6. ХІМІЧНИЙ ЗВ’ЯЗОК
6. ХІМІЧНИЙ ЗВ’ЯЗОК
6.5. Міжмолекулярна взаємодія
Існування речовин у різних агрегатних станах свідчить про те, що між частинками (атомами, молекулами, іонами) має місце взаємодія, обумовлена особливими силами. Вони названі вандерваальсовими силами на честь фізика Я. Ван-дер-Ваальса (1837 – 1923, Голандія), який вивів рівняння стану газу з урахуванням сил міжмолекулярної взаємодії.
Сили Ван-дер-Ваальса є універсальними, вони діють між будь-якими атомами, молекулами чи іонами. Навіть такий високоінертний газ як гелій He при дуже низьких температурах (–269 0С) переходить у рідкий стан, що свідчить про те, що між атомами гелію існують дуже слабкі сили міжмолекулярної взаємодії.
Виникнення сил Ван-дер-Ваальса можна пояснити виходячи з того, що навіть у електронейтральних атомі або молекул внаслідок руху електронів по орбіталях постійно виникають моментальні електричні дипольні моменти. Взаємодія дипольних моментів називається дисперсійною і характерна для всіх рідин і твердих речовин (рис. 6.13, а).
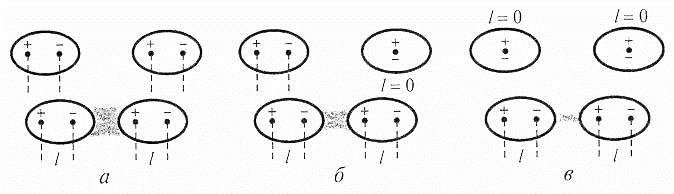
Рис. 6.13. Схема міжмолекулярної взаємодії.
Існують молекули зі сталим електричним дипольним моментом.
Розглянемо розподіл зарядів у молекулі води Н2О. Атом Оксигену несе частковий негативний заряд, який удвічі перевищує частковий позитивний заряд атомів Гідрогену, що з’єднані з ним ковалентним полярним зв’язком. Виходячи з того, що молекула води у просторі має кутову форму (див. Гібридизація), різнойменні заряди мають бути зосереджені на протилежних кінцях молекули. При наближенні двох молекул води різнойменно зарядженими краями, відбувається взаємодія, названа орієнтаційною, яка вимагає певної просторової орієнтації диполів (рис. 6.13, б).
Орієнтаційна взаємодія впливає на фізичні властивості. Речовина закипає тоді, коли вдається подолати енергію міжмолекулярної взаємодії. Чим ця енергія вища, тим сильніше слід нагрівати речовину, щоб вона закипіла. Так, температура кипіння молекулярного азоту N2 (неполярні молекули) становить ‑196 0С, а температура кипіння карбон монооксиду СО – –191,5 0С (полярні молекули).
Якщо полярна молекула стикається з неполярною, то під впливом полярної на неполярній індукується (виникає) заряд (молекула поляризується). Індукований диполь притягається до постійного диполя полярної молекули. Це – індукційна взаємодія. Прикладом такого типу міжмолекулярної взаємодії є взаємодія молекул хлороводню HCl з молекулами хлору Cl2 (рис. 6.13, в).