37. Альдегіди та кетони
Альдегіди
Визначення. Альдегідами називають органічні сполуки, молекули яких містять функціональну групу атомів >СOH, зв’язану з вуглеводневим радикалом. У найпростішому альдегіді – мурашиному Н–СОН – функціональна альдегідна група сполучена з атомом водню.
Загальна формула альдегідів R–СOH. Група атомів >С=O називається карбонілом, або карбонільною групою. Альдегіди можна розглядати як органічні сполуки, в молекулах яких ця група сполучається з вуглеводневим радикалом і з атомом водню.
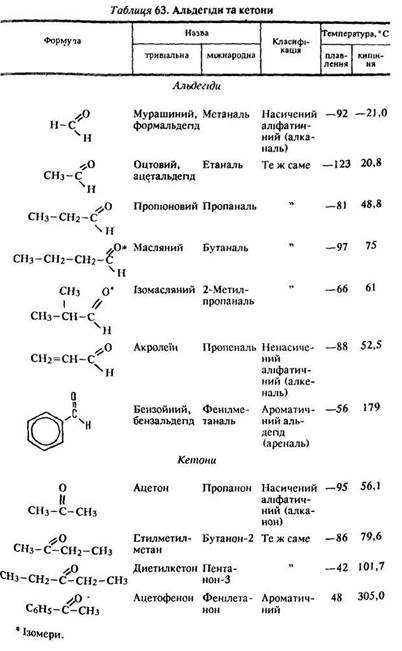
Класифікація. Альдегіди, залежно від природи вуглеводневого радикалу, утворюють гомологічні ряди: аліфатичні насичені та ненасичені – алканалі, алкеналі, алкіналі, а також ароматичні – ареналі (табл. 63).
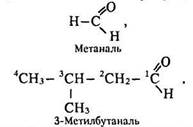
Номенклатура. Тривіальні назви альдегідів складаються з латинської назви відповідної карбонової кислоти та слова альдегід (мурашиний альдегід, оцтовий альдегід). За міжнародною номенклатурою вони утворюються від назви відповідного вуглеводню та суфіксу -аль. Під час вибору головного вуглеводневого ланцюга слід пам’ятати, що в нього має входити атом вуглецю альдегідної групи, з якого починають нумерацію:
Ізомерія. В альдегідів існує ізомерія вуглеводневого ланцюга, наприклад бутаналь і 2-метилпропаналь (див. табл. 63).
Будова молекули. В молекулі альдегіду є сигма- і пі-зв’язки. Розглянемо схему утворення цих зв’язків на прикладі оцтового альдегіду (етаналю).
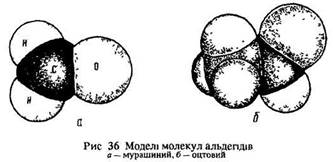
Атом вуглецю СН3-групи знаходиться в стані sp3-гібридизації (тетраедричне напрямлення ковалентних зв’язків у просторі, валентні кути 109°28') (рис. 35, 36). Він з’єднаний чотирма гібридними сигма-зв’язками з трьома атомами водню і з карбонільним атомом вуглецю. Атом вуглецю карбонільної групи пербуває в стані sр2-гібридизації (всі атоми цієї групи розміщені в одній площині, валентні кути 120°).
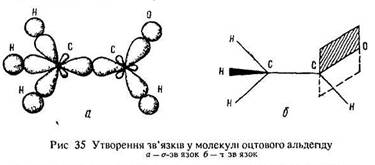
Атом вуглецю карбонільної групи з’єднаний трьома гібридними сигма-зв’язками з атомами вуглецю, водню та кисню і одним пі-зв’язком з атомом кисню. пі-Зв’язок утворюється з негібридизованого р-електрона атома вуглецю та неспареного р-електрона атома кисню. Він розташований у площині, перпендикулярній до площини сигма-зв’язків (див. рис. 35). Таким чином, атоми вуглецю та кисню в карбонільній групі з’єднані подвійним зв’язком (сигма + пі). Отже, альдегіди мають подвійний зв’язок, як і алкени.
Зв’язок між атомами вуглецю та кисню в карбонільній групі поляризований сильніше, ніж у спиртах. Це пояснюється двома причинами. По-перше, пі-зв’язок рухливіший за сигма-зв’язок, а тому легше поляризується. По-друге, в карбонільній групі кисень притягує до себе електрони лише від атома вуглецю, а в спиртовій гідроксигрупі – від вуглецю та водню.
У карбонільних групах атом вуглецю має позитивний заряд, кисню – негативний, що схематично можна показати за допомогою структурної та електронної формул альдегідів:
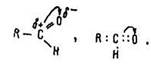
Молекули альдегідів полярні завдяки полярній карбонільній групі і здатні до асоціації. Вони не утворюють міжмолекулярних водневих зв’язків, тому що їх атом водню з’єднаний з атомом вуглецю. Такі зв’язки виникають між молекулами альдегідів і води, атоми водню яких сполучені з атомом кисню:
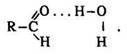
Цими явищами обумовлені фізичні властивості альдегідів.
Поширення в природі. Деякі альдегіди трапляються в природі, наприклад, ароматичний альдегід ванілін міститься в плодах ванільного дерева.
Фізичні властивості. Температури плавлення, кипіння та розчинність альдегідів у воді більші, ніж алканів, але менші ніж відповідних спиртів (див. табл. 53, 56, 62). Перший член гомологічного ряду алканалів – мурашиний альдегід – газ, наступні – рідини, вищі альдегіди – тверді речовини. Мурашиний альдегід має різкий запах, дуже отруйний.
Нижчі альдегіди добре розчиняються у воді, зі збільшенням молекулярної маси їх розчинність зменшується. Водний розчин формальдегіду з масовою часткою 40 % називається формаліном.
Хімічні властивості. Внаслідок поляризації карбонільної групи альдегіди мають велику реакційну здатність. Для карбонільної групи характерні реакції приєднання, поліконденсації і полімеризації, як і для етилену. Крім того, в альдегідах атом кисню впливає на атом водню групи >СOH, внаслідок чого той легко окислюється.
Приєднання водню. Водень приєднується по місцю подвійного зв’язку за наявності каталізатора:

Під час гідрування альдегіди відновлюються до первинних спиртів.
Полімеризація. Формальдегід полімеризується, утворює поліформальдегід – полімер лінійної структури:
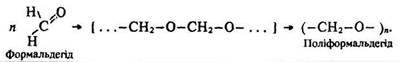
З поліформальдегіду виготовляють деталі, які замінюють металічні.
Поліконденсація. Під час нагрівання суміші альдегідів і фенолів за наявності каталізаторів (кислот або лугів) відбувається реакція поліконденсації – утворюються вода та фенолоформальдегідна смола, яка має промислове значення.
Реакцією поліконденсації називається реакція утворення високомолекулярної сполуки, внаслідок якої виділяються побічні низькомолекулярні продукти – вода, аміак, хлороводень тощо. Сполука, що утворюється, є одночасно фенолом і ароматичним спиртом. Вона вступає в реакцію з другою молекулою фенолу:
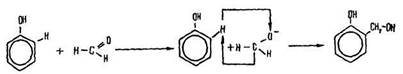
Щоб зрозуміти зміст реакції, згадаємо, що у бензольному ядрі молекули фенолу атоми водню дуже рухливі (в положеннях 2,4,6), а формальдегід здатний до реакції приєднання за місцем подвійного зв’язку С=О:
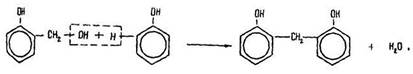
Утворена молекула містить два бензольних ядра і знову сполучається з наступною молекулою формальдегіду:
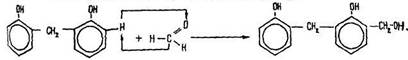
Потім знову відбувається взаємодія з молекулою фенолу і т. д. Будову утворених макромолекул можна зобразити такою формулою:
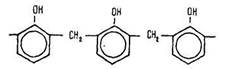
З фенолформальдегідних смол виробляють термостійкі пластмаси – фенопласти, які застосовують як теплозахисні, теплоізоляційні, антикорозійні матеріали.
Окислення. Альдегіди легко окислюються до карбонових кислот за місцем водню у групі >СOH навіть слабкими окисниками, такими, як аміачний розчин оксиду срібла або гідроксид міді (II):
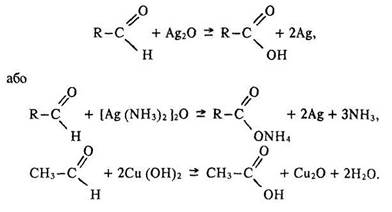
Метаналь може окислюватися за місцем двох атомів водню; утворенням вугільної кислоти, яка розкладається на диоксид вуглецю та воду:
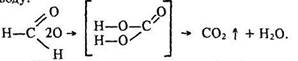
Ці реакції характеризуються зовнішніми ефектами взаємодія з оксидом срібла – утворенням «срібного дзеркала» – металічного срібла; взаємодія з гідроксидом міді (II) – випадінням осаду оксиду міді (І) червоного кольору. Тому їх використовують для якісного виявлення альдегідів.
Одержання. Загальним способом добування альдегідів є окислення спиртів. У промисловості формальдегід добувають, пропускаючи крізь реактор з розжареною мідною сіткою суміш пари метанолу з повітрям:
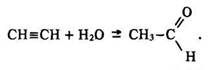
Оцтовий альдегід у промисловості добувають за реакцією Кучерова – гідратацією ацетилену за наявності солей ртуті (п. 22.5):
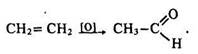
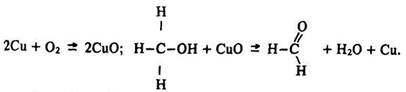
Але цей спосіб коштує дуже дорого.
Іншим способом одержання формальдегіду є окислення метану киснем повітря за температури 400 - 600° С і наявності каталізаторів – оксидів азоту:
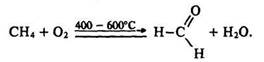
Зараз з метою охорони навколишнього середовища застосовують інші каталізатори. Розроблено економічно вигідний спосіб прямого окислення етилену до оцтового альдегіду з каталізаторами РdСl2 + Сu2Сl2 під тиском 1013 мПа і за температури 100° С:
![]()
Використання. Формальдегід широко застосовується у виробництві поліформальдегіду, фенолформальдегідних та інших смол. Він є вихідною речовиною для одержання барвників, фармацевтичних препаратів, синтетичного каучуку, вибухових речовин тощо, використовується в медицині як антисептик.
Оцтовий альдегід є важливою сировиною для добування оцтової кислоти, пластичних мас, зокрема фенопластів, лікарських речовин.