2. ОСНОВНІ ПОНЯТТЯ ХІМІЇ
2. ОСНОВНІ ПОНЯТТЯ ХІМІЇ
| Сайт: | Підготовка до ЗНО - Освітній портал "Академія" |
| Курс: | Підготовка до ЗНО з хімії |
| Книга: | 2. ОСНОВНІ ПОНЯТТЯ ХІМІЇ |
| Надруковано: | Гість |
| Дата: | Tuesday 1 July 2025 2:10 AM |
2. ОСНОВНІ ПОНЯТТЯ ХІМІЇ
Весь світ, що нас оточує, складається з різних речовин. Речовина – це сукупність певних частинок з однаковими властивостями. Речовини можуть бути однорідними (чистими) складаючись лише з одного виду частинок, або неоднорідними (сумішами) – містити у своєму складі два або більше видів частинок.
Хімія вивчає чисті речовини. Тому коли у хімії вживають терміни “водень”, “вода”, “оцтова кислота”, то вважається, що мова іде про чисті речовини, а коли кажуть “нафта”, “питна вода”, “горючий газ”, то мають на увазі природні суміші речовин. Штучні матеріали (чавун, цемент, скло) теж є сумішами.
Проте абсолютно чистих речовин не існує. Можна говорити лише про відносну чистоту речовини, яка визначається кількістю частинок сторонніх речовин (домішок) у ній.
Суміші бувають гомогенними (однорідними), у яких не можливо помітити окремі компоненти (повітря, розчини різних речовин, сплави) і гетерогенними (неоднорідними), у яких помітні їх складові (вода + пісок, залізні ошурки + крейда, вода + олія). На відміну від чистих речовин і хімічних сполук, склад сумішей може змінюватись у широких межах, причому компоненти зберігають індивідуальні властивості. За рахунок цього, суміші можна розділити на складові частини.
Основними способами розділення сумішей є: відстоювання (сумішей рідин з твердими речовинами), перегонка (дистиляція), виморожування (рідких і газових сумішей), магнітна сепарація, флотація, кристалізація (сумішей твердих речовин).
2.1. Атомно-молекулярне вчення
Уявлення про те, що всі речовини складаються з певних маленьких частинок існували ще у сиву давнину і у XVIII ст. вони сприяли виділенню хімії у самостійну науку.
Сучасні формулювання основних положень атомно-молекулярного вчення:
- Усі речовини складаються з атомів, молекул або іонів.
- Усі атоми, молекули або іони, що входять до складу речовини перебувають у безперервному русі.
- Усі речовини поділяються на прості і складні.
Розглянемо їх докладніше.
Найменшою хімічно неподільною частинкою речовини, що зберігає властивості речовини є атом (гр. atomoz – неподільний). Атоми бувають різними. Атоми певного виду мають однакові розміри, однакові властивості і відрізняються від атомів інших видів.
На сьогодні встановлено, що атоми складаються з ядра, яке розміщене в центрі атома та складається з позитивно заряджених (протонів) та нейтральних (нейтронів) частинок. Навколо ядра обертаються негативно заряджені частинки (електрони), і оскільки атоми є електронейтральними, то кількість протонів рівна кількості електронів. Тип (вид) атома визначається зарядом ядра (кількістю протонів).
Сукупність атомів з однаковим зарядом ядра називають хімічним елементом.
На сьогодні відомо понад 100 хімічних елементів, біля 90 з яких зустрічаються в природі, а решта одержані штучно, шляхом ядерних реакцій.
Кожен відомий хімічний елемент має свою назву і позначення (символ).
Перші позначення хімічних елементів були у вигляді малюнків (людей, тварин, астрологічних символів): (рис. 2.1).
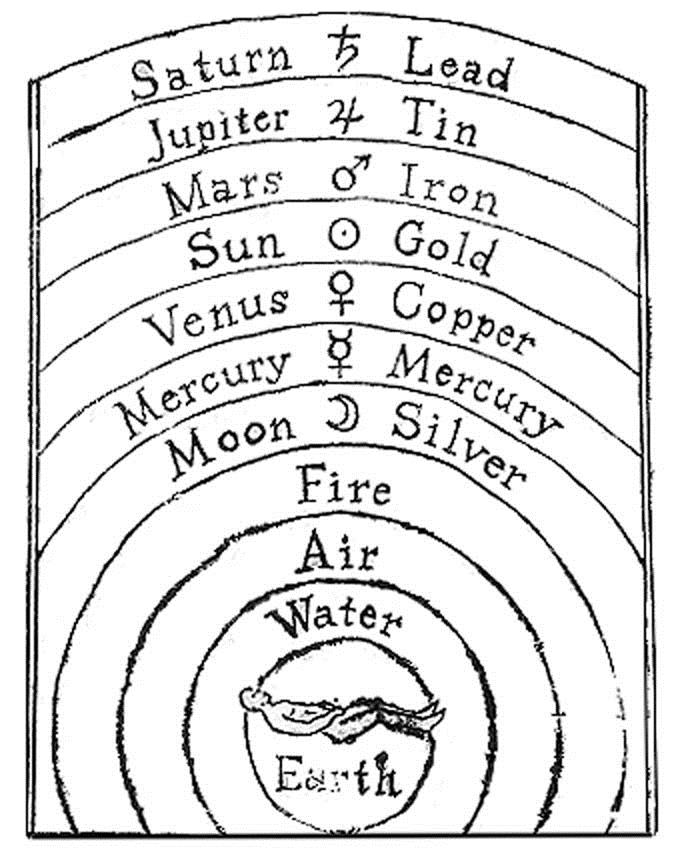
Рис. 2.1. Одна з перших алхімічних “систем хімічних елементів”, у ній символи небесних тіл та відомих на той час елементів однакові (Місяць – Аргентум, Меркурій – Меркурій, Венера – Купрум, Сонце – Аурум, Марс – Ферум, Юпітер – Станум, Сатурн – Плюмбум). До елементів відносили також Землю, Воду, Повітря та Вогонь.
Згодом, коли елементів стало більше, їх стали позначати повними латинськими назвами. Однак, якщо речовина складалась із багатьох елементів, такий запис був дуже громіздким і незручним. Тоді англ. хімік Дж. Дальтон запропонував записувати символи елементів у вигляді різних кружечків:
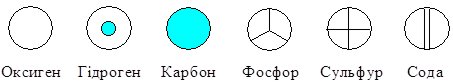
З часом елементів усе більшало і нові кружечки придумувати стало важко. Тоді Дж. Дальтон почав вписувати в кружечки перші літери англійських назв елементів:
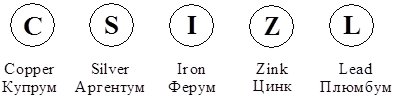
Проте і цей спосіб не набув поширення. Згодом Й. Берцеліус (1779 – 1884) запропонував позначати елемент першою літерою його латинської назви без кружечка. Якщо літера уже була зайнята, додавалась наступна. Так, Карбон (лат. Carboneum) позначають літерою С, а Кальцій і Хлор, відкриті пізніше, – двома літерами – відповідно Са (лат. Calcium) і Cl (лат. Clorum). Ця система позначень збереглася до сьогодні і символи хімічних елементів є універсальним для всіх мов.
Кілька однакових або різних атомів шляхом хімічної взаємодії сполучаються у молекулу, властивості якої відмінні від властивостей атомів, що входять до її складу.
Найменшою механічно (але не хімічно!) неподільною частинкою речовини, що зберігає всі її властивості є молекула (лат. moles – невелика маса). Поряд з цим, окремо взята молекула не обумовлює фізичних властивостей речовини, які визначаються сукупністю молекул.
Атоми у молекулі розміщені у певному порядку за допомогою хімічних зв’язків.
Речовини, що складаються з одного виду атомів (мідь – Сu, водень – Н2) називають простими.
Не слід плутати поняття “хімічний елемент” і “проста речовина”. Прості речовини можуть містити різну кількість атомів одного хімічного елемента і мати їх різне просторове розміщення. Це явище називається алотропією, а речовини – алотропними модифікаціями. Так, хімічний елемент Оксиген (О) утворює дві алотропні модифікації – кисень (О2) та озон (О3), які є простими речовинами з різними фізичними і хімічними властивостями.
Назви простих речовин, виробів з них – традиційні. Золота обручка, кисневий балон, вуглецевий ланцюг, водневий зв’язок, мідні труби тощо.
Якщо речовина складається з молекул, утворених атомами різних хімічних елементів, то її називають складною.
Складних речовин існує набагато більше, ніж простих речовин, тому що атоми різних елементів можуть сполучатись між собою у різних співвідношеннях і послідовності. Наприклад, елемент Гідроген (Н) та Оксиген (О) утворюють воду (Н2О) і гідроген пероксид (Н2О2); елементи Нітроген (N) та Оксиген (О) утворюють сполуки складу N2О, NО, N2О3, NО2, N2О4, N2О5. Ще більше таких прикладів існує в органічній хімії, де з Карбону, Гідрогену, Оксигену та ще кількох хімічних елементів утворено понад 10 млн. речовин.
Склад молекули будь-якої речовини можна виразити за допомогою хімічної формули, у якій вказується види атомів, що входять до її складу, та їх кількість. Так, наведені вище приклади сполук Гідрогену з Оксигеном та Нітрогену з Оксигеном записані з використанням хімічних формул.
2.2. Валентність атомів елементів у сполуках. Хімічні формули
Для розуміння хімічних формул та правильного їх написання, слід ознайомитись з теорією валентності.
Атоми різних хімічних елементів можуть сполучатися між собою у певних відношеннях з утворенням різних хімічних сполук.
Ці відношення визначає валентність (лат valencio – сила) – здатність атомів хімічного елемента сполучатись з певною кількістю атомів інших елементів з утворенням хімічних зв’язків. Валентність атома Гідрогену прийнято за одиницю. На основі цього можна розрахувати валентності інших елементів, знаючи хімічний склад їх сполук з Гідрогеном. Так, у молекулі HCl, яка містить атоми Хлору і Гідрогену у відношенні 1:1, Хлор одновалентний, у молекулі H2O – Оксиген двовалентний (Н:О = 2:1). Якщо елемент не утворює сполук з Гідрогеном, то його валентність можна визначити за Оксигеном, який майже завжди двовалентний, наприклад у FeO, Ферум – двовалентний, а в Al2O3 – Алюміній тривалентний.
Атоми деяких елементів виявляють змінну валентність. Так, у FeO Ферум – двовалентний, а у Fe2O3 – тривалентний (табл. 2.1).
Таблиця 2.1
Валентності атомів деяких елементів
|
Хімічний елемент |
Валентність |
Приклади формул сполук |
|
Валентність стала |
||
|
H, Li, Na, K |
І |
H2O, Na2O |
|
O, Ca, Zn |
ІІ |
CaO, ZnO |
|
Al |
ІІІ |
Al2O3 |
|
Валентність змінна |
||
|
Cu |
I i II |
Cu2O, CuO |
|
Fe, Co, Ni |
II i III |
FeO, Fe2O3 |
|
C, Sn, Pb |
II i IV |
CO, CO2 |
|
P |
III i V |
PH3, P2O5 |
|
Cr |
II, III i IV |
CrO, Cr2O3, CrO3 |
|
S |
II, IV і VI |
H2S, SO2, SO3 |
Знаючи валентності елементів можна складати хімічні формули сполук. Наприклад, відомо, що атом Сульфуру чотиривалентний, а Оксигену – двовалентний і вони утворюють сполуку SxOy. Для правильного написання формули слід над символами елементів записати їх валентності SIVxOIIy, і валентність першого атома (S) поставити нижнім індексом арабською цифрою біля атома другого (О) і навпаки (валентність атома Оксигену біля атома Сульфуру). Маємо S2O4. Даля, одержані індекси ділимо на менший з них. Якщо одержуємо ціле число (у нашому випадку 2/2 = 1 і 4/2 = 2), то записуємо значення біля символів атомів відповідних елементів, а якщо дробові – залишаємо індекси без змін. Отже, вірна формула – SO2.
Атоми можуть сполучатись не лише між собою, а і з групами атомів, які виявляють сталу валентність. Так, іони F–, Cl–, Br–, I–, NO3–,ОН– – одновалентні, SO42–, SO32–, CO32–, SiO32– – двовалентні, РО43– і ВО32– – тривалентні. Знаючи валентність цих іонів і валентність металів, можна записати формули солей (FeCl3, Al2(SO4)3 тощо).
Хімічні формули, залежно від форми запису бувають кількох видів:
- Емпіричні – вказують лише якісний і кількісний склад сполук, але не дають уявлення про їх будову (H2SO4, Н2О, С2Н4О2 тощо).
- Графічно-структурні – відображають порядок атомів у сполуках та валентність кожного елемента:
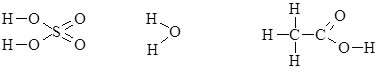
Такі формули часто застосовуються в органічній хімії.
- Електронні – вказують електронну будову атомів і молекул:
![]()
Про валентність з точки зору будови атома див. “Валентність і будова атома”.
2.3. Сучасна українська хімічна номенклатура
У 1992 р. комісія Верховної Ради України затвердила Національну комісію України з хімічної термінології та номенклатури, яка запропонувала нові принципи української хімічної номенклатури та термінології, що у 1995 р. набули значення Державного стандарту.
Хімія починається з хімічного елемента, що є “цеглинкою” будови будь-якої сполуки. Коротко зупинимось на основних принципах номенклатури елементів і простих речовин.
Хімічна номенклатура – сукупність правил утворення назв сполук, а також самі назви. Роль хімічної назви нагадує роль власного імені у житті людини – назвавши сполуку хімік дає їй “путівку в життя”.
Першу хімічні номенклатуру у 1789 р. запропонував А. Лавуазьє, включивши у неї відомі на той час 33 елементи (включаючи тепло і світло).
Назва хімічного елемента – це власна назва типу атома (аналогічно з назвами планет – Земля, Марс, географічних назв – Харків, Тернопіль), тому цю власну назву, як і символ хімічного елемента слід писати з великої літери: Н – Гідроген, Не – Гелій, О – Оксиген.
Більшість назв хімічних елементів історично пов’язані з джерелами добування (Нітроген, Кальцій), характерними властивостями (Флуор, Хлор) назвами країн (Ітербій, Рутеній, Францій), іменами вчених (Лоуренсій, Менделєєвій) тощо (додаток А).
Систематичні назви[1]* хімічних елементів, як правило, відтворюють латинську назву елемента (N – Нітроген, S – Сульфур, C – Карбон), а інколи – вимову його симовола (Cu – Купрум, Fe – Ферум, Au – Аурум, Ag – Аргентум) і тому легко сприймаються. Паралельно використовуються традиційні українські назви (табл. 2.2, виділено курсивом), оскільки існують вдалі терміни, побудовані на них: зневоднення, окиснення, азиди, вуглеводні, вуглеводи.
Назва простої речовини, що складається з одного або багатьох атомів того ж елемента – це загальна назва. Вона може збігатись, а може бути й іншою, ніж назва хімічного елемента: Не – гелій, О2 – кисень тощо.
Таблиця 2.2
Українські назви елементів та утворених ними простих речовин*
|
Символ та його вимова |
Латинська назва елемента |
Українська назва елемента |
Українська назва простої речовини |
|
Ag аргентум |
Argentum |
Аргентум Срібло |
срібло |
|
As арсен |
Arsenicum |
Арсен (миш’як) |
арсен |
|
Au аурум |
Aurum |
Аурум Золото |
золото |
|
Bi бісмут |
Bismuthum |
Бісмут (вісмут) |
бісмут |
|
C це |
Carboneum |
Карбон Вуглець |
вуглець, алмаз, графіт, карбін |
|
Cu купрум |
Cuprum |
Купрум Мідь |
мідь |
|
F фтор |
Fluorum |
Флуор (фтор) |
флуор, фтор |
|
Fe ферум |
Ferrum |
Ферум Залізо |
залізо |
|
H аш |
Hydrogenium |
Гідроген Водень |
водень |
|
Hg гідраргірум |
Hydrargirum Mercurium |
Меркурій Ртуть |
ртуть |
|
I йод |
Iodum |
Йод Іод |
йод |
|
Mn манган |
Manganum |
Манган (марганець) |
манган |
|
N ен |
Nitrogenium |
Нітроген Азот |
азот |
|
Ni нікель |
Niccolum |
Нікол Нікель |
нікель |
|
O о |
Oxygenium |
Оксиген Кисень |
кисень, озон |
|
Pb плюмбум |
Plumbum |
Плюмбум (свинець) |
свинець |
|
S ес |
Sulfur |
Сульфур Сірка |
сірка |
|
Sb стибій |
Stibium |
Стибій (сурма) |
стибій |
|
Si силіцій |
Silicium |
Силіцій (кремній) |
силіцій |
|
Sn станум |
Stannum |
Станум (олово) |
олово |
Примітка. У дужках наведені назви хімічних елементів, які раніше зустрічалися у літературі і сьогодні не застосовуються.
Номенклатуру основних класів хімічних сполук розглянуто у відповідних розділах курсу.
2.4. Відносна атомна і молекулярна маси. Масова частка елемента
Важливою характеристикою атома, окрім заряду ядра, є його маса. Величини атомних мас надзвичайно малі (наприклад, маса атома Гідрогену становить 1,674∙10-27 кг, Карбону – 1,993∙10-26 кг) і користуватись ними при обрахунках незручно. Тому на практиці використовують значення відносних атомних мас. Для цього масу певного атома порівнюють з масою еталона, яким на сьогодні є 1/12 частка маси ізотопу Карбону 12С (1,674∙10-27 кг) – атомна одиниця маси (а.о.м.) – 1,660∙10-27 г.
Відносна атомна маса – величина, яка показує, у скільки разів маса атома даного елемента більша від атомної одиниці маси.
Відносна атомна маса позначається символом “Ar” (від англ. “Аtom” i “relative” – відносний) і є безрозмірною величиною. Виходячи зі сказаного, можна записати:
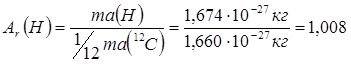
Значення відносних атомних мас кожного хімічного елемента з урахуванням його ізотопного складу наведено у Періодичній системі Д.І. Менделєєва (див. форзац). Зазвичай використовують округлені значення атомних мас, наприклад, Ar(Н) = 1, Ar(О) = 16 тощо.
Для характеристики речовин, що складаються з двох чи більше атомів однакових або різних елементів, використовують поняття “відносна молекулярна маса”. Вона показує, у скільки разів маса молекули даної речовини більша від атомної одиниці маси і позначається символом “Мr”.
Для обчислення відносної молекулярної маси речовини слід знати її якісний та кількісний склад, відомості про який записані у хімічній формулі. Так, запис Н2SO4 означає, що до складу молекули сульфатної кислоти входить два атоми Гідрогену, один атом Сульфуру і чотири атоми Оксигену. Знаючи відносні атомні маси елементів та їх кількість у молекулі, можна обчислити відносну молекулярну масу Н2SO4, яка теж є безрозмірною величиною:
![]()
Знаючи хімічну формулу та відносну молекулярну масу речовини, можна визначити відносну кількість кожного елемента у сполуці – його масову частку. Масова частка елемента може бути виражена у відсотках (%) або частках від одиниці і обчислюється за формулою:
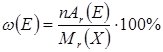 ,
,
де w(Е) – масова частка елемента Е у сполуці Х, n – кількість атомів елемента Е у сполуці Х, Ar(Е) – відносна атомна маса елемента Е, Мr(Х) – відносна молекулярна маса сполуки Х.
Розрахуємо масові частки елементів у молекулі Н2SO4:
- масова частка Гідрогену
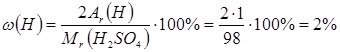 або у частках від одиниці – 0,02;
або у частках від одиниці – 0,02; - масова частка Сульфуру
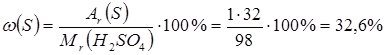 або 0,326;
або 0,326; - масова частка Оксигену
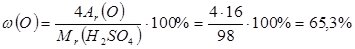 або 0,653.
або 0,653.
Сума масових часток усіх елементів, що входять до складу даної сполуки має бути рівною 100% (у випадку використання значень у відсотках) або 1 (при розрахунках у частках від одиниці).
Якщо сума незначно відрізняється від цих величин, це означає, що використовувались округлені значення масових часток елементів.
У нашому прикладі ![]() (або 0,999 в частках від одиниці), що свідчить про вищеозначене.
(або 0,999 в частках від одиниці), що свідчить про вищеозначене.
Знаючи масові частки елементів у сполуці, можна встановити її молекулярну (брутто) формулу. Нехай деяка сполука містить 40% Са, 12% С та 48% О. Поділимо масову частку кожного елемента у сполуці на його відносну молекулярну масу:
Са: 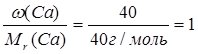 ;
;
С: 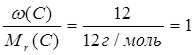 ;
;
О: 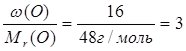 .
.
Одержані цифри вказують молярне співвідношення елементів у сполуці:
nСа : nС : nО = 1 : 1 : 3,
тобто сполука містить 1 атом Са, 1 атом С і 3 атоми О і її брутто-формула СаСО3.
2.5. Кількість речовини. Моль
Будь-яка речовина складається з визначених структурних одиниць (атомів, молекул або іонів). Наприклад, молекула водню Н2 складається з двох атомів Гідрогену, вуглекислий газ – з молекул СО2.
Кількість структурних одиниць, що утворюють певну речовину, називається кількістю речовини. Одиницею кількості речовини є моль (лат. “moles” – маса), позначається грецькою буквою n (ню). Моль – така кількість речовини, що містить стільки структурних одиниць (атомів, молекул або іонів), скільки їх є у 0,012 кг (12 г) вуглецю – 6,02∙1023 – 1 моль. Це означає, що 1 моль водню, 1 моль вуглекислого газу, 1 моль сульфатної кислоти або 1 моль будь-якої іншої сполуки містять однакову кількість молекул – 6,02∙1023.
Величина одиниці кількості речовини встановлена експериментально і названа на честь італійського фізика А. Авогадро (1776 – 1856) сталою Авогадро та позначається NA.
Якщо 1 моль речовини містить 6,02∙1023 частинок, то 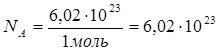 моль-1.
моль-1.
Кількість речовини n рівна відношенню кількості молекул (атомів, іонів) N даної речовини, до їх кількості в 1 моль цієї речовини NA: 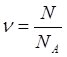 (1).
(1).
Масу m 1 моль речовини називають молярною масою і позначають літерою М: 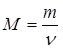 (2).
(2).
Якщо масу речовини взято у грамах, а кількість речовини – у моль, то: 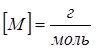 .
.
Чисельно, молярна маса речовини рівна її молекулярній (атомній) масі.
Знаючи масу речовини, можна обчислити кількість структурних одиниць, що входять до її складу. Для цього слід об’єднати формули (1) і (2):
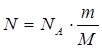 .
.