2. ОСНОВНІ ПОНЯТТЯ ХІМІЇ
2. ОСНОВНІ ПОНЯТТЯ ХІМІЇ
2.5. Кількість речовини. Моль
Будь-яка речовина складається з визначених структурних одиниць (атомів, молекул або іонів). Наприклад, молекула водню Н2 складається з двох атомів Гідрогену, вуглекислий газ – з молекул СО2.
Кількість структурних одиниць, що утворюють певну речовину, називається кількістю речовини. Одиницею кількості речовини є моль (лат. “moles” – маса), позначається грецькою буквою n (ню). Моль – така кількість речовини, що містить стільки структурних одиниць (атомів, молекул або іонів), скільки їх є у 0,012 кг (12 г) вуглецю – 6,02∙1023 – 1 моль. Це означає, що 1 моль водню, 1 моль вуглекислого газу, 1 моль сульфатної кислоти або 1 моль будь-якої іншої сполуки містять однакову кількість молекул – 6,02∙1023.
Величина одиниці кількості речовини встановлена експериментально і названа на честь італійського фізика А. Авогадро (1776 – 1856) сталою Авогадро та позначається NA.
Якщо 1 моль речовини містить 6,02∙1023 частинок, то 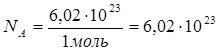 моль-1.
моль-1.
Кількість речовини n рівна відношенню кількості молекул (атомів, іонів) N даної речовини, до їх кількості в 1 моль цієї речовини NA: 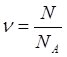 (1).
(1).
Масу m 1 моль речовини називають молярною масою і позначають літерою М: 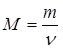 (2).
(2).
Якщо масу речовини взято у грамах, а кількість речовини – у моль, то: 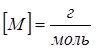 .
.
Чисельно, молярна маса речовини рівна її молекулярній (атомній) масі.
Знаючи масу речовини, можна обчислити кількість структурних одиниць, що входять до її складу. Для цього слід об’єднати формули (1) і (2):
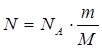 .
.