4. БУДОВА АТОМА
4. БУДОВА АТОМА
| Сайт: | Підготовка до ЗНО - Освітній портал "Академія" |
| Курс: | Підготовка до ЗНО з хімії |
| Книга: | 4. БУДОВА АТОМА |
| Надруковано: | Гість |
| Дата: | Sunday 25 May 2025 5:18 AM |
4. БУДОВА АТОМА
Після відкриття періодичного закону довгий час залишалось незрозумілим, чому властивості елементів знаходяться в періодичній залежності від їхньої відносної атомної маси. Була незрозумілою сама причина періодичності. Необхідно було з’ясувати фізичний зміст періодичного закону. Це стало можливим після встановлення будови атома.
4.1. Історія вивчення
Поняття “атом” вперше зустрічається у творах давньогрецьких філософів і означало найдрібніші, неподільні (гр. atomos – неподільний) частинки, з яких складається світ. Вважалось, що атоми вічні, здатні рухатись і мають настільки малі розміри, що виміряти їх неможливо.
Такі уявлення про атоми були поширені до початку ХХ ст. Перші докази складності будови атома були одержані при вивченні проходження електричного струму через рідини і гази (М. Фарадей). Було встановлено, що електрика існує у вигляді окремих одиничних зарядів, які під дією електричного поля у вакуумі відхиляються до катода (позитивний полюс). Ці “катодні промені” (У. Крукс, 1876 р.) – мали негативний заряд і були названі електронами (Дж. Томсон, 1907 р.). В. Рентген (1895 р.) відкрив новий вид випромінювання – електромагнітні промені (названі ним Х-промені, зараз – рентгенівське випромінювання), які випускає речовина при попаданні на неї катодних променів.
Ще одним свідченням складності будови атомів стало відкриття здатності атомів певних елементів самовільно розпадатись. Це явище дістало назву “радіоактивність” (А. Бекерель (1896 р.), подружжя Ж. Кюрі і М. Склодовська-Кюрі (1898 р.)).
Подальші відкриття ядра, протона, нейтрона, визначення зарядів елементарних частинок, надихнули вчених на створення моделей атома. Першу модель атома запропонував Дж. Томсон у 1903 р. Атом він уявляв як певну кількість позитивно зарядженої речовини – “тіло атома”, у яку вкраплені негативно заряджені електрони (як родзинки у булку) (рис. 4.1). Сумарний заряд електронів в електронейтральному атомі приймався рівним заряду позитивно зарядженого тіла атома.
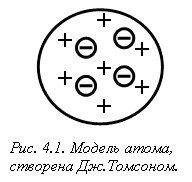
Подальше вивчення Е. Резерфордом (1907 р.) проходження a-частинок (ядра Не2+) через тонку металічну (срібну або золоту) фольгу показало, що більшість з них проходить через фольгу вільно і лише деякі змінюють траєкторію руху. Це навело вченого на думку, що атом побудований на зразок сонячної системи, тому запропонована ним модель атома була названа “планетарна модель будови атома” (рис. 4.2).
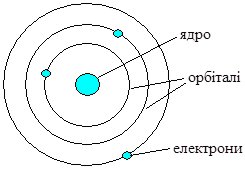
Рис. 4.2. Планетарна модель атома Е. Резерфорда
Згідно Резерфорду, у центрі системи (атома) розміщене маленьке позитивно заряджене ядро, в якому сконцентрована майже вся маса атома. Навколо ядра рухаються електрони (планети), кількість яких визначається зарядом ядра, який чисельно рівний порядковому номеру елемента у Періодичній системі Д.І. Менделєєва (Г. Мозлі, 1913 р.). Усі електрони утворюють електронну оболонку атома. Максимальна відстань від ядра атома до найдальшої точки траєкторії руху електронів визначає розмір атома – атомний радіус.
Однак, планетарна модель атома Резерфорда мала певні недоліки. Одним з найочевидніших було те, що при обертанні електрон має втрачати енергію і наближатись до ядра, врешті-решт впавши на нього, що призвело б до зникнення атома. Однак цього ніколи не відбувається.
Для усунення цієї та деяких інших суперечностей, Н. Бор (1913 р.) запропонував доповнити теорію будови атома Резерфорда постулатами (положення, які приймають без доведення):
- електрон може рухатись навколо ядра лише по певних колових – стаціонарних – орбітах;
- рухаючись по стаціонарній орбіті електрон не випромінює і не поглинає енергію.
Такі уявлення про будову атома були близькими до сучасних.
4.2. Сучасна теорія будови атома
Згідно з сучасними уявленнями ядра хімічних елементів складаються з позитивно заряджених частинок – протонів (p), і нейтральних – нейтронів (n), які разом називаються нуклони.
Заряд ядра (Z) визначається кількістю протонів (р) і рівний порядковому номеру елемента у Періодичній системі. Для забезпечення електронейтральності атома, навколо ядра рухаються негативно заряджені частинки – електрони (), кількість яких дорівнює кількості протонів. Отже, Z = p = .
Оскільки маса атома (А – масове число) зосереджена в ядрі, то А = p + n. Знаючи атомну масу елемента і його порядковий номер у Періодичній системі, використовуючи наведені відношення, можна вирахувати кількість електронів, протонів і нейтронів в атомі будь-якого елемента.
На сьогодні встановлено, що середній діаметр атомів елементів становить біля 10-10 м, а середній діаметр ядра – 10-15 м, тобто ядро менше від “свого” атома у 100 000 разів (табл. 4.1).
Таблиця 4.1
Властивості елементарних частинок, які утворюють атом
|
Частинка |
Заряд |
Маса |
||
|
Кл |
умовних одиниць |
грам |
а.о.м. |
|
|
Електрон |
–1,6*10-19 |
–1 |
9,1*10-28 |
0,00055 |
|
Протон |
1,6*10-19 |
+1 |
1,67*10-24 |
1,00728 |
|
Нейтрон |
0 |
0 |
1,67*10-24 |
1,00866 |
4.3. Ізотопи
Атоми одного елемента, які при однаковій кількості протонів та електронів відрізняються кількістю нейтронів називають ізотопами (гр. isoz – однаковий, topoz – місце).
Відомі ізотопи всіх хімічних елементів. Ізотопи бувають стабільні і радіоактивні, природні і штучні.
Кількість стабільних ізотопів може бути від 2 (у Хлору) до 10 (у Стануму). Елементи, розміщені у Періодичній системі після Бісмуту, не мають стабільних ізотопів.
Ядра радіоактивних ізотопів нестійкі, вони легко розпадаються на простіші частинки, при цьому виділяється значна кількість енергії. Особливо нестійкими є ядра з непарною кількістю протонів і нейтронів.
Природні ізотопи поширені у природі, штучні – у природі не трапляються, а утворюються у результаті ядерних реакцій.
Ізотопи записують символами відповідних хімічних елементів (Е), вказуючи зверху зліва масове число (А), а під ним порядковий номер (Z): ![]() . Назва ізотопу складається з назви елемента, який його утворює і масового числа даного ізотопу:
. Назва ізотопу складається з назви елемента, який його утворює і масового числа даного ізотопу: ![]() – Карбон-12,
– Карбон-12, ![]() – Карбон-14,
– Карбон-14, ![]() – Хлор-35,
– Хлор-35, ![]() – Хлор-37 тощо. Хімічні властивості усіх ізотопів одного елемента однакові.
– Хлор-37 тощо. Хімічні властивості усіх ізотопів одного елемента однакові.
Ядра елементів, які містять різну кількість протонів р і однакову кількість нейтронів n, називають ізотонами.
Атоми, у ядрах яких міститься різна кількість протонів р і нейтронів n, але сума (р + n) однакова (однакові масові числа), називають ізобарами.
Приклади ядер ізотопів, ізотонів та ізобарів:
Ізотопи: ![]() (6p, 6n),
(6p, 6n), ![]() (6p, 8n);
(6p, 8n);
Ізотони: ![]() (6p, 7n),
(6p, 7n), ![]() (7p, 7n);
(7p, 7n);
Ізобари: ![]() (6p, 7n),
(6p, 7n), ![]() (7p, 6n).
(7p, 6n).
На основі даних, одержаних при вивченні ізотопів, вдалося пояснити відхилення від Періодичного закону послідовності зростання атомних мас хімічних елементів та їх порядкових номерів. Середня атомна маса елемента з більшою кількістю ізотопів у деяких випадках може бути більшою, ніж середня атомна маса елемента з більшим порядковим номером. Так, Аргон (порядковий номер 18) має три ізотопи: Аргон-36, Аргон-38 і Аргон-40, однак найпоширеніший ізотоп – Аргон-40, тому середня атомна маса Аргону 39,948. У Калію (порядковий номер 19) три ізотопи: Калій-39, Калій-40 і Калій-41, але найпоширеніший легкий ізотоп – Калій-39, тому середня атомна маса Калію 39,098 і у Періодичній системі він розташований за Аргоном. З тих же причин, Co (58,933) передує Ni (58,700), Te (127,6) розміщений перед I (126,904), Th (232,038) – перед Pa (231,035). Середня атомна маса елемента визначається співвідношенням відносних кількостей його ізотопів з різними масовими числами. Це враховує залежність: ![]() , де
, де ![]() – середнє значення відносної атомної маси ізотопів даного елемента,
– середнє значення відносної атомної маси ізотопів даного елемента, ![]() – відносна атомна маса ізотопа,
– відносна атомна маса ізотопа, ![]() і – молярна частка цього ж ізотопа (у частках від 1).
і – молярна частка цього ж ізотопа (у частках від 1).
Так, у Хлору є два природні ізотопи, з масовими числами 35 (75,4%) і 37 (24,6%). На основі цих даних розраховано середню атомну масу Хлору: ![]() , або округлено 35,5.
, або округлено 35,5.
Отже, згідно зі сказаним:
Хімічний елемент – вид атомів з однаковим зарядом ядра.
Відносна атомна маса елемента у Періодичній системі – середнє значення атомних мас його ізотопів з урахуванням їх поширеності у природі.
4.4. Поведінка електрона в атомі
Сьогодні поведінка електрона в атомі пояснюється законами квантової механіки, в основи якої лежать такі основні положення:
- Електрон має подвійну (корпускулярно-хвильову) природу – може поводити себе як частинка (має масу і заряд) і як хвиля (характерні явища дифракції та інтерференції).
- Для електрона неможливо визначити точне положення в просторі у певний момент часу. Можна говорити лише про ймовірність перебування його у тій чи іншій частині простору.
Частина простору навколо ядра, у якій ймовірність перебування електрона становить понад 90% називається електронна орбіталь. Цей простір обмежується поверхнею і є об’ємною геометричною фігурою.
Розглянемо для прикладу атом Гідрогену, у якого навколо ядра обертається лише один електрон. Якщо фотографічно фіксувати положення електрона в атомі Гідрогену у різні моменти, то одержуємо картину, зображену на рис. 4.3.
Рис. 4.3. Схематичне зображення електронної орбіталі.
Простір, де зафіксовано найбільше кількість точок обмежений сферою – це орбіталь, на якій розміщений електрон. Її іноді називають електронною хмарою. Однак, іноді електрон може знаходитись і поза межами орбіталі (з ймовірністю до 10%).
У квантовій механіці для зручності орбіталь позначають квадратиком або горизонтальною рискою і називають електронною або квантовою коміркою, а електрон позначають вертикальною стрілкою (↑ або ↓). Запис ![]() або
або ![]() означає, що на орбіталі розміщений один електрон.
означає, що на орбіталі розміщений один електрон.
4.5. Квантові числа
Стан будь-якого електрона в атомі можна описати за допомогою квантових чисел. Для цього використовують головне, побічне (орбітальне), магнітне (азимутальне) та спінове квантові числа.
Головне квантове число (позначається лат. літерою n) характеризує енергію і розміри електронної орбіталі і може набувати значень від 1 до ∞.
У багатоелектронних атомах електрони з однаковими значеннями n рухаються по орбіталях з близькими розмірами та енергіями і утворюють енергетичні рівні (електронні шари, електронні рівні). Ці рівні нумерують починаючи від ядра арабськими цифрами від 1 до 7, або позначають лат. літерами від K до Q відповідно.
Кількість електронних рівнів у атома, який перебуває в основному (незбудженому) стані дорівнює номеру періоду, в якому розміщений даний елемент у Періодичній системі.
Чим менше значення n, тим менша енергія даного рівня і менший розмір орбіталі.
У межах одного рівня електрони можуть відрізнятись енергетичним підрівнями. Цю різницю відображає побічне (орбітальне) квантове число, яке визначає форму атомної орбіталі і позначається лат. літерою l.
Побічне квантове число залежить від головного і може набувати цілочисельних значень від 0 до n – 1. Так, при n = 1, l = 0, при n = 2, l = 0 і l = 1 і т.д.
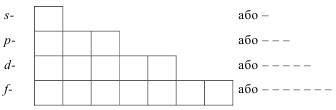
Зазвичай, числові значення l (0, 1, 2, 3, 4, 5) позначають англ. літерами s, p, d, f, g відповідно, а орбіталі називають s-, p-, d-, f- або g-орбіталями.
Кількість підрівнів в межах одного рівня дорівнює n, тому на першому електронному рівні (n = 1) може бути лише одна (n2) s-орбіталь. На другому (n = 2) рівні розміщені чотири орбіталі – одна s- і три р-орбіталі. d-Орбіталі з’являються на третьому (n = 3), а f-орбіталі на четвертому (n = 4) електронному рівнях і містять відповідно по 5 та 7 орбіталей.
При l = 0, s-орбіталь має сферичну форму (рис. 3, а). При l = 1, p‑орбіталь має форму гантелі (рис. 3. б). d-, f- i g-орбіталі відповідають значенням l = 2, l = 3 і l = 4.
Просторове розміщення орбіталі визначає магнітне (азимутальне) квантове число (позначається m або ml). Його значення залежить від l і змінюється від –l до + l, включаючи 0, тобто кожному значенню l відповідає (2l+1) значень m.
Так, якщо l = 0, то m = 0 і s-орбіталь може мати лише одне просторове розміщення (рис. 4.4, а).
Для l = 1, m = –1, 0, +1 і р-орбіталь має три можливі варіанти просторової орієнтації (рx- рy- рz-орбіталі). Осі симетрії р-орбіталей розміщені під кутом 90 0 одна відносно одної, що досягається взаємним відштовхуванням р‑електронів і забезпечує максимальну однакову відстань між усіма р‑орбіталями одного електронного рівня (рис. 4.4, б).
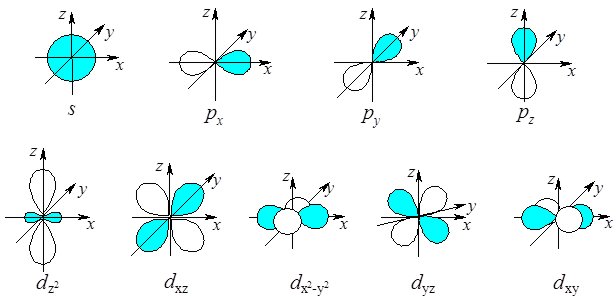
Рис. 4.4. Форми s-, p- і d-орбіталей.
При l = 2, m = –2, –1, 0, +1, +2, тобто d-орбіталей є п’ять (рис. 4.4, в), а f‑орбіталей (l = 3, m = –3, –2, –1, 0, +1, +2, +3) – сім.
Таким чином, в межах одного енергетичного рівня максимально можуть бути одна s-, три p-, п’ять d- і сім f-орбіталей. Загальна кількість орбіталей (N) на енергетичному рівні визначається формулою: N = n2, де n – головне квантове число.
Графічно s-, p-, d- і f-орбіталі зображають:
Для повної характеристики електрона в атомі у 1925 р. ввели спінове квантове число (позначається s або ms), яке характеризує можливість обертання електрона навколо своєї осі (аналогічно з добовим обертанням Землі). Якщо електрон обертається за годинниковою стрілкою (вправо), то s = +½, якщо проти (вліво) – то s = –½ (рис. 4.5).
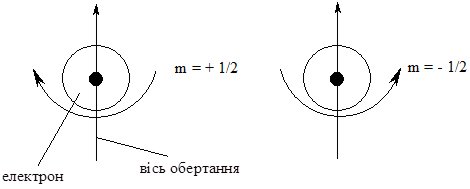
Рис. 4.5. Схема визначення спінового квантового числа.
На одній орбіталі може бути лише 2 електрони зі значеннями s = +½ та s = –½. Якщо s = +½, то графічно електрон зображають ![]() , а якщо s = –½, то
, а якщо s = –½, то ![]() . Коли на орбіталі розміщені два електрони, то їх зображають з антипаралельними (протилежно спрямованими) спінами:
. Коли на орбіталі розміщені два електрони, то їх зображають з антипаралельними (протилежно спрямованими) спінами: ![]() .
.
4.6. Розподіл електронів у багатоелектронних атомах
Послідовність заповнення електронами атомних орбіталей в багатоелектронних атомах базується на:
- Принципі найменшої енергії.
- Правилах Клечковського.
- Принципі Паулі.
- Правилі Гунда.
- Правилі симетрії.
Розглянемо їх докладніше.
Принцип найменшої енергії.
Основною умовою стабільної електронної конфігурації атома є заповнення електронами атомних орбіталей по мірі зростання їх енергії. Тобто, кожен наступний електрон займає вільну атомну орбіталь з найменшою енергією. Послідовність заповнення орбіталей (зростання їх енергії) визначається правилами Клечковського.
Перше правило Клечковського.
Заповнення електронами енергетичних підрівнів відбувається по мірі зростання суми (n + l) – головного і побічного квантових чисел.
Якщо для двох атомних орбіталей значення (n + l) однакові, то згідно з другим правилом Клечковського, першою заповнюється електронами атомна орбіталь з меншим значенням n (головного квантового числа).
Для визначення послідовності заповнення електронами атомних орбіталей, вираховують енергію кожної орбіталі за сумою (n + l) (табл. 4.2 і рис. 4.6).
Таблиця 4.2
Послідовність заповнення електронами орбіталей в багатоелектронному атомі згідно з правилами Клечковського
|
Енергія |
Мінімальна |
Енергії 4f- і 5d-підрівнів близькі |
Енергії 5f- і 6d-підрівнів близькі |
Макси-мальна |
|||||||||||||||
|
Підрівень |
1s |
2s |
2p |
3s |
3p |
4s |
3d |
4p |
5s |
4d |
5p |
6s |
4f |
5d |
6p |
7s |
5f |
6d |
7p |
|
n |
1 |
2 |
2 |
3 |
3 |
4 |
3 |
4 |
5 |
4 |
5 |
6 |
4 |
5 |
6 |
7 |
5 |
6 |
7 |
|
l |
0 |
0 |
1 |
0 |
1 |
0 |
2 |
1 |
0 |
2 |
1 |
0 |
3 |
2 |
1 |
0 |
3 |
2 |
1 |
|
n + l |
1 |
2 |
3 |
3 |
4 |
4 |
5 |
5 |
5 |
6 |
6 |
6 |
7 |
7 |
7 |
7 |
8 |
8 |
8 |
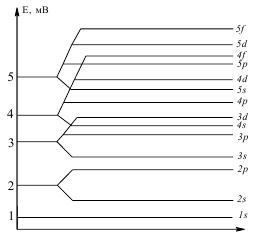
Рис. 4.6. Зміна енергії атомних орбіталей зі зростанням суми (n + l).
Як видно з рис. 4.6, близькі значення енергії мають 4s- і 3d-, 5s- і 4d- та 5p- і 4f-орбіталі (тобто однакову суму (n + l)), але згідно другого правила Клечковського заповнення відбувається в порядку зростання значення n.
Згідно принципу Паулі в атомі не може бути електронів з однаковим значенням всіх чотирьох квантових чисел. Оскільки електрон характеризується лише одним набором (n, l, m, s) квантових чисел, а одній орбіталі відповідає три (n, l, m) квантових числа, то згідно принципу Паулі для конкретної атомної орбіталі можливо стільки станів електрона, скільки значень має четверте квантове число (s – спінове, два значення). Тому на одній атомній орбіталі може одночасно перебувати не більше двох електронів. Графічно це показано на рис. 4.7. Сумарний спін спарених електронів рівний 0 (–½ + ½ = 0), а неспареного – +½.
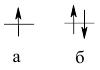
Рис. 4.7. Розміщення неспареного (а) і спарених електронів на орбіталі.
Кількість електронів (N) на даному енергетичному рівні (n), визначається залежністю N = 2n2, де n – головне квантове число.
Звідси випливає, що на першому енергетичному рівні (n = 1) може знаходитись N = 2×12 = 2 електрони на 1s-підрівні, на другому (n = 2) – N = 2×22 = 8 (2 електрони на 2s і 6 – на 2p підрівнях) і т.д. (табл. 4.3).
Таблиця 4.3
Максимальна кількість електронів на електронних рівнях і підрівнях
|
Енергетичний рівень |
Енергетичний підрівень |
Можливі значення магнітного квантового числа m |
Кількість орбіталей |
Максимальна кількість електронів |
||
|
у підрівні |
у рівні |
на підрівні |
на рівні |
|||
|
K (n = 1) |
s (l = 0) |
0 |
1 |
1 |
2 |
2 |
|
L (n = 2) |
s (l = 0) p (l = 1) |
0 –1, 0, +1 |
1 3 |
4 |
2 6 |
8 |
|
M (n = 3) |
s (l = 0) p (l = 1) d (l = 2) |
0 –1, 0, +1 –2, –1, 0, +1, +2 |
1 3 5 |
9 |
2 6 10 |
18 |
|
N (n = 4) |
s (l = 0) p (l = 1) d (l = 2) f (l = 3) |
0 –1, 0, +1 –2, –1, 0, +1, +2 –3, –2, –1, 0, +1, +2, +3 |
1 3 5 7 |
16 |
2 6 10 14 |
32 |
Згідно правила Гунда, найстійкішим станом атома є такий, у якому сумарний спін усіх його електронів максимальний.
Розглянемо це на прикладі атома Нітрогену, який містить 7 електронів. По 2 електрони розмістяться на 1s- i 2s-орбіталях, а ще 3 електрони можуть зайняти 2p-орбіталь у таких варіантах:
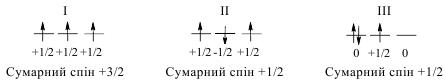
Як бачимо, лише у варіанті І, сумарний спін максимальний (+3/2). Тому така конфігурація є найстійкішою, а стан атома – основний. ІІ і ІІІ стани атома Нітрогену, коли сумарний спін не є максимальним, називають збудженими.
Правило симетрії.
На електронну будову деяких атомів впливає симетрія розподілу електронів по атомних орбіталях електронних підрівнів. Електронна конфігурація повністю і наполовину заповнених електронами підрівнів енергетично вигідніша, тому реалізація таких конфігурації ймовірніша, ніж конфігурацій з незавершеними підрівнями.
Утворення симетричних електронних конфігурацій можливе при переході електрона з одного електронного рівня на інший – явище електронного провалу.
Найчастіше “провалюються” електрони з близьких за енергіями s‑підрівнів наступного на d-підрівні попереднього електронного рівня. Це спостерігається у атомів Хрому, Купруму (з 4s- на 3d-підрівень), Молібдену, Аргентуму та Паладію (з 5s- на 4d-підрівень).
Приклади написання електронно-графічних формул атомів елементів за наведеними правилами представлені у п. “Електронні конфігурації та електронно-графічні формули елементів І – IV періодів”.