5. ПЕРІОДИЧНИЙ ЗАКОН І ПЕРІОДИЧНА СИСТЕМА ХІМІЧНИХ ЕЛЕМЕНТІВ Д.І. МЕНДЕЛЄЄВА
5. ПЕРІОДИЧНИЙ ЗАКОН І ПЕРІОДИЧНА СИСТЕМА ХІМІЧНИХ ЕЛЕМЕНТІВ Д.І. МЕНДЕЛЄЄВА
| Website: | Підготовка до ЗНО - Освітній портал "Академія" |
| Kurs: | Підготовка до ЗНО з хімії |
| Buch: | 5. ПЕРІОДИЧНИЙ ЗАКОН І ПЕРІОДИЧНА СИСТЕМА ХІМІЧНИХ ЕЛЕМЕНТІВ Д.І. МЕНДЕЛЄЄВА |
| Gedruckt von: | Gast |
| Datum: | Sunday, 25. May 2025, 05:36 |
Inhaltsverzeichnis
- 5. ПЕРІОДИЧНИЙ ЗАКОН І ПЕРІОДИЧНА СИСТЕМА ХІМІЧНИХ ЕЛЕМЕНТІВ Д.І. МЕНДЕЛЄЄВА
- 5.1. Перші спроби класифікації хімічних елементів
- 5.2. Відкриття Періодичного закону і Періодичної системи хімічних елементів Д.І. Менделєєвим
- 5.3. Структура Періодичної системи хімічних елементів
- 5.4. Електронні конфігурації та електронно-графічні формули елементів І – IV періодів
- 5.5. Періодичність зміни фізичних та хімічних властивостей елементів
- 5.6. Зв’язок електронної будови атома з положенням у Періодичній системі
- 5.7. Значення Періодичного закону і Періодичної системи хімічних елементів Д.І. Менделєєва
- 5.8. Радіоактивність. Ядерні реакції
5. ПЕРІОДИЧНИЙ ЗАКОН І ПЕРІОДИЧНА СИСТЕМА ХІМІЧНИХ ЕЛЕМЕНТІВ Д.І. МЕНДЕЛЄЄВА
Періодична система елементів - класифікація хімічних елементів, розроблена на основі періодичного закону.
Періодичний закон — фундаментальний закон природи, який визначає, що властивості хімічних елементів, простих речовин, а також склад і властивості сполук перебувають у періодичній залежності від значень зарядів ядер атомів.
5.1. Перші спроби класифікації хімічних елементів
У другій половині ХІХ ст. було відомо понад 60 хімічних елементів. Властивості простих речовин (тих, які вдалось виділити у чистому вигляді) і їх сполук необхідно було систематизувати.
При спробах класифікувати відомі елементи за основу брались схожі властивості, атомна маса і валентність, на основі яких елементи об’єднували в групи.
Так на основі схожості властивостей, А.Лавуаз’є та І. Берцеліус класифікували елементи на метали і неметали.
І. Деберейнер (1829 р., Німеччина) об’єднав по три схожих за властивостями елементи у “тріади”.
У 1857 р англ. У. Олдінг, а у 1862 р. фр. А. Шанкуртуа розмістили всі відомі елементи у порядку зростання їх атомних мас і виявили періодичність зміни їх хімічних властивостей.
У 1864 р. англ. Дж. Ньюлендс оголосив про відкриття закону “октав” – схожість властивостей кожного сьомого елемента.
Найближче до відкриття періодичного закону підійшов Л. Мейєр. Він опублікував таблицю (1864 р.), у якій 44 із 64 відомих елементів розмістив у шести групах згідно зростання атомних мас і їх вищій валентності за Гідрогеном. Основними недоліками таблиці Мейєра були відсутність наукової класифікації елементів і відсутність місця для нових елементів.
5.2. Відкриття Періодичного закону і Періодичної системи хімічних елементів Д.І. Менделєєвим
Усі розглянуті вище класифікації не давали відповіді на найважливіше запитання – у чому причина періодичної зміни властивостей хімічних елементів та їх сполук? Це спробував зробити Д.І. Менделєєв.
Основною характеристикою атома, яку вибрав Д.І. Менделєєв при побудові Періодичної системи була атомна маса.
Розмістивши усі відомі на той час елементи в порядку зростання їх атомних мас (табл. 5.1) він помітив, що схожі за властивостями сполуки зустрічаються через правильні інтервали, тобто властивості періодично повторюються.
Таблиця 5.1
Розміщення елементів за заростанням їх атомних мас
|
Символ елемента |
F |
Na |
Mg |
|
Cl |
K |
Ca |
|
Br |
Rb |
Sr |
|
I |
Cs |
Ba |
|
Атомна маса |
19 |
23 |
24 |
|
35,5 |
39 |
40 |
|
80 |
85 |
87 |
|
127 |
133 |
137 |
Це стало основою Періодичного закону (1869 р.): властивості простих тіл та властивості сполук елементів перебувають у періодичній залежності від величини атомних ваг.
Розглянемо зміну властивостей наведених елементів. Кожна трійка починається одновалентним елементом, який у сполуці з Гідрогеном утворює сильну кислоту. Далі ідуть одновалентні елементи – активні метали, які взаємодіють з водою з утворенням лугів. За ними розміщені двовалентні метали, які у хімічному відношенні є менш активними. У такій послідовності змінюються і форми сполук.
Якщо елементи зі схожими властивостями розмістити один над одним, так, щоб зверху був елемент з меншою атомною масою, одержуємо таку картину:
|
F |
Na |
Mg |
|
Cl |
K |
Ca |
|
Br |
Rb |
Ca |
|
I |
Cs |
Ba |
Горизонтальний ряд елементів, розміщених в порядку зростання атомних мас (від галогену до лужноземельного металу), було названо періодом (F – Mg, Cl – Ca тощо).
Вертикальний ряд елементів, зі схожими властивостями, розміщених в порядку зростання атомних мас, Д.І. Менделєєв назвав групою (F – I, Mg – Ba тощо).
Таке розміщення елементів називається Періодична система – графічне зображення Періодичного закону.
Однак, чітку класифікацію утруднювало те, що не всі хімічні елементи були відомі на той час, а для багатьох з них атомні маси були встановлені неточно.
Д.І. Менделєєв справився з цією проблемою: у своїй Періодичній системі він залишив місця для ще не відкритих елементів, існування і властивості яких передбачив, виходячи із структури Періодичної системи. Усі ці елементи (Екабор, Екаалюміній, Екасиліцій) були відкриті ще за життя вченого (відповідно Галій, Скандій, Германій).
На основі Періодичної системи, Д.І. Менделєєв виправив невірно визначені атомні маси елементів та їх валентність (наприклад, у Be: атомну масу з 13 на 9, валентність – з ІІІ на ІІ).
Це підтвердило правильність передбачення Д.І. Менделєєва, що фізичні і хімічні властивості простих речовин та їх сполук є періодичною функцією атомної маси елементів.
Так 1 березня 1869 року російським вченим Дмитром Івановичем Менделєєвим був відкритий Періодичний закон – новий закон природи.
Подальші дослідження будови атома та ізотопів показали, що головною характеристикою елемента є не атомна маса, а заряд ядра, який рівний порядковому номеру елемента у Періодичній системі. Тому сучасне формулювання Періодичного закону звучить так: властивості хімічних елементів, а також форми і властивості їх сполук перебувають у періодичній залежності від заряду ядра атома.
5.3. Структура Періодичної системи хімічних елементів
Першим варіантом Періодичної системи, який запропонував Д.І. Менделєєв, був довгоперіодний варіант, у якому періоди були розміщені в одну лінію. Пізніше він опублікував короткоперіодну форму, де періоди ділились на ряди, а групи на підгрупи.
Зараз найчастіше використовують напівдовгий варіант Періодичної системи, який є, по-суті, короткоперіодним варіантом, у якому для зручності лантаноїди та актиноїди винесені окремо. Надалі будемо користуватись саме таким варіантом Періодичної системи.
У сучасній Періодичній системі міститься 110 хімічний елементів, кожен з яких займає певне місце, згідно порядкового номера (заряду ядра). Для кожного елемента зазначено його символ, назву, порядковий номер та середню відносну атомну масу або масу найстабільнішого ізотопу.
Періодична система складається з семи горизонтальних періодів, перші три з яких (1 – 3) містять по одному ряду елементів і тому є малими. Решта періодів (4 – 7) є великими, вони містять по два ряди елементів.
Кожен період починається лужним металом і закінчується благородним газом. Лише перший період починається з неметалу, а сьомий – ще не завершений.
Елементи перших трьох періодів називають типовими, їх властивості плавно змінюються від типового металу до благородного газу.
У великих періодах властивості елементів плавно змінюються лише у непарних рядах (5, 7 і 9). У парних рядах (4, 6, 8, 10) розміщені метали і періодичність зміни їх властивостей малопомітна.
Лантаноїди розміщені окремим рядом внизу таблиці. Їх властивості яких схожі з Лантаном, у довгоперіодному варіанті Періодичної системи вони розміщені відразу після нього і є елементами 6 періоду.
Аналогічно розташовані і актиноїди – елементи 7 періоду, з властивостями, аналогічними Актинію.
У 1 періоді міститься 2 елементи, у 2 – 8, 3 – 8, 4 – 18, 4 – 18, 6 – 32, 7 – 21 (незавершений період).
По вертикалі у Періодичній системі розміщено вісім груп, які позначають римськими цифрами І – VIІІ. В межах кожної групи виділяють головну (або А) і побічну (або В) підгрупу.
Номер групи, як правило, рівний максимальному позитивному ступеню окиснення елемента. Винятками є Флуор (елемент VIІА групи, ступінь окиснення – 1), Купрум (ІА, +2), Аргентум (ІА, +1), Аурум (І А, +3); серед елементів VIІІ В групи, ступінь окиснення +8 характерний лише для Осмію, Рутенію та Ксенону.
Елементи головної та побічної підгруп у межах групи розташовані по різні сторони вертикального ряду (головної – зліва, побічної – справа). На рис. 5.1 це показано на прикладі VIІ групи.
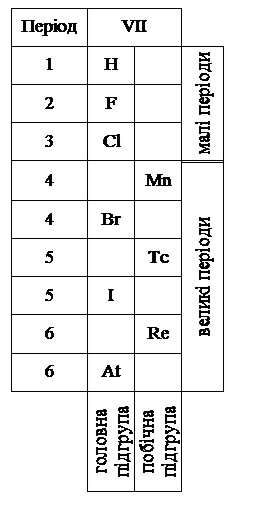
Рис. 5.1. Структура VII групи.
У головних підгрупах розміщені типові елементи (2 і 3 періодів) і схожі за властивостями елементи великих періодів.
У побічних підгрупах розташовані елементи-метали великих періодів.
Властивості елементів головної та побічної підгрупи в межах однієї групи дуже відмінні. Так, у VIІА підгрупі розміщені неметали – галогени (F, Cl, Br, I, At), а у VIІВ підгрупі – метали (Mn, Tc, Re).
У ІІІВ підгрупі розміщені елементи 6 періоду (лантаноїди) та 7 періоду (актиноїди).
VIIВ підгрупа містить три побічні підгрупи (підгрупи Феруму, Кобальту та Ніколу).
Часто зустрічаються історичні назви окремих груп і підгруп Періодичної системи: ІА підгрупа – лужні метали, ІІА – лужноземельні метали, ІІІВ (лантаноїди та актиноїди) – рідкісноземельні метали, VА – пніктогени, VIА – халькогени, VIІА – галогени, VIІІА – благородні гази.
Характеризувати положення елемента у Періодичній системі слід за такою схемою (для прикладу поряд наведено характеристику Мангану):
|
Період – Ряд – Група – Підгрупа – Порядковий номер (заряд ядра) – |
4 4 VII В 25 |
5.4. Електронні конфігурації та електронно-графічні формули елементів І – IV періодів
Розподіл електронів в атомах по електронних рівнях і підрівнях називають електронною конфігурацією атома, яка визначає його хімічні властивості, і на її основі ці властивості можна передбачити.
Графічно електронну конфігурацію зображають електронно-графічними формулами, які складають на основі правил розподілу електронів у багатоелектронних атомах.
Розглянемо електронні конфігурації атомів малих періодів.
Зазначимо, що загальна кількість електронів в атомі рівна порядковому номеру в Періодичній системі (заряду ядра).
Електронні конфігурації атомів елементів І періоду.
У першому періоді розташовані два елементи – Гідроген (заряд ядра +1) та Гелій (+2), у них відповідно є 1 та 2 електрони, які згідно з принципом найменшої енергії займають першу орбіталь електронного рівня з найменшою енергією – 1s орбіталь.
Для атома Гідрогену електронна формула записується 1s1, де 1 – номер електронного рівня, s – електронна орбіталь, 1 – кількість електронів на даній орбіталі. Електронна конфігурація атома Гелію – 1s2. Згідно принципу Паулі електронні та електронно-графічні формули атомів Гідрогену та Гелію записують так:

+1Н 1s1 +2He 1s2
Оскільки на 1s-електронному рівні максимально може міститись два електрони, то в атома Гелію він є завершеним і дуже стійким. Справді, у хімічному відношенні Гелій – найінернтніший з усіх відомих елементів.
Електронні конфігурації атомів елементів ІІ періоду.
У першого елемента 3 періоду – Літію з’являється ще один електрон, який займає наступний електронний шар. На другому електронному рівні є дві s-та три р-орбіталі. За принципом найменшої енергії електрон займає 2s-орбіталь. Електронна конфігурація атома Літію:
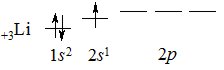
+3Li 1s2 2s1
Надалі знак заряду ядра та незаповнені орбіталі будемо опускати.
Як бачимо, конфігурація першого електронного рівня аналогічна електронній конфігурації атома Гелію. Тому часто замість завершених електронних рівнів у квадратних дужках вказують символ елемента – благородного газу попереднього періоду: Li [Не] 2s1.
У наступного елемента – Берилію, четвертий електрон теж займає 2s-орбіталь:
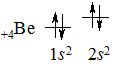
+4Be 1s22s2 або [Не] 2s2
Далі для спрощення будемо показувати лише ті рівні, які заповнюються частково.
Елементи, у яких заповнюється електронами s-підрівень, називають s-елементами.
У наступних елементів другого періоду (Бору, Карбону, Нітрогену, Оксигену, Флуору та Неону) заповнюється електронами 2р-підрівень. Для прикладу наведемо електронну конфігурацію атомів Нітрогену:
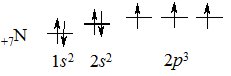
+17N [Не] 2s22р3
та Неону:
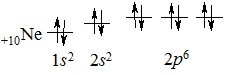
+10Ne 1s2 2s2 2р6
Елементи, у яких заповнюється р-підрівень, називають р-елементами.
Електронні конфігурації атомів елементів ІІІ періоду.
У елементів третього періоду електронами починає заповнюватись 3s- (Na, Mg – s-елементи), а потім – 3р-підрівень (Al, Si, P, Cl, Ar – р-елементи). Електронна конфігурація атома Аргону, у якого завершений зовнішній електронний шар:
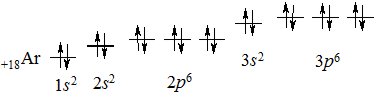
+18Ar 1s22s22р63s23р6
У цьому періоду не заповнюються d-орбіталі.
Електронні конфігурації атомів елементів ІV періоду.
У елементів четвертого періоду електрони починають заповнювати 4s-орбіталі (K, Ca).
У наступних елементів згідно правил Клечковського починають заповнюватись d-орбіталі.
Елементи, у яких заповнюється d-підрівень, називають d-елементами.
Першим d-елементом є скандій, у якого на d-орбіталі з’являється перший електрон:
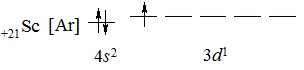
+21Sc [Ar] 4s23d1
У атома Хрому на 3d-підрівні мало б знаходитись 4 електрони, однак згідно правилу симетрії, для утворення стійкого наполовину заповненого електронами 3d-підрівня, один 4s-електрон переходить на 3d-підрівень з вищою енергією. Електронна структура атома Хрому:
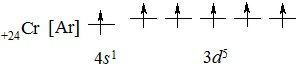
+24Cr [Ar] 4s13d5
Схожа картина спостерігається у атома Купруму: 4s-електрон переходить на 3d-підрівень з утворенням стійкої конфігурації:
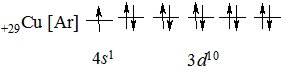
+29Cu [Ar] 4s13d10
Завершує родину d-елементів Цинк, у якого завершений d-підрівень містить 10 електронів:
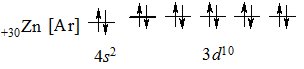
+30Zn [Ar] 4s23d10
У наступного елемента – Галію починає заповнюватись електронами 4р-підрівень:
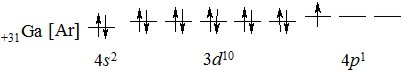
+31Ga [Ar] 4s23d104р1
Завершується четвертий період благородним газом Криптоном, у якого 4р-підрівень повністю заповнений електронами:
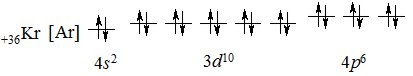
+36Kr [Ar] 4s23d104р6
4f-Підрівень, який з’явився у елементів четвертого періоду починає заповнюватись шостому періоді, починаючи з Церію.
Елементи, у яких заповнюється f-підрівень, називають f-елементами.
У елементів п’ятого періоду заповнення електронних оболонок відбувається аналогічно елементам четвертого періоду, а 5f-підрівень починає заповнюватись у елементів сьомого періоду.
5.5. Періодичність зміни фізичних та хімічних властивостей елементів
Схожість властивостей атомів елементів зумовлена схожістю їх електронних конфігурацій і розподілом електронів по зовнішніх орбіталях. Це виявляється у періодичному повторенні елементів із схожими властивостями зі зростанням заряду їх ядра. Такі властивості називають періодичними.
Розглянемо періодичність зміни властивостей на прикладі атомів елементів третього періоду (табл. 5.3).
Таблиця 5.3
Деякі властивості атомів елементів третього періоду
|
Символ |
Na |
Mg |
Al |
Si |
P |
S |
Cl |
Ar |
|
Група |
I |
II |
III |
IV |
V |
VI |
VII |
VII |
|
Заряд ядра |
+11 |
+12 |
+13 |
+14 |
+15 |
+16 |
+17 |
+17 |
|
Електронна конфігурація [Ne]… |
3s1 |
3s2 |
3s23p1 |
3s23p2 |
3s23p3 |
3s23p4 |
3s23p5 |
3s23p6 |
|
Радіус атома, м∙10-12 |
171 |
128 |
131 |
107 |
92 |
81 |
70 |
66 |
|
Енергія іонізації, Еі1, еВ |
5,14 |
7,65 |
5,99 |
8,15 |
10,49 |
10,36 |
12,97 |
15,76 |
|
Спорідненість до електрона, Еs1, еВ, |
0,3 |
–0,2 |
0,2 |
1,8 |
0,8 |
2,1 |
3,6 |
–0,4 |
|
Відносна електронегативність |
0,9 |
1,2 |
1,6 |
1,9 |
2,2 |
2,6 |
2,8 |
– |
Атом кожного елемента цього періоду містить три енергетичні рівні. Зі зростанням заряду ядра зростає кількість електронів на зовнішньому електронному рівні, за рахунок чого вони сильніше притягаються до ядра, що веде до зменшення атомного радіуса і відірвати зовнішні електрони стає все важче. Енергія, яку необхідно затратити, щоб відірвати електрон від електронейтрального атома, перетворивши його в позитивно заряджений іон (катіон) називається енергією іонізації (позначається Еі).
З відривом кожного електрона зростає позитивний заряд катіона, і для відриву наступного електрона затрачається все більше енергії, тому значення кожної наступної енергія іонізації більше за попереднє: Еі1< Еі2< Еі3< Еіn.
Порівнявши значення Еі1 атомів елементів третього періоду, бачимо, що вони плавно зростають від Натрію до Алюмінію. Винятком є атоми Магнію зі стійкою конфігурацією 3s2, Фосфору (3р3) і Аргону (3р6). Легкість віддачі електрона є мірою металічності – чим менша Еі, тим ближче атом даного елемента до металів. З табл. 5.3 видно, що найнижчі Еі у атомів з малою кількістю електронів на зовнішньому електронному рівні (від 1 до 3).
Зі зростанням Еі1 послаблюються металічні і посилюються неметалічні властивості.
Мірою неметалічності є спорідненість до електрона. Це – кількість енергії, що виділяється або поглинається при приєднанні одного електрона до нейтрального атома з перетворенням його в негативно заряджений іон – аніон (позначається Еs). Оскільки з приєднанням кожного електрона негативний заряд іона зростає, а позитивний заряд ядра не змінюється, то приєднувати кожен наступний електрон стає все важче, тому кожне наступне значення енергії спорідненості до електрона більше за попереднє: Еs1< Еs2< Еs3< Еsn.
Значення Еs1 для атомів елементів третього періоду наведені у табл. 5.3. Чим більше значення Еs1, тим характерніші для атома даного елемента неметалічні властивості. Причини відхилення від плавної зміни Еs1 у атомів Магнію, Фосфору та Аргону, такі ж як у випадку Еі1.
Ще однією характеристикою металічних (або неметалічних) властивостей є електронегативність – здатність атомів притягати до себе електрони. Позначається гр. літерою χ (хі). Розраховується як півсума значення Еі1 + Еs1: ![]() . Одержують абсолютне значення електронегативності, яким на практиці користуватись незручно. Тому за пропозицією американського вченого Л. Полінга, електронегативність атома літію приймають за одиницю – χLi = 1. Порівнюючи з нею електронегативність атомів інших елементів одержують значення відносних електронегативностей атомів.
. Одержують абсолютне значення електронегативності, яким на практиці користуватись незручно. Тому за пропозицією американського вченого Л. Полінга, електронегативність атома літію приймають за одиницю – χLi = 1. Порівнюючи з нею електронегативність атомів інших елементів одержують значення відносних електронегативностей атомів.
Зміна електронегативностей у атомів елементів в межах групи аналогічні вищеозначеним змінам Еі1 і Еs1 (табл. 5.3).
Зазначені закономірності спостерігаються в атомів елементів усіх періодів, однак у великих періодах зміна більш плавна, за рахунок заповнення електронами d- i f-підрівнів.
В межах групи елементи мають однакову будову зовнішнього електронного рівня і схожі хімічні властивості. Зі зростанням заряду ядра зростає кількість електронних рівнів, що у свою чергу веде до зменшення Еі1, Еs1 та c. Тобто в групі зі зростанням заряду ядра зростають металічні властивості (табл. 5.4).
Таблиця 5.4
Деякі властивості елементів VII B підгрупи
|
Символ |
F |
Cl |
Br |
I |
At |
|
Період |
1 |
2 |
3 |
4 |
5 |
|
Заряд ядра |
+9 |
+17 |
+35 |
+53 |
+85 |
|
Електронна конфігурація зовнішнього рівня |
2s22p5 |
3s23p5 |
4s24p5 |
5s25p5 |
6s26p5 |
|
Радіус атома, м∙10-12 |
64 |
99 |
114 |
133 |
– |
|
Енергія іонізації, Еі1, еВ |
17,42 |
12,97 |
11,84 |
10,45 |
10,49 |
|
Спорідненість до електрона, Еs1, еВ, |
3,45 |
3,60 |
3,37 |
3,08 |
2,80 |
|
Відносна електронегативність |
4,1 |
2,8 |
2,7 |
2,2 |
1,9 |
Проілюструємо сказане схемою 5.1.
Схема 5.1.
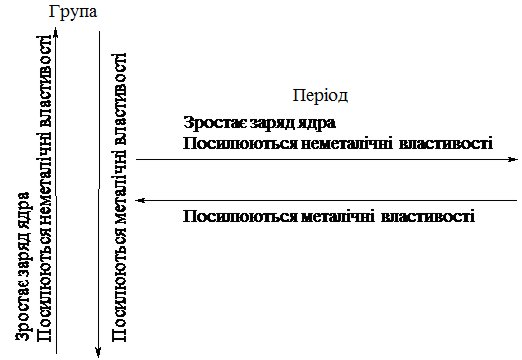
Згідно схеми, найсильніші металічні властивості виявляє Цезій, а неметалічні – Флуор.
З окресленого випливає, що періодичність зміни властивостей елементів обумовлена періодичною зміною кількості електронів на зовнішньому електронному рівні і зростанням заряду ядра атома – це фізичний зміст Періодичного закону.
5.6. Зв’язок електронної будови атома з положенням у Періодичній системі
Знаючи положення елемента у Періодичній системі можна визначити його електронну будову і навпаки – за електронною структурою визначити його положення у Періодичній системі.
Для цього використовують такі закономірності:
- Кількість електронних рівнів атомів одного періоду в основному (незбудженому) стані рівна номеру періоду.
- У головних (А) підгрупах кількість електронів на зовнішньому електронному рівні рівна номеру групи (крім Гелію).
- В елементів побічних (В) підгруп ІІІ – VІІ груп сума s-електронів останнього та d-електронів передостаннього електронного рівня рівна номеру групи.
- В елементів побічних (В) підгруп І і ІІ груп внаслідок “електронного провалу” d-підрівень завершений, а кількість електронів на s-підрівні наступного електронного рівня рівна номеру групи.
- В елементів головних (А) підгруп електронами заповнюється рівень, номер якого рівний номеру періоду.
- В елементів побічних (В) підгруп електронами заповнюється рівень, номер якого на одиницю менший від номера періоду.
- Максимальна кількість електронів в атомі елемента 1 періоду – 2, 2 – 8, 3 – 8, 4 – 18, 5 – 18, 6 – 32, 7 – 32. Відповідну кількість елементів містить кожен період.
Проілюструємо сказане прикладами.
Приклад 1. Елемент з електронною конфігурацією останнього електронного рівня 3s23p5 міститься у ІІІ періоді (електронами заповнюється 3 енергетичний рівень), VII групі (сума електронів останнього електронного рівня рівна 7). Це – р-елемент головної (А) підгрупи (електронами заповнюється р-підрівень), неметал (велика кількість валентних електронів – 5). Повна електронна структура атома: 1s22s23s23p5. Заряд ядра рівний сумі електронів – +17 і є порядковим номером елемента у Періодичній системі.
Приклад 2. Елемент з порядковим номером 25 має заряд ядра +25 і містить 25 електронів. Запишемо його електронну конфігурацію, використовуючи правила Клечковського:
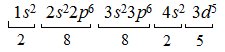
Це – елемент VII групи (сума s-електронів передостаннього і d-електронів останнього рівня дорівнює 7), d-елемент побічної (В) підгрупи (електронами заповнюється d-підрівень), 3 періоду (валентні електрони містяться на 3 електронному рівні). Метал (на зовнішньому (4s) електронному рівні міститься мало електронів – 2).
Як бачимо, існує тісний зв’язок між електронною структурою атомів елементів та їх положенням у Періодичній системі елементів, що ще раз підтверджує об’єктивні зв’язки, які існують у природі.
5.7. Значення Періодичного закону і Періодичної системи хімічних елементів Д.І. Менделєєва
Відкриття Періодичної системи та Періодичного закону хімічних елементів здійснило значний вплив на розвиток усіх хімічних наук. Це – природна класифікація хімічних елементів, яка показує їх тісний зв’язок один з одним.
Найбільше значення Періодичної системи полягає в можливості передбачення на її основі існування нових елементів. На основі Періодичної системи передбачено існування елементів з порядковими номерами від 1 до 97, між якими уже не може бути жодного елемента, що доведено сучасними дослідженнями і ще раз підтвердило правильність поглядів Д.І. Менделєєва. У наш час на основі Періодичної системи прогнозують властивості елементів 7 періоду.
Д.І. Менделєєв використав Періодичну систему для виправлення атомних мас 20 елементів, щоб вони змогли зайняти відповідні місця у ній. Так, елементу Цезію раніше приписували атомну масу 123, а Менделєєв визначив, що за властивостями Цезій має розташовуватись в ІА підгрупі, під Рубідієм і мати атомну масу 130. Сучасними методами встановлено, що атомна маса Цезію становить 132,9054.
На основі Періодичної системи спрогнозовані і згодом синтезовані трансуранові (ті, що лежать після Урану) елементи з порядковими номерами більшими за 92.
З появою Періодичного закону і Періодичної системи прискорився розвиток вчення про будову атома. Це вчення встановило фізичний зміст Періодичної системи і пояснило розміщення атомів хімічних елементів у ній з точки зору будови атома.
Періодичний закон і Періодична система хімічних елементів покладені в основу вивчення хімічних дисциплін в усіх навчальних закладах України і світу.
За положенням елемента у Періодичний системі можна визначити будову атома будь-якого елемента і передбачити властивості простої речовини та хімічних сполук.
Періодичний закон – один з фундаментальних законів природи і має велике значення для розуміння науковцями матеріального світу.
5.8. Радіоактивність. Ядерні реакції
Атом хімічного елемента зберігає свою індивідуальність, поки залишається незмінним його ядро. Незважаючи на надзвичайно малі розміри, ядра атомів можуть ділитись.
Відомості про поділ ядер атомів елементів одержані при вивченні радіоактивності.
Вперше радіоактивність спостерігав у 1896 р. фр. вчений А. Беккерель, який виявив, що уран випромінює особливу енергію, яку пізніше назвали радіоактивною.
Радіоактивність – самовільне перетворення нестійкого ізотопу одного хімічного елемента в ізотоп(и) іншого(их) елемента(ів), що супроводжується випусканням елементарних частинок.
Перетворення ядер атомів елементів відбуваються в процесі ядерних реакцій.
Радіоактивність, яку виявляють природні ізотопи називають природною, а штучні – штучною. Радіоактивні процеси відбуваються у різних ізотопів з різною швидкістю.
Характеристиками радіоактивного розпаду є:
- Стійкість ядер. Якщо Z2/Ar > 3, де Z – заряд ядра, Ar – атомна маса елемента, то ядро нестійке і легко розпадається.
- Період напіврозпаду (t1/2) – час, за який розпадається половина початкової кількості ядер радіоактивного елемента. Так, період напіврозпаду Радону становить 3,85 діб, Урану – 4,5 млрд. років.
Якщо кількість атомів вихідного елемента позначити m0, кількість атомів, що залишилась через час t – mt, то:
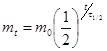
Найважливішими видами радіоактивного розпаду є:
- α-Розпад – радіоактивний розпад ядер атомів, що супроводжується випусканням α-частинок (ядер Гелію
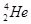 ):
): 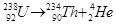 . При цьому заряд ядра зменшується на 2, а масове число – на 4.
. При цьому заряд ядра зменшується на 2, а масове число – на 4. - β-Розпад – розпад атомних ядер, що супроводжується випусканням β-частинок (потік електронів
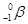 ):
): 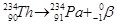 . При цьому заряд ядра зростає на 1, а масове число не змінюється, оскільки кількість нейтронів і протонів залишається сталою.
. При цьому заряд ядра зростає на 1, а масове число не змінюється, оскільки кількість нейтронів і протонів залишається сталою. - β+-Розпад (позитронний розпад) – розпад з виділенням позитрона
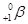 :
: 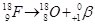 . Масове число не змінюється, а заряд ядра зменшується на 1.
. Масове число не змінюється, а заряд ядра зменшується на 1. - γ-Розпад – виділення електромагнітних хвиль при α- і β-розпадах, при цьому зменшується енергія ядра, а заряд і масове число залишаються незмінними:
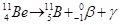 .
.
В основі ядерних реакцій, як і в основі хімічних перетворень лежать закони збереження маси та енергії. Тому при записі ядерних реакцій треба слідкувати, щоб сума зарядів (нижні індекси) реагентів та продуктів реакції і сумарна маса частинок (верхні індекси) до і після реакції були однакові. В останньому прикладі: заряди 11 = 11 + 0, масові числа 4 = 5 + (–1).
У природі відомі ряди радіоактивних перетворень: ряд Урану (![]() ), ряд Торію (
), ряд Торію (![]() ), ряд Актинію (
), ряд Актинію (![]() ).
).
Розглянуті нами реакції є реакціями ядерного розпаду.
Вперше штучну реакцію ядерного синтезу здійснив у 1912 р. Е. Резерфорд бомбардуванням ядер атомів Нітрогену α-частинками (ядрами ![]() ):
): ![]() .
.
За допомогою реакцій ядерного синтезу одержано елементи, які не зустрічаються в природі, наприклад: ![]() .
.
Отже, ядерні реакції синтезу – взаємодія ядер атомів хімічних елементів з елементарними частинками, g-випромінюванням або з ядрами інших елементів.
У ядерних реакціях символи хімічних елементів записують як ізотопи, а елементарні частинки, згідно наведеної форми (табл. 5.5).
Таблиця 5.5
Форма запису деяких елементарних частинок

Ядерні реакції і радіоактивність широко застосовуються у різних галузях науки і техніки.
Радіоактивність використовують для виявлення витоку рідин з труб, для лікування злоякісних пухлин.
Радіоактивні ізотопи застосовують при вивченні механізмів реакцій методом “мічених атомів” (див. “Естери”, “Фотосинтез”), для визначення віку органічних решток.
Ядерні реакції використовують для синтезу нових трансуранових елементів.
Енергію ядерних реакцій використовують в атомних електростанціях і ракетних двигунах.