6. ХІМІЧНИЙ ЗВ’ЯЗОК
6. ХІМІЧНИЙ ЗВ’ЯЗОК
| Сайт: | Підготовка до ЗНО - Освітній портал "Академія" |
| Курс: | Підготовка до ЗНО з хімії |
| Книга: | 6. ХІМІЧНИЙ ЗВ’ЯЗОК |
| Напечатано:: | Гость |
| Дата: | Thursday, 3 July 2025, 11:13 |
6. ХІМІЧНИЙ ЗВ’ЯЗОК
За звичайних умов лише атоми благородних газів знаходяться у незв’язаному одноатомному стані.
Атоми інших елементів взаємодіють один з одним утворюючи молекули, іони, радикали. Ця взаємодія обумовлена електростатичними силами, які виникають між електронами і ядрами різних атомів елементів. Основну роль тут відіграють електрони, розміщені на зовнішньому електронному рівні, які слабше зв’язані з ядром – валентні електрони. Тому при розгляді природи зв’язків, основну увагу акцентують на електронній структурі атомів.
На сьогодні відомо, що високу хімічну стійкість благородних газів обумовлюють їх завершені електронні оболонки, які містять 2 (дублет у Гелію) або 8 (октет у Неону, Аргону, Криптону, Ксенону, Радону) електронів.
Атоми, які містять на зовнішньому електронному рівні менше 8 (іноді менше 2) електронів прагнуть набути завершеної електронної конфігурації благородного газу (дублету – атоми елементів 1 періоду, або октету – атоми елементів інших періодів) шляхом утворення сіпальних електронних пар, віддачі або приєднання електронів.
В результаті цього утворюється хімічний зв’язок. Утворення хімічного зв’язку супроводжується зменшенням енергії системи, порівняно з сумарним значенням енергії окремих атомів, що утворюють цю систему.
Хімічний зв’язок – сукупність явищ, які утримують атоми елементів у просторі в певному положенні і на певній віддалі так, що вони утворюють стійкі молекули, іони, кристали тощо.
Основними типами хімічного зв’язку є ковалентний, іонний, металічний.
Розглянемо кожен з них.
6.1. Ковалентний зв’язок
Найпростішим прикладом виникнення хімічного зв’язку є утворення молекули водню з атомів Гідрогену.
Неполярний ковалентний зв’язок.
Навколо ядра кожного атома Гідрогену по сферичні орбіталі обертається один електрон (1s1). Електронний рівень незавершений, атому не вистачає одного електрона, щоб набути завершеної конфігурації дублету (як у атома Гелію – 1s2). При зближення двох атомів Гідрогену відбувається часткове перекривання орбіталей. Між центрами обох ядер, виникає область підвищеної електронної густини, у якій взаємодіють електрони з протилежними спінами з утворенням спільної електронної пари (рис. 6.1):
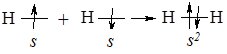
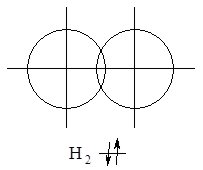
Рис. 6.1. Схема перекривання s-орбіталей атома Гідрогену при утворенні молекули Н2.
Якщо електрон позначити крапкою, а електронну пару – двокрапкою, то схема набуде вигляду:
Н· + ·Н = Н![]() Н
Н
Іноді спільну електронну пару позначають рискою, наприклад Н—Н. Спільну електронну пару називають поділеною.
Відстань між атомами Гідрогену в молекулі менша, ніж сума атомних радіусів окремих атомів (див. Довжина зв’язку).
У результаті утворення хімічного зв’язку виділяється енергія, а кожен атом Гідрогену набуває завершеної електронної конфігурації – 1s2.
Іншим прикладом є утворення ковалентного зв’язку в молекулі фтору F2. На зовнішньому електронному рівні у Флуору міститься 7 електронів (+9F 1s22s22р5), з яких неспареним є один електрон 2р-підрівня:
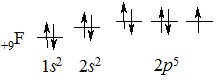
При зближенні атомів Флуору перекриваються р-орбіталі з неспареним електроном, утворюючи спільну електронну пару, а кожен атом Флуору набуває стійкої завершеної електронної конфігурації, як у Неону 1s22s22р6 (октету) утворивши спільну електронну пару:
![]()
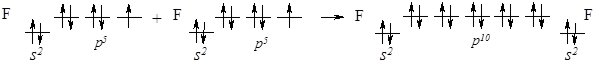
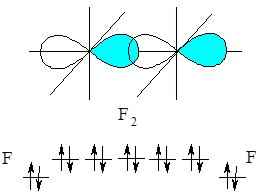
Рис. 6.2. Перекривання р-орбіталей атома Флуору з утворенням s-зв’язку.
Електронні пари, які не брали участі в утворенні хімічного зв’язку, називають неподіленими.
Іноді між атомами утворюється два (подвійний) або три (потрійний) хімічних зв’язки. Такі зв’язки називають кратними. Розглянемо кратні зв’язки на прикладі утворення молекули азоту N2 з атомів Нітрогену.
Електронна конфігурація атома Нітрогену:
+17N [Не] 2s22р3
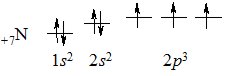
В утворенні зв’язків беруть участь усі неспарені електрони обох атомів Нітрогену:
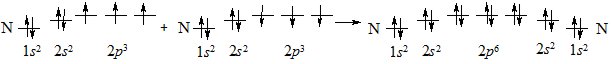
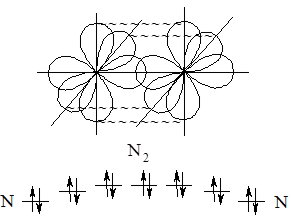
Рис. 6.3. Утворення потрійного зв’язку в молекулі азоту при перекриванні р-орбіталей та просторове розташування утворених зв’язків.
Очевидно, що кратні зв’язки будуть міцнішими, ніж одинарні, причому чим більша кратність, тим міцніший зв’язок.
Ковалентним називають зв’язок, утворений однією або кількома спільним електронними парами.
Якщо зв’язок лежить на лінії, що з’єднує ядра атомів, то він називається s (сігма)-зв’язком. Одинарний зв’язок (утворений однією спільною парою електронів) завжди є s-зв’язком.
У молекулі азоту лише один з трьох зв’язків лежить на цій лінії, а інші розташовані по обидва боки від лінії, що сполучає ядра атомів. Такі зв’язки називають p (пі)-зв’язками.
При виникненні ковалентного зв’язку між атомами з однаковою електронегативністю, спільна електронна пара у просторі симетрично розташовується відносно ядер атомів, що утворили цей зв’язок. Такий ковалентний зв’язок називають неполярним.
Полярний ковалентний зв’язок.
Якщо ж ковалентний зв’язок виникає між атомами елементів з різним значенням електронегативностей, електронна пара у просторі розташовується несиметрично, а зв’язок називають ковалентний полярний.
Розглянемо механізм виникнення ковалентного полярного зв’язку на прикладі утворення молекули гідроген фториду HF.
При взаємодії атома Гідрогену, який має неспарений електрон на s‑орбіталі з атомом Флуору, який має з неспарений р-електрон, при утворенні хімічного зв’язку перекриваються ці орбіталі:
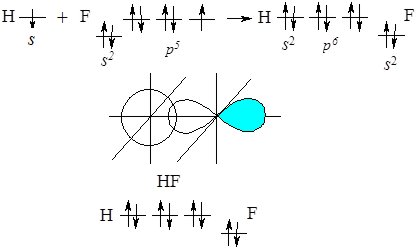
Рис. 6.4. Перекривання орбіталей атома Гідрогену та Флуору.
![]()
На схемі стрілкою показано напрям зміщення спільної електронної пари до більш електронегативного атома Флуору. За рахунок цього на ньому виникає надлишковий негативний заряд, а на атомі Гідрогену – позитивний.
Такий механізм утворення ковалентного зв’язку іноді називають обмінним.
Донорно-акцепторний механізм виникнення ковалентного зв’язку.
Ковалентний зв’язок за донорно-акцепторним механізмом виникає між атомами, один з яких містить неподілену пару електронів, а інший – незайняту (вакантну) орбіталь. Атом, який надає для утворення зв’язку неподілену пару електронів називається донором електронної пари, а який надає орбіталь (тобто приймає цю електронну пару) – акцептором електронної пари.
Схематично це можна зобразити так (А – акцептор, D – донор):
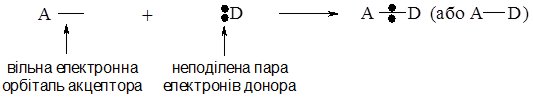
Простим прикладом донорно-акцепторної взаємодії є утворення іона амонію NH4+. Як відомо, такий іон утворюється при взаємодії аміаку NH3 з кислотами за схемою:
NH3 + Н+ = NH4+
У молекулі NH3 атом Нітрогену має неподілену електронну пару, а іон Гідрогену Н+, який входить до складу кислот – вільну електронну орбіталь (див. схему утворення НF). Завдяки цьому молекула NH3 виступає донором електронної пари, а іон H+ – її акцептором. При утворенні зв’язку, неподілена електронна пара стає спільною для атомів Нітрогену та Гідрогену, при цьому утворюється іон амонію NH4+:
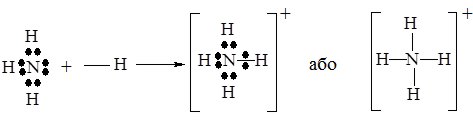
В утвореному катіоні NH4+ всі зв’язки N–H ідентичні.
Як бачимо, валентність атома Нітрогену рівна 4, що більше, ніж кількість неспарених електронів. Тому у випадках, коли елемент утворює ковалентні зв’язки за донорно-акцепторним механізмом, його валентність визначається загальною кількістю орбіталей на зовнішньому електронному рівні У атома Нітрогену їх чотири – одна 2s- і три 2р-орбіталі.
Іншими прикладами виникнення ковалентного зв’язку за розглянутим механізмом є утворення іонів гідроксонію Н3О+, BF4- та комплексних сполук.
За звичайних умов ковалентні сполуки можуть бути твердими речовинами (молекулярний йод І2, глюкоза С6Н12О6), рідинами (вода Н2О, молекулярний бром Br2), газами (F2, HCl, NH3, CH3Cl). У них низькі (порівняно зі сполуками з іонним та металічним типами зв’язку) температури плавлення та кипіння.
Речовини з ковалентним неполярним зв’язком розчиняються в неполярних розчинниках (бром Br2 розчиняється в тетрахлорметані CCl4, бензені С6Н6), а з полярним – у полярних (хлороводень HCl, етанол С2H5OH – у воді Н2О) (див. Розчини).
6.2. Основні характеристики ковалентного зв’язку
Найважливішими характеристиками ковалентного зв’язку є кратність, довжина та енергія (табл. 6.1).
Кратність зв’язку описана при розгляді утворення молекули азоту N2.
Довжина зв’язку – найкоротша відстань між ядрами атомів, які утворюють ковалентний зв’язок. Чим менша довжина зв’язку, тим він міцніший.
Кратні зв’язки завжди коротші від одинарних, тому міцніші. Чим вища кратність тим більша міцність.
Енергія зв’язку – кількість енергії, яка необхідна для його розриву, або яка виділяється при його утворенні.
Енергія характеризує міцність зв’язку і вимірюється в кДж/моль.
Таблиця 6.1.
Кратність, довжина та енергія зв’язків у деяких молекулах
|
Молекула |
Атоми, між якими виникає зв’язок |
Довжина, м∙10-12 |
Енергія, кДж/моль |
|
N2 |
NºN |
109 |
949 |
|
CO |
C=O |
113 |
941 |
|
HF |
H–F |
91 |
559 |
|
H2 |
H–H |
74 |
443 |
|
CO2 |
O=C=O |
131 |
347 |
|
Br2 |
Br–Br |
228 |
190 |
Іншими характеристиками ковалентного зв’язку є полярність, спрямованість у просторі та насиченість.
Насиченість зв’язку – здатність атомів утворювати певну кількість хімічних зв’язків. Завдяки цьому молекули мають чіткий склад і структуру.
Полярність зв’язку – асиметричний розподіл електронної хмари між ядрами атомів по осі зв’язку. Зміщення електронної хмари до більш електронегативного атома називається поляризацією, а зв’язок полярним (див. Ковалентний полярний зв’язок, схема утворення молекули HF). Електронна хмара зміщується тим сильніше, чим більша різниця електронегативностей атомів, між якими утворений хімічний зв’язок.
Коли різниця електронегативностей перевищує 1,8, то ковалентний зв’язок переходить в іонний.
Спрямованість ковалентного зв’язку обумовлює просторову структуру молекул і визначається валентним кутом (кут між лініями зв’язку атомів у молекулі).
Очевидно, двоатомні молекули матимуть лінійну форму (Н2, HF, N2).
Утворення валентного кута розглянемо на прикладі молекули H2S.
Утворення молекули H2S з атомів Гідрогену та Сульфуру схематично зображається так:
+1H 1s1 +1H 1s1
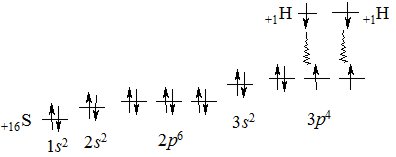
+16S 1s22s22р63s23р4
Ковалентні зв’язки атом Сульфуру утворює з рахунок неспарених електронів двох 3р-орбіталей, які у просторі розташовані під кутом 90 0 (див. Квантові числа). Саме ці орбіталі взаємодіють з орбіталями атомів Гідрогену і при перекриванні утворюють два ковалентні полярні s-зв’язки, розташовані під кутом один відносно одного (рис. 6.5).
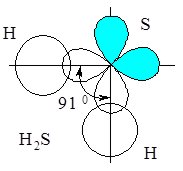
Рис. 6.5. Схема просторового розміщення орбіталей у молекулі Н2S.
Цей кут мав би дорівнювати куту між р-орбіталями (90 0), однак насправді він трохи більший (~ 91 0), за рахунок відштовхування позитивно заряджених атомів Гідрогену.
Розглядаючи аналогічні сполуки Гідрогену з іншими елементами VIA підгрупи, слід відмітити, що валентний кут зростає із зменшенням радіуса центрального атома і відповідним зменшенням довжини зв’язку (табл. 6.2).
Таблиця 6.2.
Залежність валентного кута від радіуса центрального атома у гідридів елементів VIA підгрупи
|
Центральний атом |
Сполука |
Радіус центрального атома, м∙10-12 |
Валентний кут, 0 |
|
O |
H2O |
66 |
104,5 |
|
S |
H2S |
104 |
92 |
|
Se |
H2Se |
117 |
91 |
|
Te |
H2Te |
137 |
90 |
|
Po |
H2Po |
159 |
90 |
Нижче докладніше описана геометрія молекул.
6.3. Гібридизація атомних орбіталей та геометрія молекул
Орбіталі деяких атомів у процесі утворення хімічного зв’язку змінюють свою форму, енергію та просторову орієнтацію, внаслідок чого збільшується область перекривання електронних хмар і зв’язок стає міцнішим.
Незважаючи на те, що в утворенні хімічного зв’язку беруть участь орбіталі різної форми та просторової орієнтації (s-, p-, d- та f-орбіталі), у сполуках ці орбіталі є рівноцінними.
Для пояснення цього явища американський вчений Л. Полінг у 1931 р. ввів поняття “гібридизація” – вирівнювання різних атомних орбіталей за формою та енергією при утворенні хімічного зв’язку.
Гібридизація може бурти кількох видів. Розглянемо кожен з них на прикладі молекул BeCl2, BF3 та NH3.
В основному (незбудженому) стані конфігурація зовнішнього електронного рівня атома Берилію записується 2s22р0. Перехід атома у збуджений стан веде до розпарування 2s2-електронів і переходу одного з них на 2р-підрівень:
+4Be 1s22s22p0 → +4Be 1s22s22p0
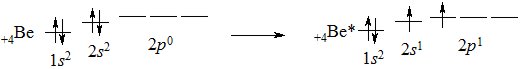
У збудженому стані атом Берилію може приєднати два атоми Хлору, у яких на зовнішньому електронному рівні знаходиться по 1 неспареному електрону. Енергія, що виділяється при утворенні двох s-зв’язків, компенсує енерговитрати на переведення атома Берилію у збуджений стан (перехід електрона з 2s- на 2р-підрівень). Обидва зв’язки Be – Cl однаково міцні і розміщені в просторі під кутом 180 0. Це пояснюється тим, що різні за формою та енергією s- та р-орбіталі атома Берилію гібридизувались – вирівнялись за формою та енергією і набули максимально віддаленого у просторі розміщення периферійних областей.
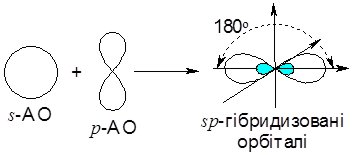
Рис. 6.6. Схемa гібридизації s- та р-орбіталей атома Берилію.
Зазначимо, що кількість гібридизованих орбіталей завжди рівна кількості вихідних (негібридизованих) орбіталей.
Якщо у процесі гібридизації беруть участь одна s- та одна р-орбіталі центрального атома (як розглянутому нами випадку), цей тип гібридизації називається sр-гібридизацією, а утворені орбіталі – sр-гібридизованими. Такі орбіталі завжди розташовані у просторі під кутом 180 0, за рахунок чого молекули при цьому мають лінійну форму. Для прикладу на рис. 6.7. зображена молекула BeCl2.
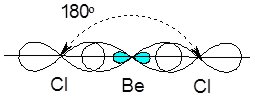
Рис.6.7. Просторове розташування sp-гібридизованих орбіталей у молекулі BeCl2.
В атома Берилію у збудженому стані конфігурація зовнішнього електронного рівня записується 2s12р2 (один 2s-електрон переходить на 2р-орбіталь). Гібридизації зазнає одна s- і дві р-орбіталі, тому у цьому випадку має місце sр2-гібридизація.
Внаслідок цього процесу утворюються три sр2-гібридизовані орбіталі, розташовані у просторі під кутом 120 0:
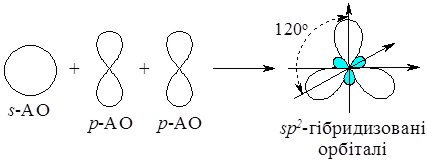
Рис. 6.8. Утворення sр2-гібридизованих орбіталей атома Бору.
Зв’язки в молекулі BF3 утворюються за рахунок одного 2s-, двох 2р-електронів атома Бору та по одному 2р-електрону кожного атома Флуору. В просторі молекула має форму трикутника:
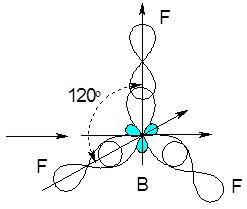
Рис. 6.9. Просторова конфігурація молекули трифториду бору BF3.
При утворенні зв’язків N – H у молекулі NH3 відбувається гібридизація однієї s- і трьох р-орбіталей атома Нітрогену. Утворюються чотири sp3-гібридизовані орбіталі, три з яких утворюють зв’язки з атомами Гідрогену, а четверту займає неподілена електронна пара атома Нітрогену.
Молекула NH3 має форму трикутної піраміди з атомом Нітрогену на вершині:
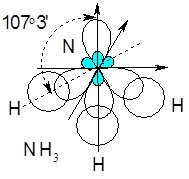
Рис. 6.10. Просторова конфігурації молекули NH3
Валентний кут НNH повинен був становити 109,5 0, однак насправді його значення 107,5 0, що пояснюється впливом неподіленої електронної пари атома Нітрогену. Аналогічне пояснення відхилення валентного кута НОН у молекулі води Н2О (104,5 0) за рахунок відштовхування двох неподілених електронних пар атома Оксигену.
Один атом може утворювати різні гібридизовані стани. Це розглянуто на прикладі атома Карбону в розділі “Органічна хімія”.
Геометрію молекул різного типу наведено в табл. 6.3.
Таблиця 6.3
Просторова конфігурація деяких молекул
|
Тип молекули |
Просторова структура |
Валентний кут, 0 |
Приклади сполук |
|
АВ2 |
кутова |
> 90 |
H2O, H2S |
|
лінійна |
180 |
BeCl2, MgBr2, CO2 |
|
|
AB3 |
пірамідальна |
107,5 |
NH3, PCl3, AsH3 |
|
трикутна |
120 |
BCl3 |
|
|
АВ4 |
тетраедрична |
109,5 |
CH4, CCl4, SiH4 |
6.4. Іонний зв’язок
Як зазначалось при розгляді полярності зв’язку якщо різниця електронегативностей атомів, між якими виникає хімічний зв’язок, перевищує 1,8, ковалентний зв’язок набуває граничної поляризації і стає іонним.
При утворенні іонного зв’язку електрон від менш електронегативного атома повністю зміщується до більш електронегативного. Внаслідок цього перший атом стає позитивно зарядженим (катіон), а другий – негативно (аніон).
Розглянемо механізм утворення іонного зв’язку на прикладі молекули цезій фториду CsF (електронегативність атома Цезію 0,93, атома Флуору – 4, різниця Δχ = 3,07).
У атома Цезію конфігурація останнього електронного рівня 6s1. Для набуття стійкої електронної конфігурації благородного газу 6 періоду – Радону – 6s26p6 – йому не вистачає 7 електронів, а для електронної конфігурації благородного газу попереднього періоду – Ксенону – 5s25p6 – один електрон зайвий.
Атом Флуору містить один неспарений електрон на зовнішньому електронному рівні (2р5), але для завершення йому необхідний ще один (у Неону – 2р6).
Очевидно, що у випадку атома Цезію для завершення електронної структури легше віддати один електрон, ніж прийняти 7, а у випадку атома Флуору – легше один прийняти. Це і має місце при утворенні зв’язку в молекулі CsF.
Схематично цей процес виглядає так:
Cs – ![]() = Cs+
= Cs+
F + ![]() = F–
= F–
Cs + F = Cs+ + F– або 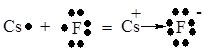
Утворені заряджені частинки (аніон і катіон) називають іонами, а хімічний зв’язок утворений внаслідок електростатичної взаємодії іонів – іонним зв’язком. Напрям зміщення електронної пари вказують стрілкою.
Принципової різниці між ковалентним неполярним, ковалентним полярним та іонним зв’язком немає. Вони відрізняються лише ступенем поляризації (зміщення) спільних електронних пар (рис. 6.11).
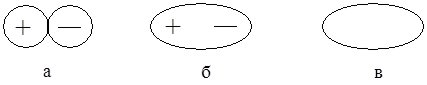
Рис. 6.11. Схематичне зображення молекул з іонним (а), ковалентним полярним (б) та ковалентним неполярним зв’язком.
На відміну від ковалентного зв’язку, іонний характеризується неспрямованістю в просторі і ненасичуваністю. Неспрямованість виявляється в тому, що кожен іон може взаємодіяти з протилежно зарядженим іоном в будь-якому напрямку. Взаємодія з одним протилежно зарядженим іоном не унеможливлює взаємодію з іншими такими ж іонами в інших напрямках. Це – ненасичуваність.
Так, у кристалі Натрій хлориду NaCl, кожен катіон Натрію Na+ оточений шістьма аніонами Хлору Cl– і навпаки (рис. 6.12).
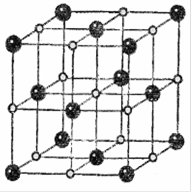
Рис. 6.12. Кристал натрій хлориду.
Іонний тип зв’язку реалізується при утворенні більшості солей, оксидів металів та гідроксидів металів і неметалів.
Іонні сполуки існують у вигляді кристалів, твердих за нормальних умов, а формули типу CsF, Na2O, Ca(OH)2 тощо відображають співвідношення іонів у кристалі.
Іонні сполуки мають високі (порівняно з ковалентними) температури плавлення та кипіння, добре розчинні у воді та інших полярних розчинниках, погано розчинні у бензолі, тетрахлорметані, ацетоні та інших неполярних розчинниках.
У твердому стані іонні сполуки не проводять електричний струм.
6.5. Міжмолекулярна взаємодія
Існування речовин у різних агрегатних станах свідчить про те, що між частинками (атомами, молекулами, іонами) має місце взаємодія, обумовлена особливими силами. Вони названі вандерваальсовими силами на честь фізика Я. Ван-дер-Ваальса (1837 – 1923, Голандія), який вивів рівняння стану газу з урахуванням сил міжмолекулярної взаємодії.
Сили Ван-дер-Ваальса є універсальними, вони діють між будь-якими атомами, молекулами чи іонами. Навіть такий високоінертний газ як гелій He при дуже низьких температурах (–269 0С) переходить у рідкий стан, що свідчить про те, що між атомами гелію існують дуже слабкі сили міжмолекулярної взаємодії.
Виникнення сил Ван-дер-Ваальса можна пояснити виходячи з того, що навіть у електронейтральних атомі або молекул внаслідок руху електронів по орбіталях постійно виникають моментальні електричні дипольні моменти. Взаємодія дипольних моментів називається дисперсійною і характерна для всіх рідин і твердих речовин (рис. 6.13, а).
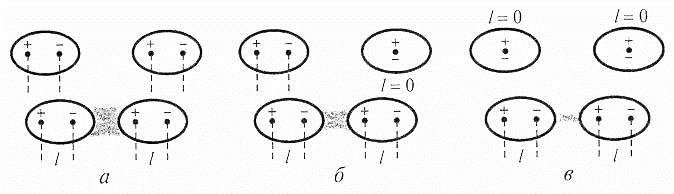
Рис. 6.13. Схема міжмолекулярної взаємодії.
Існують молекули зі сталим електричним дипольним моментом.
Розглянемо розподіл зарядів у молекулі води Н2О. Атом Оксигену несе частковий негативний заряд, який удвічі перевищує частковий позитивний заряд атомів Гідрогену, що з’єднані з ним ковалентним полярним зв’язком. Виходячи з того, що молекула води у просторі має кутову форму (див. Гібридизація), різнойменні заряди мають бути зосереджені на протилежних кінцях молекули. При наближенні двох молекул води різнойменно зарядженими краями, відбувається взаємодія, названа орієнтаційною, яка вимагає певної просторової орієнтації диполів (рис. 6.13, б).
Орієнтаційна взаємодія впливає на фізичні властивості. Речовина закипає тоді, коли вдається подолати енергію міжмолекулярної взаємодії. Чим ця енергія вища, тим сильніше слід нагрівати речовину, щоб вона закипіла. Так, температура кипіння молекулярного азоту N2 (неполярні молекули) становить ‑196 0С, а температура кипіння карбон монооксиду СО – –191,5 0С (полярні молекули).
Якщо полярна молекула стикається з неполярною, то під впливом полярної на неполярній індукується (виникає) заряд (молекула поляризується). Індукований диполь притягається до постійного диполя полярної молекули. Це – індукційна взаємодія. Прикладом такого типу міжмолекулярної взаємодії є взаємодія молекул хлороводню HCl з молекулами хлору Cl2 (рис. 6.13, в).
6.6. Водневий зв’язок
Ще у ХІХ столітті було помічено, що сполуки, в яких атом Гідрогену Н безпосередньо сполучається з атомами Флуору F, Оксигену O або Нітрогену N, мають певні аномальні властивості, зокрема температури плавлення та кипіння.
Зазвичай, у ряду однотипних сполук даної підгрупи, температури плавлення та кипіння зростають при зростанні молекулярної маси. Це пояснюється збільшенням взаємного притягання молекул зі зростанням розмірів атомів, та посиленням дисперсійної взаємодії між ними (табл. 6.4).
Таблиця 6.4
Зміна температури плавлення гідридів деяких елементів VIIA підгрупи
|
Гідрид |
HCl |
HBr |
HI |
|
Температура плавлення, 0С |
– 142,2 |
– 86,9 |
– 50,8 |
Аналогічна залежність спостерігається у ряду H2S – H2Se – H2Te.
Відхилення від сказаного спостерігаються у HF та Н2О, які киплять та плавляться при аномально високих температурах (рис. 6.14).
Як видно з рис. 6.14, зі зростанням молекулярної маси гідридів елементів однієї групи, очікуваний хід кривих спостерігається лише для елементів IVA підгрупи. У гідридів елементів VА, VIА і VIIА підгруп аномально високі температури кипіння спостерігаються у NH3, H2O та HF відповідно, що пояснюється утворенням водневих зв’язків.
Водневий зв’язок виникає внаслідок електростатичної взаємодії між атомом Гідрогену, що має частково позитивний заряд, та атомами з неподіленими парами електронів. Ці атоми зміщують на себе електронну густину, створюючи частковий позитивний заряд d+ на атомах Гідрогену: Нd+ ®Fd–. Диполі кількох полярних молекул взаємодіють між собою з утворенням водневих зв’язків (позначені трьома крапками):
![]()
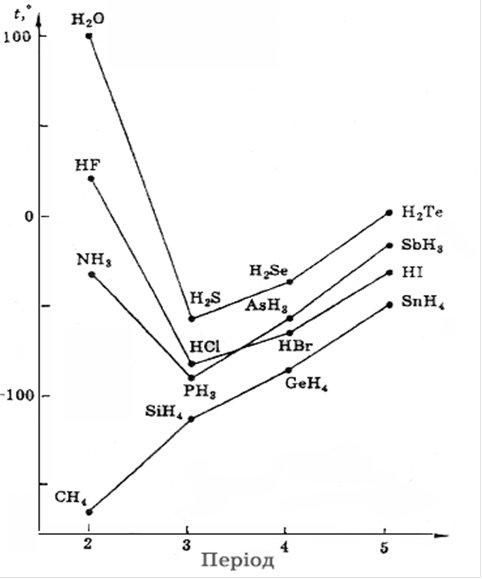
Рис. 6.14. Зміна температур кипіння та плавлення гідридів різних елементів
Зв’язок у молекулі гідроген фториду HF сильно полярний і можна вважати, що у атома Гідрогену електронна орбіталь вільна (утворюється іон Н+) на яку і попадає неподілена пара електронегативного елемента:
![]()
(для порівняння див. Донорно-акцепторний механізм виникнення ковалентного зв’язку).
Завдяки утворенню водневих зв’язків молекули об’єднуються в асоціати. Так, HF існує у вигляді асоціатів (HF)n, де n = 2 ¸ 6.
Водневі зв’язки сильно змінюють фізичні властивості. Вода за їх відсутності мала б кипіти при – 66 0С.
Водневі зв’язки можуть виникати між однаковими або різними молекулами неорганічних (HF, H2O, NH3) та органічних (спиртів, кислот та їх водних розчинів) речовин:
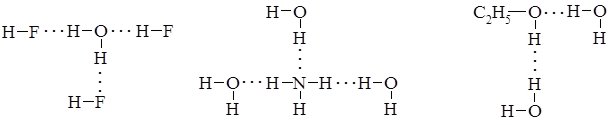
Крім розглянутих прикладів міжмолекулярних, існують внутрішньомолекулярні водневі зв’язки. Найчастіше такі зв’язки виникають у молекулах органічних сполук, наприклад саліцилової (о-оксибензойної) кислоти, о-нітрофенолу:

Зазначимо, що у випадку пара- або мета-заміщених бензолу виникнення внутрішньомолекулярних водневих зв’язків неможливе, оскільки групи, які беруть участь у їх утворенні надто віддалені у просторі.
Водневі зв’язки довші і тому слабкіші від ковалентних (20 кДж/моль у льоду, що становить лише 4,3% енергії ковалентного зв’язку Н–О, а довжина його 1,8∙10-12 м, вдвічі більша від Н–О).
Утворення водневих зв’язків відіграє важливу роль у процесах, які відбуваються при звичайній температурі. Вони підтримують вторинну структуру білків, нуклеїнових кислот. Завдяки водневим зв’язкам лід (кристалічна вода) легший за рідку воду, через що утворюється на поверхні і захищає рідину від втрати тепла.