7. ХІМІЧНІ РЕАКЦІЇ
7. ХІМІЧНІ РЕАКЦІЇ
| Сайт: | Підготовка до ЗНО - Освітній портал "Академія" |
| Курс: | Підготовка до ЗНО з хімії |
| Книга: | 7. ХІМІЧНІ РЕАКЦІЇ |
| Надруковано: | Гість |
| Дата: | Tuesday 1 July 2025 8:58 AM |
7. ХІМІЧНІ РЕАКЦІЇ
Важко сказати, які явища важливіші для людини - фізичні чи хімічні. Випадання або танення снігу, випаровування води, рух повітря, розм'якшення заліза при куванні, плавлення скла - все це важливі для всіх нас речі. Не менш необхідні нам і хімічні реакції. З їх допомогою ми отримуємо метали з руд, ліки, пластмаси, барвники, енергію при спалюванні палива, багато інших речовин. В організмі теж постійно протікають складні біохімічні реакції, що дають енергію для життя. Ось чому людині необхідні знання і з фізики, і з хімії.
7.1. Загальні положення
Перетворення речовин відбувається у ході хімічних реакцій. Для зображення хімічних реакцій користуються хімічними рівняннями, у яких за допомогою хімічних формул і знаків записують реагенти та продукти реакції, а також кількісні співвідношення між ними.
Хімічні рівняння складаються з двох частин, які сполучені знаком “=” “→” або “↔”. Знак рівності ставлять у випадку повністю збалансованого (за елементами та зарядами) рівняння реакції, що відбувається у даному напрямку до кінця. Знак оборотності ставлять для підкреслення оборотності процесу. Стрілку записують у незбалансованих схемах реакцій і в органічній хімії, щоб не сплутати знак “=” з подвійним зв’язком. У лівій частині реакції записують формули реагентів, у правій – продуктів. Кількість атомів кожного елемента до і після реакції повинна бути однаковою, що досягається розставленням коефіцієнтів. Коефіцієнти – цифри, що ставлять перед символами елементів або формулами речовин і вказують на їх кількість.
Хімічні рівняння складають у відповідності із законом збереження маси та енергії.
Основні етапи складання рівнянь хімічних реакцій:
1. Зліва записують формули реагентів, справа – формули продуктів, стрілкою вказують напрям реакції:
Al + HCl → AlCl3 + H2
2. Підраховують кількість атомів кожного елемента до і після реакції, при необхідності розставляють коефіцієнти та заміняють стрілку знаком “=”:
2Al + 6HCl = 2AlCl3 + 3H2
Основні типи хімічних рівнянь:
1. Молекулярні – речовини записують у формі молекул або атомів:
Р2О5 + Н2О = Н3РО4.
2. Іонні – речовини записують у формі іонів:
Н+ + ОН– = Н2О.
3. Електронні та електронно-іонні – вказують ступені окиснення елементів або заряди іонів та кількість електронів, що беруть участь у даному процесі:
Cr2O72– + 14H+ + 6е = 2Cr3+ + 7H2O.
4. Термохімічні – вказують агрегатні стани речовин та тепловий ефект реакції.
С(кр) + O2(г) = СO2(г), ΔН = – 395,3 кДж/моль.
Характерними ознаками проходження хімічних реакцій є:
1. Зміна забарвлення:
2HgO = 2Hg + O2
червоний блискучий безбарвиний
2. Утворення гетерогенних продуктів:
осаду: K2SO4 + BaCl2 = BaSO4↓ + KCl,
або газу: CaCO3 + 2HCl = CaCl2 + CO2↑
3. Виділення або поглинання енергії у вигляді тепла і/або світла:
2Fe + 3O2 = Fe2O3
Існує кілька класифікацій хімічних реакцій залежно від утворених продуктів, агрегатного стану реагентів, оборотності, теплового ефекту, наявності каталізатора, зміни ступеня окиснення елементів, механізму проходження. Остання класифікація широко застосовується в органічній хімії і розглянута у розд. Органічна хімія.
Залежно від результату реакції (утворених продуктів) виділяють основні типи хімічних реакцій:
- Сполучення – з кількох речовин або атомів утворюється нова речовина або молекула: 2Н2 + О2 = 2Н2О.
- Розкладання – з однієї речовини або молекули утворюється кілька нових речовин або атомів: 2HgO = 2Hg + O2.
- Обміну – реагенти обмінюються своїми складовими з утворенням нових речовин: NaCl + AgNO3 = NaNO3 + AgCl.
- Заміщення – один реагент заміщає в іншому певну структурну частину (атом, іон): 2NaBr + Cl2 = 2NaCl + Br2.
За агрегатним станом реагентів виділяють:
- Гомогенні – реагенти перебувають в одному агрегатному стані: 2H2(г) + O2(г) = 2H2O(г).
- Гетерогенні – реагенти перебувають у різних агрегатних станах: С(кр) + O2(г) = СO2(г).
За ознакою оборотності розрізняють реакції:
- Необоротні – відбуваються лише в прямому напрямку і реагенти повністю перетворюються в продукти: Zn + 2HCl = ZnCl2 + H2.
- Оборотні – можуть відбуватись у двох напрямках (прямому і зворотному), не доходячи до кінця по жодному з них: N2 + 3H2 ↔ 2NH3.
За зміною теплового ефекту розрізняють:
- Екзотермічні – теплота виділяється з реакційного середовища.
- Ендотермічні – теплота поглинається з навколишнього середовища.
За наявністю каталізатора розрізняють:
- Каталітичні – відбуваються у присутності каталізатора
- Некаталітичні – проходять без каталізатора.
За зміною ступеня окиснення елементів розрізняють:
- Реакції невалентних перетворень – відбуваються без зміни ступенів окиснення елементів
- Окисно-відновні реакції – проходять зі зміною ступеня окиснення елементів.
Зазначимо, що будь-яка хімічна реакція може одночасно належати до кількох типів. Так, реакція: 2KClO3 = 2KCl + 3O2, що відбувається у присутності MnO2 є гомогенною, необоротною, ендотермічною, каталітичною, окисно-відновною реакцією розкладу.
Кількісні співвідношення між реагентами та продуктами вивчає стехіометрія реакцій.
Розглянемо реакцію:
2HCl + CaCO3 = CaCl2 + CO2 + H2O.
Коефіцієнти у рівнянні реакції вказують молярне співвідношення реагентів та продуктів: 2 моль HCl реагує з 1 моль CaCO3, при цьому утворюється 1 моль CaCl2, 1 моль CO2 і 1 моль H2O (або 73 г HCl реагує зі 100 г CaCO3, утворюючи 111 г CaCl2, 44 г CO2 і 18 г H2O).
Однак, на практиці часто утворюється менша кількість продуктів реакції, ніж розрахована за рівнянням реакції. Причини цього різні – наявність домішок у реагентах, недотримання технології процесу, проходження рівноважних реакції (напр., синтез НІ або NH3 з елементів), людські помилки. Показником ефективності хімічної реакції є процентний вихід продуктів реакції (η – ета), %, який обчислюють за формулою:
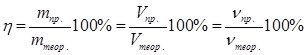 ,
,
де mпр., Vпр., νпр. – відповідно маса, об’єм або кількість моль практично одержаного продукту реакції;
mтеор., Vтеор., νтеор. – теоретично розрахована за рівнянням реакції відповідно маса, об’єм або кількість моль продукту.
Сьогодні фахівці працюють над збільшенням процентного виходу продуктів реакції промислово важливих процесів. Так, застосовуючи сучасні технології добувають амоніак з простих речовин за процесом Габера із виходом понад 90%.
7.2. Основні закономірності проходження хімічних процесів
Основним предметом вивчення хімії є хімічні реакції та закономірності їх перебігу. Енергетику хімічних реакції вивчає термохімія, а кількісні та якісні зміни в часі – хімічна кінетика.
Основними умовами початку хімічної реакції є:
- Безпосередній контакт реагентів.
- Максимальна площа контакту реагентів, що досягається шляхом проведення реакцій у розчинах або паро-газовій фазі.
- Енергія, необхідна для ініціювання початку реакції.
- Наявність каталізатора.
Іноді буває достатньо виконання хоча б однієї умови, а іноді необхідно створювати додаткові умови (наприклад, підвищувати тиск у паро-газовій фазі). Для проходження реакції необхідно постійно подавати реагенти у реакційну суміш, підтримувати умови, перелічені вище (іноді додатково необхідно виводити утворені продукти із зони реакції, охолоджувати реактор тощо).
Існують реакції, які самі створюють і підтримують необхідні умови проходження. Прикладом таких реакцій є процес горіння.
7.3. Термохімія
Хімічна реакція полягає в розриві одних хімічних зв’язків і утворенні інших. Це супроводжується поглинанням або виділенням енергії у вигляді тепла, світла, роботи розширення утворених газів тощо.
У термохімії схеми хімічних перетворень записують за допомогою термохімічних рівнянь.
У термохімічних рівняннях вказують агрегатний усіх стан речовин, для чого використовуються умовні скорочення: г. – газ, р. – рідина, тв. – тверда, кр. – кристалічна. Іноді для деяких речовин (наприклад, для вуглецю) вказують алотропну модифікацію: гр. – графіт, алмаз – алмаз тощо.
Залежно від того, поглинається чи виділяється теплота, виділяють відповідно ендо- та екзотермічні реакції.
Якщо енергія в ході реакції виділяється, то така реакція називається екзотермічною.
Якщо енергія в ході реакції поглинається – то ендотермічною. Ендотермічними є процеси розкладу:
СН4(г) = С(гр) + 2Н2(г), ΔН = 74,9 кДж/моль.
Екзотермічними є процеси горіння:
СН4(г) + 2О2(г) = СО2(г) + Н2О(г), ΔН = – 890,2 кДж/моль.
Енергію, що виділилась або поглинулась в даних умовах називають тепловим ефектом реакції.
Тепловий ефект реакції вказують у термохімічних рівняннях використовуючи значення ентальпії – тепловмісту системи ΔН.
Якщо енергія виділяється, то тепловміст системи (ентальпія) зменшується (Н1 > Н2 і ΔН = Н2 – Н1 < 0).
Якщо енергія поглинається, то тепловміст системи зростає (Н2 > Н1 і ΔН = Н2 – Н1 > 0).
Термохімічне рівняння реакції горіння графіту в кисні:
С(гр) + О2(г) = СО2(г), ΔН = – 395,3 кДж/моль,
означає, що у результаті взаємодії 1 моль твердого графіту з 1 моль газоподібного кисню утворюється 1 моль газоподібного карбон (IV) оксиду і при цьому виділяється 395,3 кДж енергії.
Тепловий ефект реакції визначають відносно 1 моль одного з реагентів за стандартних умов (тиск 101,325 кПа (1 атмосфера) і температура 298,15 К (25 0С)), які не слід плутати з нормальними умовами (101,325 кПа і 273,15 К).
Коефіцієнти перед формулами речовин у термохімічних рівняннях вказують кількість моль речовин, а оскільки часто тепловий ефекти реакції вказують для 1 моль продукту або реагенту, то перед іншими речовинами можуть стояти дробові коефіцієнти:
СО(г) + ½О2(г) = СО2(г), ΔН = – 283 кДж/моль
7.4. Термохімічні розрахунки
В основі усіх термохімічних розрахунків лежить закон Гесса, сформульований у 1858 р. російським хіміком В. Гессом:
Тепловий ефект хімічної реакції визначається лише природою і агрегатним станом реагентів і не залежить від шляху проходження процесу (або від кількості проміжних стадій).
Пояснимо це на прикладі.
Добути карбон (ІV) оксид можна двома шляхами (рис. 7.1):
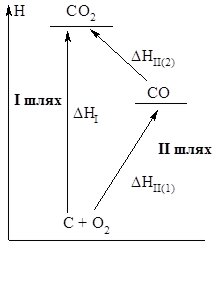
Рис. 7.1. Ентальпійна діаграма утворення СО2
- В одну стадію – взаємодією простих речовин вуглецю та кисню у співвідношенні 1 : 1 (І шлях).
- У дві стадії – взаємодією простих речовин вуглецю та кисню у співвідношенні 2 : 1 (1 стадія) і наступним спалюванням одержаного карбон (ІІ) монооксиду в надлишку кисню (2 стадія) (ІІ шлях):
С(гр) + О2(г) = СО2(г), ΔНІ = – 393,5 кДж/моль – І шлях
2С(гр) + О2(г) = СО(г), ΔНІІ(1) = – 110,5 кДж/моль – ІІ шлях (1 стадія)
СО(г) + ½О2(г) = СО2(г), ΔН ІІ(2) = – 283 кДж/моль – ІІ шлях (2 стадія)
Як видно з рис. 7.1., у результаті реакцій за двома напрямками, кінцевий тепловий ефект однаковий:
ΔНІ = ΔНІІ(1) + ΔНІІ(2) = ‑ 110,5 кДж/моль+ (‑ 283 кДж/моль) = ‑ 393,5 кДж/моль
Із закону Гесса випливає кілька наслідків:
1. Тепловий ефект хімічної реакції рівний різниці між сумами стандартних теплот утворення продуктів реакції і реагентів (І наслідок):
ΔНх.р. = ΣНпрод. – ΣНреагенти.
2. Тепловий ефект хімічної реакції рівний різниці між сумами стандартних теплот згоряння реагентів і продуктів реакції (ІІ наслідок):
ΔНх.р. = ΣНзгор. регенти. – ΣНзгор. прод.
Стандартна теплота утворення речовини (ΔНf0) (англ. formation – утворення) – тепловий ефект реакції утворення 1 моль сполуки з простих речовин, стійких за стандартних умов:
Н2(г) +О2(г) = Н2О(г), ΔН f0 = –286 кДж
Стандартні теплоти утворення різних сполук наведені у довідниках. Теплоти утворення простих речовин приймаються рівними нулю (крім алмазу, озону та деяких інших алотропних модифікацій).
Стандартна теплота згоряння (ΔН0згор) – тепловий ефект згоряння 1 моль речовини у достатній кількості кисню О2:
NH3(г) + 3/4O2(г) = ½N2(г) + 3/2H2O(г), ΔН0згор = – 383 кДж
Теплоти згоряння вищих оксидів рівні нулю.