8. ХІМІЧНА КІНЕТИКА І КАТАЛІЗ
8. ХІМІЧНА КІНЕТИКА І КАТАЛІЗ
| Сайт: | Підготовка до ЗНО - Освітній портал "Академія" |
| Курс: | Підготовка до ЗНО з хімії |
| Книга: | 8. ХІМІЧНА КІНЕТИКА І КАТАЛІЗ |
| Надруковано: | Гість |
| Дата: | Sunday 25 May 2025 5:20 AM |
8. ХІМІЧНА КІНЕТИКА І КАТАЛІЗ
Основні завдання хімічної кінетики:
- Вивчення механізму реакції (з’ясування елементарних стадій процесу і їх послідовності).
- Кількісний опис хімічної реакції (встановлення відношень, за якими можна розрахувати зміну кількостей реагентів і продуктів у ході реакції).
8.1. Швидкість хімічних реакцій
Основним поняттям хімічної кінетики є швидкість реакції.
Відомо, що усі хімічні процеси відбуваються з різною швидкістю. Деякі реакції відбуваються миттєво (фторування органічних сполук молекулярним фтором: СH4 + 2F2 = CF4 + 4HF), для проходження інших іноді необхідно кілька діб (відновлення ароматичних нітросполук до ароматичних амінів сульфідом амонію (NH4)2S у кислому середовищі – реакція Зініна: С6Н5NO2 + (NH4)2S + 2HCl = С6Н5NH2 + 2NH4Cl + SO2).
Швидкість гомогенної реакції, що відбувається в замкненому об’ємі, визначається зміною концентрації реагентів або продуктів за одиницю часу.
Для реакції aA + bB ↔ cC + dD:
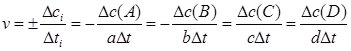
де a, b, c, d – стехіометричні коефіцієнти, Δсі = сі2 – сі1 – зміна концентрації компонента (A, B, C або D) за час Δt = t2 – t1.
Зазначимо, що в ході реакції концентрація реагентів зменшується (сі2 < сі1) і Δсі > 0, а концентрація продуктів – зростає (сі2 > сі1) i Δсі < 0, а оскільки значення швидкості реакції може бути лише більшим від нуля, то для дотримання цієї умови ставиться знак “±”.
Концентрації речовин зазвичай вказують у моль/л, а час – у секундах, тому розмірність швидкості хімічної реакції ![]() або моль×л-1×с-1.
або моль×л-1×с-1.
Швидкість реакції залежить від багатьох факторів, основними з яких є природа реагентів, агрегатний стан, концентрація, температура, наявність каталізатора, тощо.
Вплив природи реагентів виявляється у тому, за однакових умов різні речовини реагують між собою з різною швидкістю. Так, за стандартних умов газоподібні молекулярні водень і фтор, розчини хлороводню і натрій гідроксиду реагують миттєво, а молекулярні водень і бром (або йод) – повільно.
У газовій і рідкій фазах, як правило, реакції відбуваються швидше, ніж у твердій.
Вплив концентрації. Збільшення кількості частинок реагентів в одиниці об’єму збільшує частоту зіткнень між ними, при цьому зростає площа стикання. І хоча не кожне зіткнення веде до утворення продукту, однак ймовірність взаємодії зростає, тому зростає і швидкість реакції.
Для збільшення площі стикання реагенти подрібнюють або переводять у рідку або газову фазу.
Кількісно вплив концентрації на швидкість хімічної реакції описує закон дії мас (К. Гульдберг і П. Вааге, 1867 р., Норвегія).
Швидкість хімічної реакції за даної температури пропорційна добутку концентрацій реагентів або продуктів реакції.
Для реакції aA + bB ↔ cC + dD математично цей закон записується:
v = kСAaСB b = k’СС сСD d,
де СА, СВ, CС i СD – концентрації речовин А, В, С i D відповідно, моль/л, а, b, с і d – стехіометричні коефіцієнти, k i k’ – константи швидкості – коефіцієнти, які не залежать від концентрацій, а залежать від температури і природи реагентів.
Якщо СА = СВ = 1 або СC = СD = 1, то v = k (v = k’), тобто k (k’) – швидкість хімічної реакції при концентрації реагентів (продуктів) 1 моль/л. Це – фізичний зміст константи швидкості.
Описана залежність вірна для реакцій в гомогенному стані.
Коли реакція відбувається в гетерогенній системі, то її швидкість залежить від площі стикання реагентів. У вираз швидкості гетерогенної хімічної реакції не входять значення концентрацій реагентів, що перебувають у твердій фазі, але враховуються концентрації рідких і газоподібних компонентів (іноді для останніх використовують значення парціального тиску). Для реакції
2Mg(тв) + O2(тв) = 2MgO(тв)
вираз швидкості має вигляд v = kСO2 = рO2, де рO2 – парціальний тиск кисню у системі.
Існують реакції, які відбуваються в одну стадію – елементарні реакції, і реакції, що відбуваються у кілька стадій – складні.
У випадку елементарної реакції відбувається один процес і хімічне рівняння описує її справжній механізм.
Для складних багатостадійних реакцій у хімічному рівнянні часто об’єднують кілька стадій і воно показує лише реагенти і продукти, але не відображає реального механізму проходження процесу.
Реакція Na2S2O3 + H2SO4 = Na2SO4 + SO2 + S+ H2O відбувається у дві стадії: Na2S2O3 + H2SO4 = Na2SO4 + Н2SO3 – І стадія
H2SO3 = SO2 + S+ H2O – ІІ стадія.
Для кожної з цих стадій можна визначити швидкість. Стадія, яка відбувається з найменшою швидкістю, визначає загальну швидкість процесу. У наведеному прикладі найповільнішою є ІІ стадія, яку називають лімітуючою.
Вплив температури на швидкість хімічної реакції описується правилом Вант-Гоффа: збільшення температури на кожні 10 0С веде до зростання швидкості реакції у 2 – 4 рази:
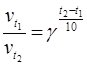 ,
,
де ![]() i
i ![]() – швидкість реакції відповідно за температури t1 i t2, γ – температурний коефіцієнт швидкості реакції (визначається експериментально).
– швидкість реакції відповідно за температури t1 i t2, γ – температурний коефіцієнт швидкості реакції (визначається експериментально).
Точніше вплив температури на швидкість хімічної реакції показав С. Арреніус. Він запропонував теорію активації, згідно з якою у реакцію вступають лише активні молекули. Активні молекули мають визначену для даної реакції енергію, яка перевищує енергію інших молекул. Цей надлишок енергії називають енергією активації.
Між реагентами і продуктами реакції існує проміжний стан, який називають активований комплекс. Особливістю цього стану є те, що старі зв’язки в молекулах реагенту ще не розірвались, а нові ще не повністю сформувались:
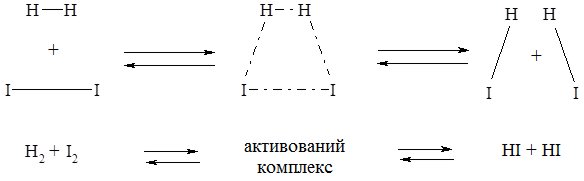
Зв’язки в активованому комплексі слабкіші, ніж у молекулах Н2 та І2, тому хід реакції по такому шляху реакції є енергетично вигідним.
Енергія, що витрачається на активацію молекул повністю або частково компенсується енергією, що виділяється при утворенні продуктів реакції. Коли енергії виділяється більше, то процес є екзотермічним, коли менше – ендотермічним. У розглянутому прикладі енергія активації перевищує тепловий ефект реакції.
8.2. Каталіз і каталізатори
Багато реакцій відбуваються дуже повільно або не відбуваються взагалі у потрібному напрямку без наявності у реакційному середовищі невеликих кількостей певних речовин. Так, у лабораторних умовах для одержання молекулярного кисню використовують реакцію термічного розкладу бертолетової солі (калій хлорату):
2KClO3(тв) = 2KCl(тв) + 3O2(г)
Навіть при значному нагріванні (до початку плавлення) солі, процес відбувається дуже повільно, а основною реакцією є дипропорціювання KClO3:
4KClO3(тв) = 3KClО4(тв) + KCl(тв)
Але якщо перед нагріванням до KClO3 додати невелику кількість манган (IV) оксиду MnO2, швидкість реакції значно зростає, і процес іде у потрібному напрямку з утворенням калій хлориду та молекулярного кисню. Після завершення реакції весь MnO2 залишається кількісно і якісно незміненим.
Речовини, які збільшують швидкість хімічних реакції, беручи участь у проміжних стадіях, але не витрачаються на утворення продуктів реакції називають каталізаторами.
Зміна швидкості реакції під впливом каталізатора називається каталізом, а реакції, що відбуваються за участю каталізаторів – каталітичними.
Якщо реагенти і каталізатор перебувають в одній фазі, каталіз називають гомогенним (прикладом є розглянута реакція розкладу калій хлорату), а коли в різних – гетерогенним (синтез амоніаку NH3 з молекулярних водню та азоту, або окиснення сульфур (IV) оксиду SO2 киснем повітря до сульфур (VІ) оксиду SO3 у присутності V2O5). В останньому випадку швидкість реакції залежить і від площі стикання реагентів, оскільки реакція відбувається на поверхні каталізатора.
Деякі речовини можуть прискорювати одні процеси і сповільнювати інші. Якщо в присутності даної речовини швидкість хімічної реакції зростає, то каталіз позитивний. Якщо швидкість зменшується – негативний. Негативні каталізатори називають інгібіторами. Так, реакція Fe + 2HCl = FeCl2 + H2 не відбувається в присутності уротропіну (гексаметилентетраміну), який є її інгібітором.
Механізм дії каталізаторів пояснюють зниженням енергії активації реакції шляхом утворення проміжних сполук з реагентами (активні комплекси), для чого необхідна менша енергія. Реакція відбувається шляхом, який є енергетично доступнішим:
І. Без каталізатора:
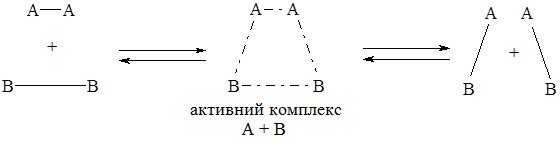
ІІ. З каталізатором:
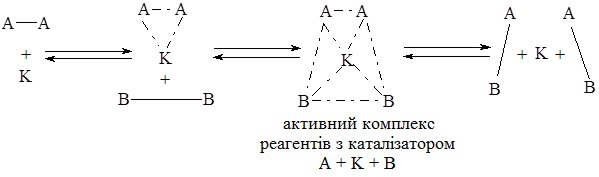
У результаті проходження реакції за ІІ шляхом утворюється продукт АВ а каталізатор К виділяється у незмінному вигляді.
Зі схеми видно, що каталізатор однаково змінює швидкість прямої і зворотної реакції.
Прикладом гомогенного каталізу за таким механізмом є реакції, що лежать в основі виробництва сульфатної кислоти нітрозним методом. Однією із стадій процесу є окиснення сульфур (IV) оксиду SO2 киснем повітря до сульфур (VІ) оксиду SO3 у присутності каталізатора NO:
|
O2 + 2NO = 2NO2 NO2 + SO2 = SO3 + NO |
|
A + K = AK AK + B = AB + K |
|
O2 + 2SO2 = SO3 |
|
A + B = AB |
Зазначимо, що без каталізатора ця реакція практично не відбувається.
Каталізатори характеризуються специфічністю та універсальністю. Специфічні каталізатори прискорюють лише одну реакцію, для інших неефективні (MnO2 прискорює розклад лише KClO3).
Існують каталізатори із груповою специфічністю. Наприклад V2O5 прискорює окиснення NH3, SO2; Ni – процеси гідрування/дегідрування органічних сполук.
Універсальні каталізатори змінюють швидкість різних реакцій (Рt є каталізатором реакцій окиснення SO2 до SO3 і гідрування ненасичених сполук).
Каталізатори іноді змінюють не лише швидкість, а й напрям проходження реакції. Вище розглянуто різницю у напрямках розкладу KClO3 без MnO2, та у його присутності. Іншим прикладом є каталітичний термоліз етанолу С2Н5ОН. Якщо процес проводити при 30 0С у присутності Al2O3, то продуктами реакції є етан СН2=СН2 і вода Н2О:
СН3–СН3–ОН ![]() СН2=СН2 + Н2О
СН2=СН2 + Н2О
Якщо реакцію проводити при 250 0С у присутності порошку міді Cu, утворюються ацетальдегід СН3СОН і молекулярний водень Н2:
СН3–CH2–ОН ![]() СН3СOН + Н2
СН3СOН + Н2
Використання каталітичних реакції. У хімічній промисловості понад ¾ виробництв базуються на застосуванні каталізаторів. Серед них – виробництва амоніаку, нітратної та сульфатної кислот, різноманітні органічні синтези.
Величезну роль відіграє каталіз у біологічних системах. Більшість реакцій у живих організмах є каталітичними. Біокаталізатори (ферменти або ензими) – це прості або складні білки. Ферменти є високоспецифічними каталізаторами – в організмі людини є понад 3000 ферментів, кожен з яких каталізує лише одну “свою” реакцію.
8.3. Необоротні та оборотні хімічні реакції. Хімічна рівновага та її зміщення
Як зазначалось вище, всі хімічні реакції можна поділити на оборотні та необоротні.
Необоротні реакції відбуваються до кінця – поки не буде повністю використаний один з реагентів.
Оборотні реакції ніколи не відбуваються до кінця, тому що жоден з реагентів не витрачається повністю в ході реакції і продукти реакції за певних умов можуть перетворюватись у реагенти.
Розглянемо два приклади.
Взаємодія металічного магнію з хлоридною кислотою відбувається за схемою:
Mg + 2HCl = MgCl2 + H2
Якщо взяти достатню кількість кислоти, то реакція припиниться, коли розчиниться весь магній. Спроба провести зворотну реакцію шляхом пропускання водню Н2 через розчин магній хлориду MgCl2 очікуваного результату не дасть. Таким чином, наведена реакція необоротна.
Хімічні реакції, що відбуваються винятково в одному напрямку називають необоротними.
При нагріванні парів молекулярного йоду І2 з Н2 при 200 0С відбувається реакція:
І2 + Н2 ![]() 2НІ, v1 = k1[Н2][І2]
2НІ, v1 = k1[Н2][І2]
При утворенні газової суміші із вмістом НІ 80%, ця реакція припиняється.
При подальшому нагріванні цієї суміші до 350 0С відбувається розклад утвореного НІ:
2НІ ![]() І2 + Н2 v2 = k2[НІ] 2
І2 + Н2 v2 = k2[НІ] 2
Коли розкладеться 80% йодоводню, реакція припиниться.
Як бачимо, кількісний склад утворених за обома реакціями газових сумішей однаковий.
Очевидно, що у даних умовах не утвориться 100% НІ за першою реакцією і не розкладеться 100% його за другою схемою, оскільки реагенти і продукти можуть перетворюватись одні в одних. Тому ця реакція оборотна.
Хімічні реакції, що при певних умовах можуть відбуватись у протилежних напрямках називають оборотними.
Розглянуті процеси, що відбуваються у випадку НІ можна записати сумарною схемою:
Н2 + І2  2НІ
2НІ
Реакція, що відбувається з ліва на право називається прямою, а справа на ліво – зворотною.
Для реакції І2 + Н2 = 2НІ у початковий момент часу швидкість утворення НІ (прямої реакції) v1 буде максимальною, а швидкість v2 реакції 2НІ = І2 + Н2 (зворотної) буде нульовою, оскільки НІ ще не утворився. З плином часу в реакційній системі буде зростати концентрація НІ і зменшуватись кількість Н2 і І2, тому відповідно буде зростати швидкість v2 і зменшуватись v1 (рис. 8.1).
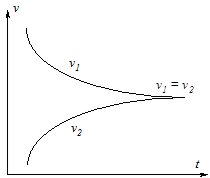
Рис. 8.1. Зміна швидкості прямої (v1) та зворотної (v1) реакцій з плином часу (t).
Коли v1 = v2 настає момент хімічної рівноваги. У стані хімічної рівноваги за певний час утворюється стільки ж молекул продуктів, скільки їх розкладається до регентів.
Стан системи, при якому швидкість прямої реакції дорівнює швидкості зворотної називають станом хімічної рівноваги.
Хімічну рівновагу називають динамічною, підкреслюючи цим, що у системі одночасно відбуваються пряма і зворотна реакції з однаковою швидкістю, через що зміни в реакційному середовищі непомітні.
Кількісно стан хімічної рівноваги характеризує константа хімічної рівноваги – відношення констант швидкості прямої k1 і зворотної реакції k2.
У розглянутому прикладі оборотної реакції Н2 + І2 D 2НІ, v1 = v2 і тому k1[Н2][І2] = k2[НІ] 2, і 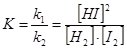 .
.
У загальному випадку для оборотної реакції
aA + bB + … ↔ pP + qQ + …
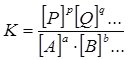
Константа хімічної рівноваги залежить від температури і не залежить від концентрацій компонентів реакції.
Знаючи значення К можна говорити про повноту проходження тієї чи іншої реакції.
При K > 1 рівновага зміщена вправо і в системі переважають продукти реакції.
При К < 1 рівновага зміщена вліво і в системі переважають реагенти.
При К = 0 реакція не відбувається.
Зміщення хімічної рівноваги.
При сталих зовнішніх умовах (тиск, температура, концентрації реагентів) стан рівноваги оборотної реакції може зберігатись нескінченно довго. Насправді, при зміні хоча б одного з вказаних параметрів, швидкості прямої і зворотної реакції змінюються і рівновага зміщується в бік того чи іншого процесу. Через певний час швидкості прямої і зворотної реакцій знову вирівняються і встановиться новий стан хімічної рівноваги з іншими концентраціями компонентів системи.
Закономірності впливу зовнішніх змін на стан хімічної рівноваги в оборотних системах вивчав фр. вчений Ле-Шатель’є і у 1884 р. встановив:
Якщо на систему, що перебуває у стані динамічної рівноваги подіяти ззовні, то у системі відбуватимуться реакції, що зменшують зовнішній вплив.
Ця закономірність названа принципом Ле-Шатель’є.
Розглянемо зміщення хімічної рівноваги за умов зміни концентрацій реагентів і продуктів, температури і тиску на прикладі оборотної реакції синтезу аміаку NH3 з молекулярних водню H2 та азоту N2:
N2(г) + 3H2(г) ↔ 2NH3(г), ΔН = 92 кДж
Зміна концентрації реагентів у бік її збільшення веде до зростання швидкості прямої реакції утворення аміаку і зв’язування реагентів. Зменшення концентрації реагентів викликає проходження зворотної реакції. Аналогічно (але в протилежному напрямку) впливає зміна концентрації продуктів реакції.
Зміна температури. Оскільки пряма реакція є екзотермічна, то зворотна – ендотермічна. При підвищенні температури рівновага зміщується в бік ендотермічної реакції (розклад аміаку), а при зниженні – екзотермічної (утворення NH3).
Зміна тиску впливає на стан хімічної рівноваги реакцій, що відбуваються у газовій фазі, оскільки зумовлює зміну об’єму системи і відповідно концентрації компонентів. У розглянутому прикладі пряма реакція веде до зменшення об’єму системи (з 2 об’ємів азоту та 3 об’ємів водню утворюється 2 об’єми аміаку) і відповідно до зменшення тиску в реакторі, а зворотна – до збільшення об’єму і тиску.
Отже, при зростанні тиску хімічна рівновага зміщується у бік менших об’ємів, а при зменшенні – у бік більших.
Якщо реакція відбувається у газовій фазі без зміни об’єму, то зміна тиску в системі на стан хімічної рівноваги не впливає (Н2 + І2 ↔ 2НІ).
Як зазначалось вище, каталізатори однаково змінюють швидкість прямої і зворотної реакції, тому на стан хімічної рівноваги вони не впливають, а лише прискорюють момент її настання.