9. ОКИСНО-ВІДНОВНІ РЕАКЦІЇ (ОВР)
9. ХІМІЯ ОКИСНО-ВІДНОВНИХ ПРОЦЕСІВ
| Сайт: | Підготовка до ЗНО - Освітній портал "Академія" |
| Курс: | Підготовка до ЗНО з хімії |
| Книга: | 9. ОКИСНО-ВІДНОВНІ РЕАКЦІЇ (ОВР) |
| Надруковано: | Гість |
| Дата: | Sunday 25 May 2025 4:54 AM |
Зміст
- 9. ОКИСНО-ВІДНОВНІ РЕАКЦІЇ (ОВР)
- 9.1. Загальні положення
- 9.2. Теорія окисно-відновних реакцій
- 9.3. Стехіометричні співвідношення у редокс-процесах
- 9.4. Метод електронного балансу
- 9.5. Метод електронно-іонного балансу (напівреакцій)
- 9.6. Класифікація окисно-відновних реакцій
- 9.7. Кількісні характеристики окисно-відновних реакцій
- 9.8. Вплив середовища на напрям проходження ОВР
- 9.9. Значення окисно-відновних реакцій
9. ОКИСНО-ВІДНОВНІ РЕАКЦІЇ (ОВР)
Серед хімічних перетворень найважливішу роль відіграють окисно-відновні процеси, які є причиною низки природних явищ: горіння, гниття, бродіння, перерозподілу енергії в природі, процесів обміну речовин у живих організмах. Людина широко використовує штучні окисно-відновні реакції – в енергетиці, металургії, хімічній індустрії, біології, медицині, сільському господарстві, екології та в багатьох інших галузях.
9.1. Загальні положення
Стан атомів у сполуках характеризує ступінь окиснення.
Ступінь окиснення – це умовний заряд атома у сполуці, обчислений з припущенням, що вона складається з іонів і спільні електронні пари повністю зміщені до більш електронегативного атома.
Розглянемо молекулу гідроген фториду HF, у якій зв’язок H—F ковалентний полярний. У молекулі HF спільна електронна пара сильно зміщена в бік атома F. Умовно можна вважати, що на атомі H виник частковий позитивний заряд, а на атомі F – частковий негативний. Значення часткових зарядів, залежно від кількості зв’язків між атомами, приймають кратними 1 (1, 2, 3, 4 і т. д.). Якщо електрона пара відтягнута від атома, то вважається, що його ступінь окиснення позитивний (у нашому випадку це атом Н), а якщо зміщена до нього – негативний (атом F). У випадку рівномірного розподілу електронної хмари між атомами (у сполуках з ковалентним неполярним зв’язком) ступінь окиснення усіх атомів у молекулі є нульовим.
Позначають ступінь окиснення верхнім індексом справа від символа хімічного елемента арабськими цифрами зі знаком “+” або “–” перед цифрою (не плутати із зарядом іона, який записують цифрами зі знаком після цифри – Al3+, SO42– ):
H+1F–1 P+5Cl–15 Cl02
Слід запам’ятати, що ступінь окиснення не завжди чисельно збігається з валентністю атома.
Існує ряд правил для обчислення ступенів окиснення елементів:
- Ступінь окиснення елементів у простих речовинах дорівнює нулю (H02, Na0, P04, S∞0).
- Ступінь окиснення Оксигену у більшості сполук –2 (СО–22, Na2SO–24). У пероксидах ступінь окиснення Оксигену дорівнює –1 (Н2О–12, Na2O–12).
- У Гідрогену ступінь окиснення переважно +1 (H+12O, NH+13, H+1Cl). У гідридах лужних металів ступінь окиснення Гідрогену –1 (NaH–1).
- Ступінь окиснення лужних металів (ІА підгрупа) +1, лужно-земельних (ІІА підгрупа) +2, у Алюмінію Al +3 майже у всіх сполуках.
- У Флуору F ступінь окиснення завжди –1, у галогенів –1 лише у бінарних сполуках, при умові, що галоген зв’язаний з менш електронегативним атомом (HBr‑1, NaI–1).
- Сума ступенів окиснення елементів у сполуках завжди повинна дорівнювати нулю.
- В простих іонах (Н+, Na+, Cl–) ступінь окиснення елемента дорівнює заряду іона. У складних іонах (NH4+, SO42–, Cr2O72–) сума ступенів окиснення елементів повинна дорівнювати заряду іона.
Приклад до правила 6.
Обчислимо ступінь окиснення Мангану Mn у сполуці КMnO4 (калій перманганат).
Запишемо відомі ступінь окиснення біля атомів елементів; невідомий ступінь окиснення мангану позначимо через х: К+1MnхO–24.
Виходячи з того, що сума ступенів окиснення елементів у електронейтральній молекулі повинна дорівнювати нулю, складаємо рівняння з урахуванням кількості атомів кожного елемента, що входять до складу КMnO4:
К+1MnхO–24
+1 + х + 4(–2) = 0,
звідки х = +7.
Приклад до правила 7.
Обчислимо ступінь окиснення Хрому Cr у складному іоні Cr2O72– (дихромат-іон).
Сума ступенів окиснення елементів у складному іоні повинна дорівнювати заряду іона:
(Crх2O–27)2–
2х + 7(–2) = –2,
х = +6.
9.2. Теорія окисно-відновних реакцій
Реакції, які відбуваються зі зміною ступенів окиснення елементів називають окисно-відновними.
Розглянемо основні положення теорії окисно-відновних реакцій (ОВР).
- Окиснення (англ. Oxidation) – процес віддачі електронів атомом:
Na – е = Na+; 2Cl– – 2е = Cl2.
В процесі окиснення ступінь окиснення елемента зростає.
- Відновлення (англ. Reduсtion) – процес приєднання електронів атомом:
S + 2е = S–2; Fe3+ + е = Fe2+.
В процесі відновлення ступінь окиснення елемента зменшується.
- Частинки (атоми, молекули, іони), які віддають електрони називають відновниками і в реакції вони окиснюються. Частинки, які приєднують електрони називають окисниками, в реакції вони відновлюються. Оскільки окисник і відновник входять до складу певних речовин, то ці речовини відповідно називають окисником і відновником.
- Окиснення завжди супроводжується відновленням і навпаки:
Red1 – nе → Ox1
Ox2 + mе→ Red2
Окисно-відновні реакції – єдність процесів окиснення і відновлення.
- Кількість електронів, відданих відновником, завжди дорівнює кількості електронів, прийнятих окисником.
Від англійських назв процесів окиснення і відновлення, окисно-відновні реакції ще називають редокс-реакціями.
Окисники та відновники.
Окисники – атоми елементів у таких ступенях окиснення, у яких вони здатні приєднувати електрони. Серед усіх речовин, окисну здатність мають ті, які містять атоми з високими ступенями окиснення. До них належать:
- Прості речовини – неметали – галогени (VIIA підгрупа), халькогени (VIA підгрупа).
- Гідроген пероксид Н2О2.
- Оксиди металів у високих ступенях окиснення: хром (VI) оксид CrO3, манган (VII) оксид Mn2O7, плюмбум (IV) оксид PbO2, аргентум (ІІ) оксид Ag2O та їх солі: феруму (ІІІ), ауруму (ІІІ) кобальту (ІІІ), плюмбуму (IV).
- Оксигеновмісні кислоти та їх солі: нітратна HNO3 і нітрати, концентрована сульфатна H2SO4, перманганатна HMnO4 і перманганати. Солі кислот хрому (VI) – хромати Ме2CrO4, дихромати Ме2Cr2O7 (Ме – одновалентний метал), оксигеновмісні кислоти хлору – гіпохлоритна HClO, хлоратна HClO3, перхлоратна HClO4.
- Анод при електролізі.
Відновники – атоми елементів у таких ступенях окиснення, у яких вони здатні віддавати електрони. Відновну здатність мають нейтральні атоми або молекули, катіони металів, аніони неметалів, складні іони або молекули, що містять елементи у низьких або проміжних ступенях окиснення. До них належать:
- Прості речовини – метали.
- Прості речовини – неметали: вуглець С, водень Н2, кремній Si.
- Гідроген пероксид Н2О2.
- Оксиди неметалів: карбон (ІІ) оксид СО, нітроген (ІІ) оксид NO, сульфур (IV) оксид SO2.
- Оксигеновмісні кислоти: сульфітна H2SO3, нітритна HNO3, метафосфатна H3PO3 та їх солі.
- Безоксигенові кислоти: сульфідна H2S, галогеноводневі HHal та їх солі.
- Солі, у яких метали перебувають не у найвищих ступенях окиснення: стануму (ІІ), феруму (ІІ), хрому (ІІІ), мангану (ІІ).
- Аміак NH3.
- Альдегіди, спирти.
- Катод при електролізі.
Цікавою особливістю деяких речовин, зокрема тих, що містять атоми елементів у проміжних ступенях окиснення, є їх дуалістична поведінка в редокс-процесах. Ці речовини, залежно від умов, виявляють відновні або окисні властивості.
Так, гідроген пероксид Н2О2 виявляє відновні властивості при дії сильного окисника – калій перманганату KMnO4:
5H2O–12 + 2KMn+7O4 + 3H2SO4 = 5O02 + 2Mn+2SO4 + K2SO4 + 8H2O.
Однак, Н2О2 виявляє властивості окисника при взаємодії з типовими відновниками:
2KI–1 + H2O–12 + H2SO4 = I02 + K2SO4 + 2H2O–2.
Іншим прикладом є нітрит-іон NO2–:
2HN+3O2 + 2HI–1 = I02 + 2N+2O + 2H2O
5KN+3O2 + 2KMn+7O4 + 3H2SO4 = 5KN+5O3 + 2Mn+2SO4 + K2SO4 + H2O
Нітрит-іон NO2– є окисником у реакції з НІ і відновником – з KMnO4.
Окрім зазначених речовин, таку здатність мають сульфіт-іон SO32–, манган (IV) оксид MnO2 та деякі інші.
9.3. Стехіометричні співвідношення у редокс-процесах
Для усіх хімічних процесів справедливий закон збереження маси речовин. Оскільки окисно-відновні процеси описуються хімічними рівняннями, то кількість атомів елементів у складі реагентів повинна дорівнювати їх кількості у складі продуктів реакції. Для додержання цієї умови використовують коефіцієнти у рівнянні реакції. Існує кілька методів підбору коефіцієнтів в окисно-відновних реакціях, але ми детально розглянемо лише два – електронного балансу та електронно-іонного балансу (напівреакцій).
9.4. Метод електронного балансу
Даний метод базується на порівнянні ступенів окиснення атомів у складі реагентів та продуктів реакції. При цьому обов’язково слід пам’ятати, що кількість електронів, прийнятих окисником повинна дорівнювати кількості електронів, відданих відновником. Для складання хімічного рівняння слід знати формули реагентів і продуктів реакції.
Приклад 1.
Взаємодія алюмінію з розчином хлоридної кислоти відбувається за схемою: Al + HCl → AlCl3 + H2.
Визначимо ступені окиснення усіх елементів: Al0 + H+1Cl–1 → Al+3Cl–13 + H02.
Ступені окиснення змінюють атоми Al i H. Під час реакції відбуваються два процеси:
1. Окиснення Al0 → Al+3
2. Відновлення H+1 → H0.
Таким чином, Al є відновником, а HCl – окисником.
Атом Al0 окиснюється в Al+3 віддаючи при цьому три електрони:
Al0 – 3е = Al+3.
Атом Н+1 відновлюється до Н0 приймаючи один електрон:
Н+1 + е = Н0.
Але оскільки проста речовина водню – двоатомна молекула Н2, то для її утворення повинні відновитись два атоми Гідрогену, використовуючи для цього два електрони:
2Н+1 + 2е = Н02.
Складемо схему електронного балансу, вказавши справа від неї кількість відданих та приєднаних електронів:
|
Al0 – 3е = Al+3 2Н+1 + 2е = Н02 |
3 2 |
Найменше спільне кратне (НСК) для 3 і 2 є 6. Коефіцієнти у рівнянні реакції одержуємо діленням НСК на кількість електронів, які беруть участь в процесі відновлення чи окиснення:
|
|
Кількість електронів |
НСК |
Коефіцієнти |
|
Al0 – 3е = Al+3 2Н+1 + 2е = Н02 |
3 2 |
6 |
2 3 |
Отже, перед атомом Al слід поставити коефіцієнт 2, відповідно перед молекулою AlCl3 теж 2, перед Н2 – 3 і перед HCl – 6. Остаточно одержуємо:
2Al + 6HCl = 2AlCl3 + 3H2.
Перевіримо правильність підібраних коефіцієнтів:
|
Атоми |
Кількість |
|
|
до реакції |
після реакції |
|
|
Al |
2 |
2 |
|
H |
6 |
6 |
|
Cl |
6 |
6 |
Приклад 2.
Підберемо коефіцієнти у схемі: HCl + КMnO4 → Cl2 + MnCl2 + KCl + + H2O.
Визначаємо, які елементи змінюють ступені окиснення:
H+1Cl–1 + К+1Mn+7O–24 → Cl02 + Mn+2Cl–12 + K+1Cl–1 + H+12O–2.
Ступені окиснення змінюють Мn+7 → Mn+2 i Cl–1 → Cl0. Окисником є Мn+7 (KMnO4), відновником – Cl–1 (НCl).
Складаємо електронні рівняння:
|
|
Кількість електронів |
НСК |
Коефіцієнти |
|
Mn+7 + 5е = Mn+2 2Cl–1 – 2е = Cl02 |
5 2 |
10 |
2 5 |
Коефіцієнти перед КMnO4, MnCl2 і KCl – 2, перед Cl2 – 5:
HCl + 2КMnO4 → 5Cl2 + 2MnCl2 + 2KCl + H2O.
Коефіцієнт перед HCl знаходимо, виходячи з того, що у правій частині рівняння міститься 10 + 4 + 2 = 16 атомів Сl, а у правій – лише один. Тому перед HCl слід поставити коефіцієнт 16.
Кількість атомів Н до реакції 16 (у складі HCl), а після – 2, тому коефіцієнт перед H2O – 8. Остаточно одержуємо:
16HCl + MnO4 = 5Cl2 + 2MnCl2 + 2KCl + 8H2O.
Перевіривши кількість усіх атомів до і після реакції, переконуємось, що рівняння складене правильно.
Приклад 3.
Підберемо коефіцієнти у схемі: Cr2O3 + NaNO3 + NaOH → Na2CrO4 + + NaNO2 + H2O.
Ступені окиснення змінюють Сr+3 → Cr+6 (відновник Cr2O3) і N+5 → N+3 (окисник NaNO3).
Електронні рівняння:
|
|
Кількість електронів |
НСК |
Коефіцієнти |
|
2Cr+3 – 6е = 2Cr+6 N+5 + 2е = N+3 |
6 2 |
6 |
1 3 |
Переносимо підібрані коефіцієнти у схему реакції:
Cr2O3 + 3NaNO3 + NaOH → 2Na2CrO4 + 3NaNO2 + H2O
Для зрівнювання кількості атомів Na перед NaОН ставимо коефіцієнт 2:
Cr2O3 + 3NaNO3 + NaOH = 2Na2CrO4 + 3NaNO2 + H2O.
Перевіряємо кількість усіх атомів до і після реакції, щоб переконатись, що рівняння складене правильно.
Зазначимо, що іноді достатньо підрахувати кількість лише одного елемента (наприклад, Оксигену) до і після реакції, щоб перевірити правильність підібраних коефіцієнтів.
9.5. Метод електронно-іонного балансу (напівреакцій)
Як видно з назви, даний метод базується на складанні іонних рівнянь процесів окиснення і відновлення з наступним додаванням їх в одне рівняння.
Розглянемо даний метод, урівнявши схему з прикладу 2 методу електронного балансу: HCl + КMnO4 → Cl2 + MnCl2 + KCl + H2O.
Відомо, що при проходженні цієї реакції виділяється газ з різким запахом і відбувається знебарвлення розчину. Газ – це хлор Сl2, який утворюється в результаті процесу 2Сl– = Сl2. Дана схема урівняна за кількістю атомів. Для урівнювання за зарядами від лівої частини схеми слід відняти 2 електрони:
2Сl– – 2е = Сl2
Це – перша напівреакція – окиснення відновника.
Знебарвлення розчину зумовлене переходом іона MnO4–, який надає розчину фіолетового забарвлення в безбарвний іон Mn2+ за схемою: MnO4– ® Mn2+.
Атоми Оксигену, які входять до складу іона MnO4– при взаємодії з іонами Н+ (кисле середовище) утворюють воду Н2О; для повного перетворення одного іона MnO4–, в іон Mn2+ необхідно вісім катіонів Н+:
MnO4– + 8Н+ → Mn2+ + 4Н2О
Складемо баланс за зарядами, для чого до лівої частини схеми додамо 5 електронів:
MnO4– + 8Н+ + 5е = Mn2+ + 4Н2О
Це – друга напівреакція – відновлення окисника.
Додамо почленно схеми напівреакцій окиснення та відновлення, зрівнявши при цьому кількість відданих та приєднаних електронів (див. Метод електронного балансу):
|
2Сl– – 2е = Сl2 MnO4– + 8Н+ + 5е = Mn2+ + 4Н2О |
5 2 |
|
2MnO4– + 16Н+ + 10Сl– = 2Mn2+ + 8Н2О + 5Сl2 |
|
Ми одержали скорочене іонне рівняння. Для перевірки правильності розставлених коефіцієнтів, обчислимо кількість атомів Оксигену до і після реакції та заряди у правій і лівій частинах схеми:
|
Кількість атомів Оксигену |
|
Сумарний заряд |
||
|
до реакції |
після реакції |
до реакції |
після реакції |
|
|
2·4 = 8 |
8 |
–10 + (–2) + 16 = +4 |
2·(+2) = +4 |
|
Отже, скорочене іонне рівняння складене правильно.
Для запису окисно-відновних реакцій у молекулярній формі підберемо для кожного аніона катіон і навпаки:
|
2MnO4– + 16Н+ + 10Сl– = 2Mn2+ + 8Н2О + 5Сl2 2K+ + 6Cl– = 4Cl– + 2K+ + 2Cl– |
|
16HCl + 2КMnO4= 5Cl2 + 2MnCl2 + 2KCl + 8H2O |
Основними перевагами методу електронно-іонного балансу (напівреакції) є:
- Використання в процесі урівнювання реально існуючих іонів.
- Не треба визначати ступенів окиснення елементів до і після реакції.
- Не треба знати всі продукти реакції (вони визначаються з напівреакцій).
- Чітко видно роль середовища (див. далі).
При складанні рівнянь напівреакцій завжди виникає необхідність у збалансуванні кількостей атомів Оксигену і Гідрогену в лівій і правій частинах кожної напівреакції. Для цього існує ряд правил.
Для збалансування кількості атомів Оксигену в кислому середовищі, необхідну їх кількість вводять молекулами води, дописуючи з іншого боку реакції вдвічі більшу кількість катіонів Н+.
У лужному середовищі атоми Оксигену вводять, дописуючи на потрібній стороні рівняння подвійну кількість аніонів ОН–, а з протилежного боку – вдвічі меншу кількість молекул Н2О.
Необхідну кількість атомів Гідрогену у кислому середовищі вводять іонами Н+. У лужному – молекулами Н2О, дописуючи з протилежного боку таку ж кількість аніонів ОН–.
Зазначимо, що метод напівреакцій (іонно-електронного балансу) придатний лише для зрівнювання рівнянь реакцій, що відбуваються у водному середовищі. Метод електронного балансу – для будь якого середовища та агрегатного стану (твердий, газоподібний, розплав тощо).
9.6. Класифікація окисно-відновних реакцій
Основним критерієм класифікації окисно-відновних реакцій є місце знаходження окисника і відновника серед реагентів. За цією ознакою виділяють дві групи окисно-відновних реакцій:
1. Міжмолекулярні – окисник і відновник входять до складу різних молекул реагентів.
В межах міжмолекулярних окисно-відновних реакцій розрізняють:
а) реакції окисно-відновного сполучення:
2С+2О + О02 = 2С+4О–22, 4Al0 + 3I02 = 2Al+3I–13;
б) реакції окисно-відновного заміщення:
Fe0 + 2H+1Cl = Fe+2Cl2+ H02, 2Na0 + 2H+12O = 2Na+1OH + H02.
2. Внутрішньомолекулярні – окисник і відновник входять до складу однієї молекули реагента.
Внутрішньомолекулярними є окисно-відновні реакції розкладання:
2KN+5O–23 = 2KN+3O–22 + O02, 2N–3H+13 = N02 + 3H02.
3. Особливу групу складають окисно-відновні реакції у яких атоми одного і того ж елемента є одночасно окисником і відновником. Це – окисно-відновні реакції внутрішньомолекулярного самоокиснення-самовідновлення (диспропорціювання, дисмутації):
Cl02 + 2KOH = KCl–1 + KCl+1O + H2O,
3Cl02 + 6KOH = 5KCl–1 + KCl+5O3 + 3H2O.
Поряд з описаними реакціями є процеси, у яких атоми одного елемента, що перебувають у різних ступенях окиснення у складі різних сполук перетворюються з набуттям однакових ступенів окиснення. Це – реакції синпропорціювання (конмутації):
2H2S–2 + S+2O2 = 3S0 + 2H2O, N–3H4N+5O2 = N02 + 2H2O.
9.7. Кількісні характеристики окисно-відновних реакцій
Можливість проходження будь-якої окисно-відновної реакції у різних умовах визначається природою окисника і відновника, кислотністю середовища, температурою тощо. Усі ці фактори враховані у стандартних редокс потенціалах (СРП).
Для розуміння фізико-хімічної суті СРП, розглянемо процеси, які супроводжуються виникненням електричного струму або ним ініціюються і називаються електрохімічними. Їх вивчає фізична хімія.
При зануренні металевої пластинки (електрода) в розчин солі даного металу, можуть відбуватись процеси:
1. Якщо метал – сильний відновник, то пластинка віддає атоми металу в розчин:
Me0 + mH2O = Men+ + mH2O + n,
або Me0 = Men+ + n.
Пластинка набуває негативного заряду і до неї притягаються катіони Men+. На межі поділу метал – розчин виникає подвійний електричний шар (ПЕШ) (рис. 9.1 а).
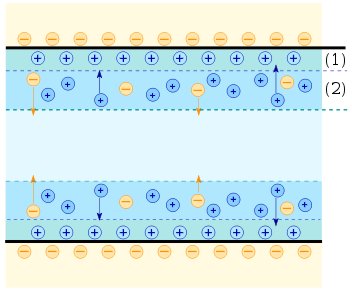
Рис. 9.1. Схема подвійного електричного шару (пояснення в тексті).
1 — шар Гуї-Чепмена, 2 — шар Штерна.
2. Якщо метал – слабкий відновник, то його іони, які містяться в розчині солі є сильними окисниками. Частина цих іонів підходить до поверхні пластинки і відновлюється за рахунок вільних електронів металу:
Men+ + n = Me0.
В результаті скупчення катіонів Men+ поверхня пластинки заряджається позитивно і притягає до себе негативно заряджені аніони (рис.9.1. б).
Різниця зарядів, що виникає в ПЕШ на межі метал – розчин, називають електродним потенціалом.
Безпосередньо виміряти потенціал окремого електрода неможливо, тому його визначають відносно стандартного водневого електрода СВЕ, потенціал якого прийнято за нуль.
СВЕ складається з платинової пластинки, зануреної в 1М розчин сульфатної кислоти H2SO4, яка омивається струменем газоподібного водню Н2 під тиском 101,325 кПа (1 атмосфера) (рис. 9.2).
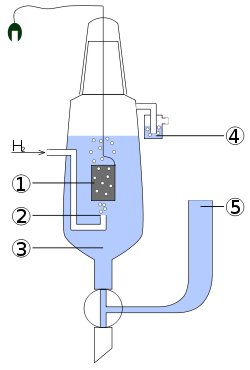
Рис. 9.2. Стандартний водневий електрод.
1 — платиновий електрод, 2 — подача водню, 3 — кислотний розчин (H+=1 mol/l), 4 — запобіжник від проникнення кисню, 5 — резервуар.
Якщо металеву пластинку занурити в 1 М розчин солі цього ж металу і з’єднати з СВЕ, то одержимо гальванічний елемент, ЕРС якого, виміряна при 25 0С характеризує СЕП металу і позначається Е0.
Відносно СВЕ деякі речовини є окисниками, а деякі – відновниками. СЕП деяких редокс-систем наведені у додатку В.
Якщо метали з цієї таблиці розмістити в ряд за зростанням СЕП, то одержимо ряд стандартних електродних потенціалів (застаріла назва – електрохімічний ряд напруг металів):
Li, K, Ba, Ca, Na, Mg, Be, Al, Mn, Cr, Zn, Fe, Cd, Co, Ni, Sn, Pb, (H), Cu, Ag, Hg, Pt, Au
металічні властивості послаблюються →
Для металів цього ряду справедливі такі правила (табл. 9.1):
1. Чим лівіше розташований метал, тим сильнішим відновником він є і тим слабшим окисником є його катіон.
2. Кожен наступний метал витісняється попереднім із розчину солі:
Fe + CuSO4 = Cu + FeSO4, Cu + HgSO4 = Hg + CuSO4.
3. Якщо метал розташований зліва від символа “Н”, він витісняє водень з розчинів кислот-неокисників (Н2SO4 розб, НСl)
Fe + Н2SO4 = FeSO4 + Н2.
4. Ряд справедливий лише для водних розчинів.
5. Лужні і лужноземельні метали з водою реагують, тому з солями у водних розчинах не взаємодіють.
Таблиця 9.1
Деякі хімічні властивості металів за положенням у ряду стандартних електродних потенціалів
|
Метал |
Реакція з О2 або повітрям |
Реакція з Н2О |
Реакція з кислотами |
Реакція із солями інших металів |
|
Li – Mg |
Горять на повітрі або в О2 |
Реагують з холодною Н2О (чим нижче у ряду, тим менш активно) |
Заміщують Гідроген у кислотах-неокисниках (чим нижче у ряду, тим менш активно) |
Витісняють з розчину солі метал, розміщений у ряду нижче |
|
Be – Fe |
Реагують з парою Н2О при нагріванні |
|||
|
Cd – Pb |
При нагріванні на повітрі утворюють оксиди |
Не реагують ні з Н2О ні з її парою |
||
|
Cu – Hg |
Реагують лише з кислотами-окисниками |
|||
|
Pt, Au |
Не реагують ні з повітрям ні з О2 |
Не реагують майже ні з якими кислотами |
Подібно до систем метал – розчин солі, визначені СЕП редокс-систем, що містять складні іони (типу MnO4–, Cr2O72– тощо). У таких системах окисником є іон, що містить елемент у вищому ступені окиснення (MnO4–, Cr2O72–), відновником – у нижчому (Mn2+, Cr3+).
Порівнюючи СЕП редокс-систем, можна визначити, чи відбудеться окисно-відновних реакцій за участю того чи іншого окисника та відновника.
Розглянемо це на конкретному прикладі. Процеси:
2Cl– = Cl2, E0 = – 1,36 B
2Br– = Br2, E0 = – 1,07 B
2I– = I2, E0 = – 0,54 B
за стандартних умов можуть відбуватись за участю окисників PbO (E0 = 1,46 В) або KMnO4 (E0 = 1,52 В). За участю K2Cr2O7 (E0 = 1,35 В) відбуваються лише дві останні реакції, а за участю HNO3 (E0 = 0,96 В) – лише остання. Таким чином, Окисно-відновна реакція відбувається тоді, коли сума E0Ox + E0Red > 0.
9.8. Вплив середовища на напрям проходження ОВР
рН середовища (концентрація катіонів гідроксонію Н3О+) впливає на глибину зміни ступенів окиснення атомів.
Так, перманганат-іон MnO4– залежно від рН середовища може відновлюватись згідно схем:
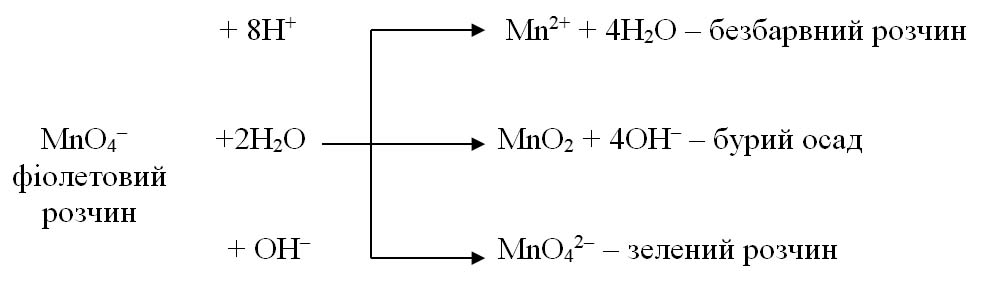
Кисле середовище створюють за допомогою розведеної сульфатної кислоти H2SO4, оскільки нітратна HNO3 є окисником, а хлоридна HCl – відновником.
Лужне середовище створюють за допомогою розчинів гідроксидів лужних і лужно-земельних металів NaOH, KOH, Ca(OH)2 тощо.
Іншим прикладом впливу середовища на продукти ОВР є окиснення іона Сr3+:
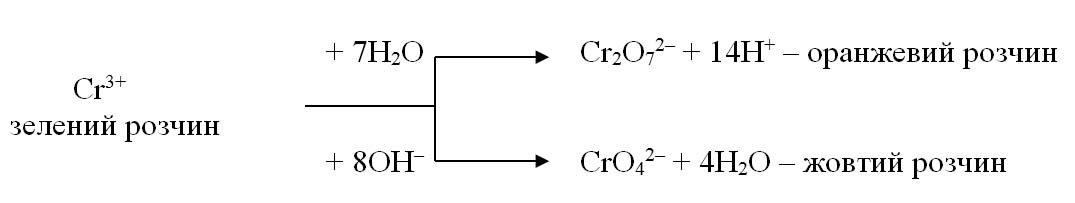
Кількісно вплив рН середовища на проходження процесу за участю іонів H+ при стандартних умовах за схемою aOx + nе + mH+ ↔ bRed, описується рівнянням Нернста-Петерса:
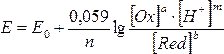
Для прикладу розрахуємо, чи відбудеться процес, який описується напівреакцією MnO4– + 8H+ + 5е = Mn2++ 4Н2О при рН = 4.
У довіднику знаходимо значення Е0(MnO4–/Mn2+) = 1,52 В. Окиснена форма – іон MnO4–, відновлена – Mn2+. Концентрацію іонів Н+ обчислимо з рівняння [H+] = 10–рН = 10–4 моль/л. Рівноважні концентрації окисненої та відновленої форм однакові. Підставимо одержані значення у рівняння Нернста-Петерса:
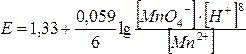 , E = 1,015.
, E = 1,015.
Отже, при даному значенні рН цей процес відбувається.
Аналогічні розрахунки можна проводити для процесів, що відбуваються за участю гідроксид-іонів ОН–, при цьому слід враховувати співвідношення рН + рОН = 14 ([Н+][ОН–] = 10–14).
9.9. Значення окисно-відновних реакцій
Окисно-відновні процеси є невід’ємним компонентом, характерним для живої і неживої матерії. Під час їх проходження змінюються склад і структура хімічних сполук, хімічні елементи переходять з одних валентних станів у інші, що має принципове значення для неорганічної та органічної хімії. Окисно-відновні реакції супроводжуються зміною кількісних і якісних параметрів систем, в яких вони відбуваються, завдяки чому широко застосовуються в якісному (ідентифікація сполук та їх структурних елементів) та кількісному аналізі (перманганатометрія, йодометрія, хроматометрія тощо).
Окисно-відновні перетворення біоорганічних сполук є провідним гарантом існування біосистем та регулятором їх енергетичного балансу.