9. ОКИСНО-ВІДНОВНІ РЕАКЦІЇ (ОВР)
9. ОКИСНО-ВІДНОВНІ РЕАКЦІЇ (ОВР)
9.7. Кількісні характеристики окисно-відновних реакцій
Можливість проходження будь-якої окисно-відновної реакції у різних умовах визначається природою окисника і відновника, кислотністю середовища, температурою тощо. Усі ці фактори враховані у стандартних редокс потенціалах (СРП).
Для розуміння фізико-хімічної суті СРП, розглянемо процеси, які супроводжуються виникненням електричного струму або ним ініціюються і називаються електрохімічними. Їх вивчає фізична хімія.
При зануренні металевої пластинки (електрода) в розчин солі даного металу, можуть відбуватись процеси:
1. Якщо метал – сильний відновник, то пластинка віддає атоми металу в розчин:
Me0 + mH2O = Men+ + mH2O + n,
або Me0 = Men+ + n.
Пластинка набуває негативного заряду і до неї притягаються катіони Men+. На межі поділу метал – розчин виникає подвійний електричний шар (ПЕШ) (рис. 9.1 а).
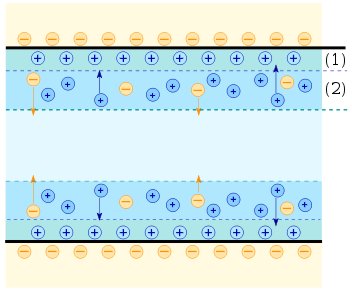
Рис. 9.1. Схема подвійного електричного шару (пояснення в тексті).
1 — шар Гуї-Чепмена, 2 — шар Штерна.
2. Якщо метал – слабкий відновник, то його іони, які містяться в розчині солі є сильними окисниками. Частина цих іонів підходить до поверхні пластинки і відновлюється за рахунок вільних електронів металу:
Men+ + n = Me0.
В результаті скупчення катіонів Men+ поверхня пластинки заряджається позитивно і притягає до себе негативно заряджені аніони (рис.9.1. б).
Різниця зарядів, що виникає в ПЕШ на межі метал – розчин, називають електродним потенціалом.
Безпосередньо виміряти потенціал окремого електрода неможливо, тому його визначають відносно стандартного водневого електрода СВЕ, потенціал якого прийнято за нуль.
СВЕ складається з платинової пластинки, зануреної в 1М розчин сульфатної кислоти H2SO4, яка омивається струменем газоподібного водню Н2 під тиском 101,325 кПа (1 атмосфера) (рис. 9.2).
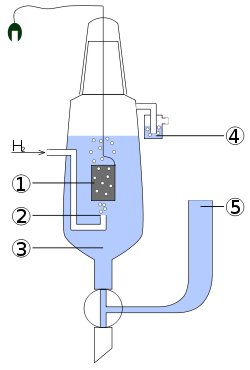
Рис. 9.2. Стандартний водневий електрод.
1 — платиновий електрод, 2 — подача водню, 3 — кислотний розчин (H+=1 mol/l), 4 — запобіжник від проникнення кисню, 5 — резервуар.
Якщо металеву пластинку занурити в 1 М розчин солі цього ж металу і з’єднати з СВЕ, то одержимо гальванічний елемент, ЕРС якого, виміряна при 25 0С характеризує СЕП металу і позначається Е0.
Відносно СВЕ деякі речовини є окисниками, а деякі – відновниками. СЕП деяких редокс-систем наведені у додатку В.
Якщо метали з цієї таблиці розмістити в ряд за зростанням СЕП, то одержимо ряд стандартних електродних потенціалів (застаріла назва – електрохімічний ряд напруг металів):
Li, K, Ba, Ca, Na, Mg, Be, Al, Mn, Cr, Zn, Fe, Cd, Co, Ni, Sn, Pb, (H), Cu, Ag, Hg, Pt, Au
металічні властивості послаблюються →
Для металів цього ряду справедливі такі правила (табл. 9.1):
1. Чим лівіше розташований метал, тим сильнішим відновником він є і тим слабшим окисником є його катіон.
2. Кожен наступний метал витісняється попереднім із розчину солі:
Fe + CuSO4 = Cu + FeSO4, Cu + HgSO4 = Hg + CuSO4.
3. Якщо метал розташований зліва від символа “Н”, він витісняє водень з розчинів кислот-неокисників (Н2SO4 розб, НСl)
Fe + Н2SO4 = FeSO4 + Н2.
4. Ряд справедливий лише для водних розчинів.
5. Лужні і лужноземельні метали з водою реагують, тому з солями у водних розчинах не взаємодіють.
Таблиця 9.1
Деякі хімічні властивості металів за положенням у ряду стандартних електродних потенціалів
|
Метал |
Реакція з О2 або повітрям |
Реакція з Н2О |
Реакція з кислотами |
Реакція із солями інших металів |
|
Li – Mg |
Горять на повітрі або в О2 |
Реагують з холодною Н2О (чим нижче у ряду, тим менш активно) |
Заміщують Гідроген у кислотах-неокисниках (чим нижче у ряду, тим менш активно) |
Витісняють з розчину солі метал, розміщений у ряду нижче |
|
Be – Fe |
Реагують з парою Н2О при нагріванні |
|||
|
Cd – Pb |
При нагріванні на повітрі утворюють оксиди |
Не реагують ні з Н2О ні з її парою |
||
|
Cu – Hg |
Реагують лише з кислотами-окисниками |
|||
|
Pt, Au |
Не реагують ні з повітрям ні з О2 |
Не реагують майже ні з якими кислотами |
Подібно до систем метал – розчин солі, визначені СЕП редокс-систем, що містять складні іони (типу MnO4–, Cr2O72– тощо). У таких системах окисником є іон, що містить елемент у вищому ступені окиснення (MnO4–, Cr2O72–), відновником – у нижчому (Mn2+, Cr3+).
Порівнюючи СЕП редокс-систем, можна визначити, чи відбудеться окисно-відновних реакцій за участю того чи іншого окисника та відновника.
Розглянемо це на конкретному прикладі. Процеси:
2Cl– = Cl2, E0 = – 1,36 B
2Br– = Br2, E0 = – 1,07 B
2I– = I2, E0 = – 0,54 B
за стандартних умов можуть відбуватись за участю окисників PbO (E0 = 1,46 В) або KMnO4 (E0 = 1,52 В). За участю K2Cr2O7 (E0 = 1,35 В) відбуваються лише дві останні реакції, а за участю HNO3 (E0 = 0,96 В) – лише остання. Таким чином, Окисно-відновна реакція відбувається тоді, коли сума E0Ox + E0Red > 0.