10. ОСНОВИ ЕЛЕКТРОХІМІЇ
Електрохі́мія — галузь науки, яка вивчає властивості систем, що містять іонні провідники, та перетворення речовин на межі поділу фаз за участю заряджених часток (іонів, електронів).
| Сайт: | Підготовка до ЗНО - Освітній портал "Академія" |
| Курс: | Підготовка до ЗНО з хімії |
| Книга: | 10. ОСНОВИ ЕЛЕКТРОХІМІЇ |
| Надруковано: | Гість |
| Дата: | Sunday 25 May 2025 5:11 AM |
10. ОСНОВИ ЕЛЕКТРОХІМІЇ
Електрохі́мія — галузь науки, яка вивчає властивості систем, що містять іонні провідники, та перетворення речовин на межі поділу фаз за участю заряджених часток (іонів, електронів).
10.1. Хімічні джерела електричного струму
Як відомо, електродні потенціали усіх редокс-систем відрізняються між собою. Ця різниця дозволяє використовувати редокс-системи для створення джерел електричного струму, у яких енергія хімічних реакцій перетворюється в електричну.
Пристрій, у якому енергія редокс-реакцій перетворюється в електричну називають гальванічним елементом (ГЕ).
Найпростішим ГЕ є елемент Даніеля-Якобі, в основі роботи якого лежить ОВР:
Zn + CuSO4 = Cu + ZnSO4
Zn0 + Cu2+ = Cu0 + Zn2+
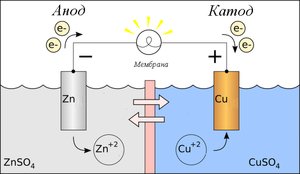
Рис. 10.1. Схема ГЕ Даніеля-Якобі.
Цей ГЕ складається з мідного і цинкового електродів, занурених у розчини відповідних сульфатів (CuSO4 та ZnSO4) і з’єднаних сольовим містком (скляна трубка, заповнена розчином калій хлориду KCl), який є “провідником” іонів і не допускає змішування розчинів солей (рис. 10.1).
Розглянемо механізм роботи ГЕ Даніеля-Якобі. Раніше зазначалось, що при зануренні металу у розчин його солі, відбувається окиснення металу або відновлення його катіонів з розчину солі, що зумовлює виникнення електрохімічного потенціалу. Це стосується і даного випадку.
На цинковому електроді відбувається процес Zn0 – 2е = Zn2+,. який зумовлює виникнення негативного заряду на електроді за рахунок адсорбції аніонів.
На мідному електроді проходить реакція Cu2+ + 2е = Cu0, відбувається адсорбція катіонів, за рахунок чого електрод набуває позитивного заряду.
Якщо цинковий електрод з’єднати з мідним за допомогою зовнішнього провідника, то надлишок електронів з цинкового електрода по провіднику перейде на мідний. На мідному електроді надлишок електронів буде спонукати дальше проходження реакції Cu2+ + 2е = Cu0. Сульфат-іони SO42–, які вивільняються при цьому, по сольовому містку перейдуть до цинкового електрода, де сполучаючись з катіонами Zn2+ утворять ZnSO4.
Поряд з цим, катіони Zn2+ перейдуть тим же шляхом у розчин СuSO4, де заміщатимуть іони Cu2+ за схемою Zn2+ + СuSO4 = Cu2+ + ZnSO4. З часом весь розчин СuSO4 перетвориться у розчин ZnSO4. ГЕ буде працювати, поки весь цинк не перейде в розчин (у вигляді іонів Zn2+).
Вважається, що струм проходить від точки з вищим потенціалом (умовно позначається “+”) до точки з нижчим (умовно позначається “–”). Позитивного заряду набуває мідний електрод, тому знак “+” одержує він (анод), а цинковий – негативного, тому йому приписують знак “‑”(катод).
Кількісною характеристикою ГЕ є його електрорушійна сила (ЕРС), тобто максимальна різниця потенціалів на аноді та катоді. Для випадку ГЕ Даніеля-Якобі знаходимо значення потенціалів систем Сu2+/Cu (+ 0,338 В) та Zn2+/Zn (– 0,763 В). Маємо:
ЕРС = ![]() = + 0,338 В – (– 0,763) В = 1,101 В.
= + 0,338 В – (– 0,763) В = 1,101 В.
Одним з видів ГЕ є паливний елемент. У ньому електричний струм утворюється за рахунок окиснення палива (молекулярного водню Н2). Окисник (кисень повітря О2) і відновник (паливо) подаються у систему ззовні. При роботі паливного елемента відбуваються процеси:
Н2 – 2е = 2Н+,
О2 + 2Н2О + 4е = 4ОН–,
сумарно 2Н2 + О2 + 2Н2О = 4ОН– + 4Н+ або 2Н2 + О2 = 2Н2О,
тобто фактично зводяться до горіння Н2.
Робота розглянутих ГЕ не є постійною і припиняється у випадку закінчення одного з учасників редокс-процесу. Практичне значення мають джерела постійного електричного струму.
Як джерела постійного електричного струму ефективні і зручні в роботі акумулятори – ГЕ багаторазового використання.
Розглянемо для прикладу роботу кислотного свинцевого акумулятора. Він побудований із занурених у розчин сульфатної кислоти H2SO4 електродів – чисто свинцевого і аналогічного, вкритого шаром плюмбум (IV) оксиду PbO2. При роботі акумулятора на електроді без покриття відбувається реакція:
Pb + SO42– – 2е = PbSO4,
на іншому електроді іде процес:
PbO2 + 4H+ + + SO42– + 2е = PbSO4 + 2H2O.
Сумарно: Pb + PbO2 + 2H2SO4 = 2PbSO4 + 2H2O.
Коли весь Pb і PbO2 перетворюються у PbSO4, акумулятор “сідає”. Зарядити його можна пропускаючи через акумулятор постійний електричний струм. При цьому відбуваються реакції:
|
PbSO4 + 2е = Pb2+ + SO42– 2PbSO4 + 2H2O – 2е = PbO2 + 4H+ + SO42– |
|
2PbSO4 + 2H2O = Pb + PbO2 + 2H2SO4 |
10.2. Електроліз
У розглянутих вище редокс-реакціях процес окиснення завжди супроводжувався процесом відновлення. Будь-яка з них може використовуватись у ГЕ для генерації електричного струму. Постає запитання “Чи можливий зворотній процес – перетворення електричної енергії у хімічну?”
Такі процеси реалізуються при проходженні постійного електричного струму через систему з двох електродів, під’єднаних до джерела струму і занурених у розплав або розчин електроліту.
Реакції, що відбуваються під дією постійного електричного струму в розчинах або розплавах електролітів називають електролізом. Електроліз здійснюють у приладах – електролізерах (рис. 10.2).
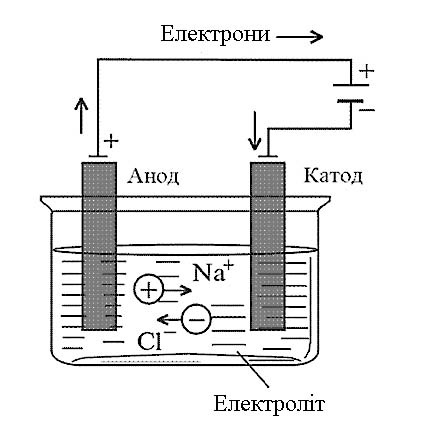
Рис.10.2. Схема електролізу розплаву NaCl.
Розглянемо докладніше деякі випадки електролізу.
10.3. Електроліз розплавів
Відомо, що іонні сполуки (солі, гідроксиди) дисоціюють не лише у розчинах, а й у розплавах, наприклад NаCl = Nа+ + Cl–.
Якщо у розплав NаCl пропускати постійний електричний струм, то катіони Nа+ будуть рухатись до негативного електрода (катода), аніони Cl‑ – до позитивного (анода) (рис. 10.2).
За рахунок підвищеної концентрації електронів на катоді відбувається процес Nа++ 2e = Nа.
Така ж кількість електронів перейде на анод за рахунок реакції 2Cl‑ ‑ 2e = Cl2.
Сумарний процес при електролізі розплаву NаCl описується схемою:
2Nа+ + 2Cl– = 2Nа + Сl2,
2NаCl = 2Nа + Сl2.
Таким чином, на катоді буде виділятись металічний натрій Na, а на аноді – газоподібний хлор Cl2.
За стандартних умов ця реакція не відбувається, а іде лише зворотній процес.
Електроліз розплаву натрій сульфату Na2SO4.
Сіль дисоціює у розплаві: Na2SO4 = 2Na+ + SO42–.
Процеси на електродах:
|
К (–) Na+ + e = Na А (+) SO42– – 4e = 2SO3 + O2 |
4 1 |
|
4Na+ + 2SO42– = 4Na + 2SO3 + O2 2Na2SO4 = 4Na + 2SO3 + O2 |
|
Електроліз розплаву калій нітрату KNO3.
KNO3 = K+ + NO3–.
|
К (–) K+ + e = K А (+) 2NO3– – 2e = 2NO2 + O2 |
2 1 |
|
2K+ + 2NO3– = 2K + 2NO2 + O2 2KNO3 = 2K + 2NO2 + O2 |
|
Електроліз розплаву калій гідроксиду KOН.
KOН = K+ + OН–.
|
К (–) K+ + e = K А (+) 4ОН– – 4e = 2Н2O + O2 |
4 1 |
|
4K+ + 4OН– = 2K + 2Н2O + O2 4KОН = 4K + 2Н2O + O2 |
|
Як бачимо, при електролізі розплавів солей та основ на катоді завжди виділяється метал, а на аноді – газоподібний продукт (галоген – при наявності галогенідів, або кисень – при наявності в розплаві оксигеновмісних аніонів).
Електроліз розплавів уперше провів Г. Деві (Англія) у 1807 – 1808 рр., добувши таким чином калій, натрій, магній, стронцій, барій, кальцій.
10.4. Електроліз водних розчинів
При електролізі водних розчинів електролітів на електродах поряд з розряджанням катіонів і аніонів або замість них можуть відновлюватись або окиснюватись молекули води.
Для визначення частинок, які беруть участь у катодному процесі, користуються рядом стандартних електродних потенціалів. Залежно від положення металу в цьому ряду, можливі такі варіанти (табл. 10.1).
- Катіони металів, розміщених правіше від символу “Н” відновлюються до вільного металу: Сu2+ + 2e = Cu.
- Катіони металів, розміщених лівіше від символу “Mn” не відновлюються, а відновлюються молекули води: Н2О + 2e = Н2 + 2ОН–.
- Катіони металів, розміщених між символами “Al” i “H” відновлюються паралельно з молекулами Н2О: Сd2+ + 2e = Cd, 2Н2О + 2e = Н2 + 2ОН–.
При цьому більша кількість електрики іде на відновлення катіонів металу.
Таблиця 10.1
Катодні процеси у водних розчинах солей
|
Ряд стандартних ектродних потенціалів |
|||
|
Li, K, Ca, Na, Mg, Al |
Mn, Zn, Fe, Ni, Sn, Pb |
H2 |
Cu, Ag, Hg, Pt, Au |
|
Н2О + 2e = Н2 + 2ОН– |
Меn+ + ne = Me0 Н2О + 2e = Н2 + 2ОН– |
|
Меn+ + ne = Me0 |
В анодному процесі розряджаються тільки аніони безоксигенових кислот (Hal–, S2–) та ОН–-групи:
2Cl– – 2e = Cl2, 4OH– – 4e = 2H2O + O2.
У присутності іонів F–, SO42–, NO3–, PO43–, CO32– та деяких інших окиснюються лише молекули Н2О: 2Н2О – 4e = 4H+ + O2 (табл. 10.2).
Таблиця 10.2
Анодні процеси у водних розчинах електролітів
|
Анод |
Аніон An– |
|
|
безоксигеновий або ОН– |
оксигеновмісний і F– |
|
|
Нерозчинний |
An– – ne = An0 4OH– – 4e = 2H2O + O2 |
2Н2О – 4e = 4H+ + O2 |
|
Розчинний |
Окиснення матеріалу анода Me0 + ne = Men+ |
|
Проілюструємо сказане кількома прикладами.
Електроліз водного розчину купрум (ІІ) хлориду CuCl2.
У водному розчині сіль дисоціює за схемою: СuCl2 = Сu2+ + 2Cl–.
Оскільки Сu розміщений правіше від символу “Н”, то на катоді відновлюються катіони Сu2+, а на аноді окиснюються аніони Cl–:
|
К (–) Сu2+ + 2e = Cu А (+) Cl– – 2e = Cl2 |
1 1 |
|
CuCl2 = Cu + Cl2 |
|
Електроліз водного розчину кадмій (ІІ) сульфату CdSO4.
У водному розчині сіль дисоціює за схемою: СdSO4 = Сd2+ + SO42–.
Оскільки Сd лежить між символами “Al” i “Н”, то на катоді паралельно відновлюються катіони Сu2+ та молекули Н2О, на аноді окиснюються молекули Н2О:
К (–) Сd2+ + 2e = Cd, 2Н2О + 2e = Н2 + 2ОН–.
А (+) 2Н2О – 4e = 4H+ + O2.
Сумарну схему реакції у цьому випадку записати неможливо, оскільки невідомо, яка кількість електрики затрачається на відновлення молекул Н2О, а яка – на розряджання катіонів Сd2+.
Електроліз водного розчину калій нітрату KNO3.
Оскільки К розміщений зліва від символу “Mn”, то катіони К+ не будуть відновлюватись на катоді, а аніони NO3– – окиснюватись на аноді у водному розчині. В катодному та анодному процесах участь беруть лише молекули Н2О:
|
К (–) 2Н2О + 2e = Н2 + 2ОН– А (+) 2Н2О – 4e = 4H+ + O2 |
2 1 |
|
6Н2О = 4ОН– + 4H+ + 2Н2 + О2 2Н2О = 2Н2 + О2 |
|
Електроліз водного розчину натрій гідроксиду NаOН.
Як і у попередньому прикладі, на катоді будуть відновлюватись молекули Н2О. На аноді будуть окиснюватись ОН–-групи:
|
К (–) 2Н2О + 2e = Н2 + 2ОН– А (+) 4OH– – 4e = 2H2O + O2 |
2 1 |
|
4Н2О + 4ОН– = 4ОН– +2H2O + 2Н2 + О2 2Н2О = 2Н2 + О2 |
|
Досі ми розглядали електроліз з інертним анодом, який не окиснюється при електролізі (графіт, платина тощо). Проте, часто електроліз проводять з розчинним анодом (мідний, нікелевий).
При електролізі з розчинним анодом катодні процеси проходять як і у випадку з нерозчинним. Основною відмінністю є те, що окиснюється матеріал анода і це іноді призводить до появи в розчині нових катіонів.
Розглянемо для прикладу електроліз водного розчину купрум (ІІ) сульфату CuSO4 з мідним анодом:
К (–) Сu2+ + 2e = Cu
А (+) Сu – 2e = Cu2+.
Таким чином, метал, що розчинився на аноді, осідає на катоді. Це явище часто застосовують при добуванні металів високої чистоти.
10.5. Закони електролізу
Кількісні закономірності електролізу встановив англійський вчений М. Фарадей у 30-х рр. ХІХ ст. На основі власних досліджень він сформулював закони:
1. Маса речовини, утвореної при електролізі, прямо пропорційна кількості електрики, що пройшла через систему:
m = kQ
де m – маса речовини, k – електрохімічний еквівалент, що визначає масу речовини, утвореної при проходженні струму силою 1А протягом 1 с, Q – кількість електрики (Q= It, І – сила струму, t – час електролізу).
2. Однакові кількості електрики виділяють з різних сполук однакові кількості продуктів електролізу (табл. 10.3).
Таблиця 10.3
Результати електролізу деяких сполук
|
Сполука |
Електродний процес |
Кількість електронів, n |
Молярна маса, М |
Молярна маса еквівалента, |
|
AgNO3 |
Ag+ + e = Ag |
1 |
107,9 |
107,9 |
|
CuSO4 |
Cu2+ + 2e = Cu |
2 |
63,54 |
31,77 |
|
TiCl3 |
Ti3+ + 3e = Ti |
3 |
204,4 |
68,1 |
|
SnCl4 |
Sn4+ + 4e = Sn |
4 |
118,7 |
29,7 |
Кількість моль еквівалентів сполук усіх сполук становить 1 моль.
Експериментально встановлено, що для виділення 1 моль еквівалента речовини необхідно 96485 Кл електрики (число Фарадея, F).
Тоді 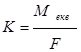 або
або ![]() , де n – кількість електронів.
, де n – кількість електронів.
У загальному випадку маємо: 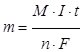 .
.
Для обчислення об’єму газоподібних речовин використовують аналогічну формулу, замінивши М на Vm (молярний об’єм, 22,4 л/моль):
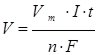
10.6. Застосування електролізу
Електроліз використовують для:
– одержання металів (див. Метали);
– одержання активних неметалів (H2, F2, O2, Cl2);
– одержання лугів (NaOH, KOH);
– очищення металів (див. Метали);
– покриття металів іншими металами (гальваностегія);
– копіювання рельєфних виробів (гальванопластика).
Найчастіше проводять електроліз водних розчинів, оскільки для одержання розплавів неорганічних сполук необхідні високі температури.