11. РОЗЧИНИ
11. РОЗЧИНИ
| Сайт: | Підготовка до ЗНО - Освітній портал "Академія" |
| Курс: | Підготовка до ЗНО з хімії |
| Книга: | 11. РОЗЧИНИ |
| Надруковано: | Гість |
| Дата: | Wednesday 2 July 2025 4:59 AM |
11. РОЗЧИНИ
Розчини і процеси розчинення відіграють значну роль в органічному і мінеральному світі Землі. Поверхневі і підземні води – це водні розчини. Повітря – розчин газів один в одному, сік рослин, кров – теж розчини. Засвоєння їжі супроводжується розчиненням поживних речовин. У всіх галузях сільського господарства, медицини використовуються розчини.
Розчин – гомогенна система змінного складу, складається з двох або більше компонентів і продуктів їх взаємодії.
Компонент розчину, який перебуває у тому ж агрегатному стані, що й розчин називають розчинником. Інші компоненти розчину – розчинені речовини.
У випадку, коли всі компоненти розчину окремо перебувають в одному агрегатному стані (вода і оцтова кислота), розчинником вважають той, який кількісно переважає в даному розчині.
Окремо взяті розчинники і розчинені речовини можуть перебувати у будь-якому агрегатному стані.
Найпоширенішими є рідкі розчини і вони мають найбільше значення. Основними неорганічним розчинником є вода, унікальні фізичні властивості якої зумовлюють її широке застосування як розчинника (див. Вода). Іноді, як неорганічні розчинники застосовують рідкий амоніак NH3, сірковуглець CS2 тощо. Поширеними органічними розчинниками є оцтова кислота СН3СООН, бензен С6Н6, N,N-диметилформамід (ДМФА) НСON(CH3)2, тетрахлорметан CCl4, пірідин C5H5N, гексан C6H14, метанол CH3OH тощо.
Властивості та стійкість розчинів залежать від розмірів частинок розчиненої речовини. З цієї точки зору розрізняють зависі (суспензії, емульсії), колоїдні та істинні розчини.
Тверді частинки зависі, що утворюють суспензії мають розміри 10-5 – 10-7 м. Вони є нестійкі в часі – завислі частинки осідають на дно (вода + глина) або спливають на поверхню (вода + тирса).
Зависі утворені рідинами (молоко, олія, креми) називають емульсіями.
Коли розміри частинок розчиненої речовини не перевищують 10-9 м, система є стійкою і не розшаровується з часом. Такі розчини називають істинними (молекулярними).
Проміжними між істинними розчинами і зависями є колоїдні розчини з розмірами частинок розчиненої речовини 10-7 – 10-9 м.
Надалі ми будемо розглядати істинні розчини.
11.1. Класифікація істинних розчинів
Класифікують істинні розчини за різними ознаками:
– природою розчинника: водні і неводні (спиртові, бензенові);
– значенням рН: нейтральні, кислі, лужні;
– агрегатним станом розчинника: рідкі, тверді (сплави, скло), газові (повітря);
– концентрацією розчиненої речовини: концентровані і розбавлені;
– забарвленням: забарвлені і безбарвні;
– електропровідністю: електролітів і неелектролітів;
– ступеня досягнення межі розчинності: насичені, ненасичені, пересичені.
Не слід плутати поняття “насичений” і “концентрований” та “ненасичений” і “розбавлений” розчини. Так, розчин натрій хлориду NaCl (добре розчинний у воді) може бути ненасиченим, але концентрованим, а розчин аргентум хлориду AgCl (малорозчинний у воді) – насиченим, але розбавленим.
Насиченим називають розчин, у якому за певних умов (температура, розчинник) дана речовина більше не розчиняється.
11.2. Розчинення речовин. Кристалогідрати
Розчинення – процес рівномірного розподілу частинок розчиненої речовини в об’ємі розчину. Розчинення – самовільний процес.
Перехід речовини у розчин супроводжується поступовим збільшенням її концентрації. Зворотний процес – виділення речовини з розчину – кристалізація. На початку процесу утворення розчину переважає процес розчинення, а у певний момент настає динамічна рівновага між розчиненням і кристалізацією.
Розчинення не можна розглядати як механічний процес, оскільки властивості розчинника і розчинених речовин у розчині змінюються. Про це свідчать такі факти:
- Об’єм розчину ніколи не дорівнює сумі об’ємів окремо взятих компонентів – “контракція” (500 мл води + 500 мл етанолу = 940 мл);
- Зміна температури при розчиненні (NH3 + H2O – охолодження, H2SO4 + H2O – розігрівання);
- Зміна забарвлення (білий CuSO4 і безбарвна H2O утворюють розчин блакитного кольору).
Ці явища зумовлені фізичними та хімічними факторами. Вплив їх пояснюють відповідно фізична та хімічна теорії утворення розчинів.
Прихильники фізичної теорії (Я. Вант-Гофф, В. Оствальд, Ф. Рауль) розглядали процеси розчинення як фізичне явище. Розподіл молекул розчиненої речовини між молекулами розчинника відбувається за рахунок дифузії, при цьому будь-яка міжмолекулярна взаємодія виключена.
Хімічна теорія розчинення (Д.І. Менделєєв, І.А. Каблуков, М.С. Курнаков) передбачала хімічну взаємодію між молекулами розчинника і розчиненої речовини, яка веде до утворення більш-менш стійких продуктів.
Фізична та хімічна теорії лягли в основу сучасної фізико-хімічної теорії утворення розчинів, яка враховує фізичні та хімічні процеси при розчиненні. Фізичними явищами є розподіл молекул розчиненої речовини між молекулами розчинника шляхом дифузії і взаємодія між ними за рахунок електростатичних сил: диполь-дипольна, міжіонна тощо.
Фізичні сили діють на великих відстанях і передують хімічним, які починають діяти на відстані діаметра молекули і перебудовують електронні оболонки атомів або іонів.
Сукупність фізичних та хімічних процесів взаємодії розчиненої речовини з розчинником називають сольватацією (у випадку, коли розчинником є вода – гідратацією). Сполуки змінного складу, що утворюються у процесі сольватації називають сольватами (у випадку води – гідратами).
Розглянемо сутність процесу утворення розчину на прикладі розчинення твердої речовини у рідині (NaCl у Н2О).
NaCl – кристалічна іонна сполука, у водному розчині існують іони Na+ та Cl–. Між молекулами води діють водневі зв’язки і сили Ван-дер-Ваальса. Процес розчинення починається з орієнтації диполів води відносно кристалічної гратки NaCl. Між розміщеними на поверхні кристалу NaCl іонами Na+ та Cl– та диполями води виникає іон-дипольна взаємодія. Диполі води орієнтуються так, що до іонів Na+ вони обертаються негативним, а до іонів Cl– – позитивним полюсом. Внаслідок взаємодії з диполями води іони Na+ та Cl– вириваються з поверхні кристала, гідратуються і дифундують в розчинник. Кристал NaCl розпадається на гідратовані іони, які утворюють з водою гомогенну систему – іонний розчин (рис. 11.1).
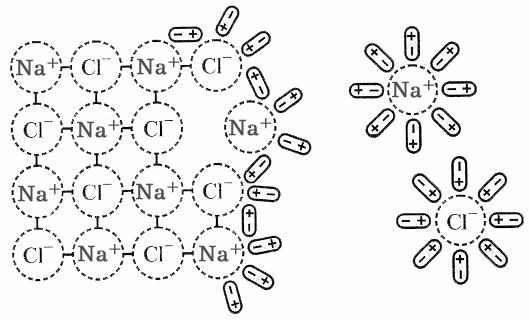
Рис. 11.1. Схема розчинення NaCl у воді.
Іноді гідратна вода настільки міцно зв’язана з розчиненою речовиною, що при виділенні речовини з розчину виходить до складу її кристалів.
Кристалічні речовини, до складу яких входить вода називають кристалогідратами, а воду у їх складі – кристалізаційною.
Склад кристалогідратів виражають, вказуючи у формулі кількість молекул кристалізаційної води, що припадає на одну молекулу речовини. Так, запис CuSO4∙5H2O означає, що в кристалогідраті на одну молекулу CuSO4 припадає 5 молекул H2O, а запис 2CаSO4∙H2O або CаSO4∙0,5H2O – на одну молекулу Н2О припадає 2 молекули CаSO4.
Деякі речовини утворюють кристалогідрати з різною кількістю молекул води. Так, CoCl2 утворює кристалогідрати складу CoCl2∙хН2О, де х = 1, 2, 4 або 6. Залежно від кількості молекул кристалізаційної води змінюється забарвлення кристалогідрату. Розчин CoCl2 – рожево-червоного кольору (гідратовані іони Co2+), кристалогідрат CoCl2∙6Н2О – рожево-червоний, CoCl2∙4Н2О – рожевий, CoCl2∙2Н2О – синьо-фіолетовий, CoCl2∙Н2О – темно-синій, CoCl2 – блідо-синій.
Більшість кристалогідратів – сполуки нестійкі і легко втрачають кристалізаційну воду. Na2CO3∙10Н2О втрачає воду при 20 0С, Na2SO4∙10Н2О – при 32 0С, СuSO4∙5Н2О – при тривалому нагріванні.
11.3. Теплові явища при розчиненні
Як зазначалось вище, при утворенні розчину відбуваються процеси:
- Взаємодія розчинника з частинками розчиненої речовини – сольватація;
- Руйнування структури розчиненої речовини (кристалічної гратки) – іонізація;
- Розподіл сольватованих частинок в об’ємі розчину – дифузія.
Сольватація супроводжується виділенням теплоти (ΔНс < 0), іонізація – поглинанням теплоти (ΔНі > 0). Залежно від співвідношення ΔНс та ΔНі процес розчинення може бути екзо- або ендотермічним.
Теплота, що виділяється або поглинається при розчиненні, називається теплотою розчинення. Розчинення сульфатної кислоти H2SO4 у воді є екзотермічним, а розчинення СaCl2 – ендотермічним процесом.
11.4. Залежність розчинності речовин від різних факторів
Розчинність визначається трьома факторами: природою розчинника, природою розчиненої речовини (агрегатний стан) і зовнішніми умовами (температура, а для газів і тиск).
Вплив природи розчинника і розчиненої речовини виражається правилом “подібне розчиняється в подібному”. Полярні та іонні сполуки добре розчиняються в полярних розчинниках (вода, спирти, ДМФА), а неполярні (прості речовини, вуглеводні) – у неполярних (вуглеводні, тетрахлорметан). Так, галогеноводні (полярні молекули) добре розчинні у воді (полярний розчинник), але погано розчинні у бензені (неполярний розчинник). З іншого боку, у воді не розчиняються галогенпохідні вуглеводнів (тетрахлорметан, дихлоретан), які добре розчинні у бензені.
Вплив температури. Зі зростанням температури, розчинність більшості речовин зростає, а при зниженні – зменшується. Часто тверді речовини розчиняють при нагріванні, а потім при охолодженні розчину частина їх викристалізовується. Такий метод використовують для очистки речовин і називають кристалізацією.
Якщо гарячий насичений розчин обережно охолоджувати, то розчинена речовина може не кристалізуватись. Утворюється пересичений розчин. Пересичені розчини нестійкі і навіть при незначному струшуванні починається спонтанна кристалізація. Теж саме спостерігається при внесенні кристалика речовини (“затравки”) у її пересичений розчин, або терті скляною паличкою до стінок посудини, що веде до утворення центрів кристалізації. Легко утворюють пересичені розчини кристалогідрати натрій тіосульфату Na2S2O3∙5H2O, натрій тетраборату (бура) Na2B4O7∙10H2O, натрій сульфату Na2SO4∙10H2O.
Існують речовини, розчинність яких зі зростанням температури зменшується. Це, зокрема, кальцій гідроксид Са(ОН)2, кальцій сульфат CaSO4. Залежність розчинності речовин від температури зображається кривими розчинності (рис. 11.2).
За кривими розчинності можна знайти коефіцієнт розчинності і масу кристалів, що утворюються при охолодженні розчину в певному інтервалі температур.
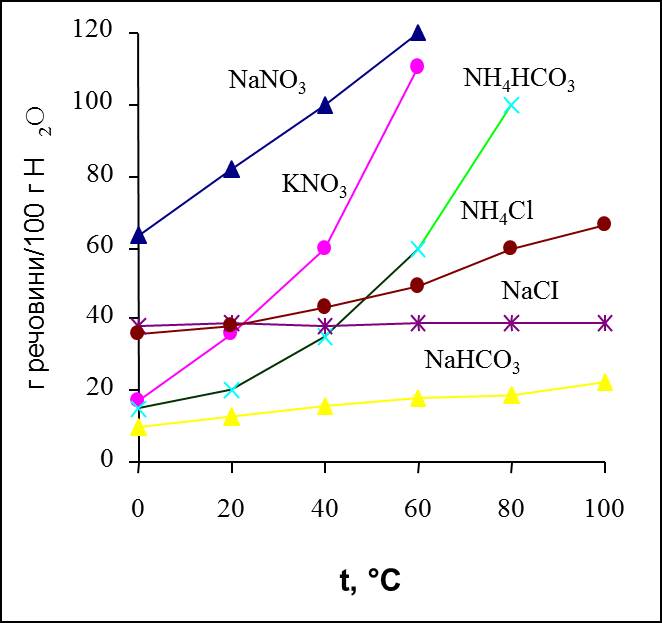
Рис.11.2. Залежність розчинності деяких солей від температури.
Як і для твердих тіл, розчинність рідин у рідинах зі зростанням температури зростає. Температура, вище або нижче якої речовини необмежено розчинні одна в одній, називається критичною. Так, для системи вода – фенол критичною є температура 66,4 0С, нижче якої вони обмежено розчинні один в одному, а вище – необмежено.
Розчинність газів у рідинах зі зростанням температури зменшується. Гази, що не утворюють сполук з розчинником, погано розчиняються у ньому (табл. 11.1). Як видно з табл. 11.1, гази, що не утворюють сполук з водою (азот N2, кисень O2) дуже мало у ній розчинні. Якщо ж процес розчинення супроводжується утворенням хімічної сполуки (H2CO3, HCl + HClO, NH3∙H2O), то розчинність помітно зростає.
Таблиця 11.1
Розчинність деяких газів у воді при різних температурах
|
Газ |
Температура, 0С |
||||
|
0 |
20 |
40 |
60 |
||
|
не взаємодіють з водою |
N2 |
0,024 |
0,016 |
0,012 |
0,01 |
|
O2 |
0,049 |
0,031 |
0,023 |
0,019 |
|
|
взаємодіють з водою |
CO2 |
1,713 |
0,878 |
0,530 |
0,360 |
|
Cl2 |
4,60 |
2,30 |
1,48 |
1,24 |
|
|
HCl |
525 |
440 |
390 |
340 |
|
|
NH3 |
1176 |
702 |
405 |
214 |
|
Вплив тиску спостерігається лише на розчинність газів і непомітний при розчиненні рідин чи твердих речовин. Зі зростанням тиску розчинність газів збільшується. Кількісно це описується законом Генрі: при сталій температурі розчинність газу Х в рідині прямо пропорційна його парціальному тиску:
СХ = КХрХ
де СХ – концентрація газу в насиченому розчині, моль/л;
КХ – стала Генрі для газу Х, моль∙л–1∙Па–1;
рХ – парціальний тиск газу Х на розчином, Па.
Закон Генрі справедливий лише для газів, що не взаємодіють з розчинником.
Взаємний вплив розчинених речовин. Якщо у деякому розчиннику вже розчинені певні речовини, то інші речовини в ньому розчиняються гірше. Найсильніше на це впливають електроліти, що пояснюється сольватацією іонів, яка в свою чергу веде до зменшення концентрації вільних молекул розчинника. Та частина молекул розчинника, яка зв’язана з іонами електроліту, не є розчинником для інших речовин.
Кількісно розчинність твердих речовин характеризується коефіцієнтом розчинності ks – відношення маси речовини mB у насиченому при даній температурі розчині до маси розчинника mS:
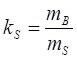
Розчинність S – максимальна маса речовини mB, г, яка може розчинитись у 100 г розчинника за даних умов:
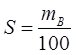
За здатністю до розчинення розрізняють легкорозчинні (більше 10 г речовини на 100 г води), малорозчинні (0,01 – 1 г), важкорозчинні (до 0,01 г) (табл. 11.2). Абсолютно нерозчинних речовин не існує.
Таблиця 11.2
Розчинність речовин
|
|
Розчинність при 20 0С |
Кількісні параметри |
Приклад |
|
Речовини |
добре розчинні |
> 10 г речовини в 100 г Н2О |
35,8 г натрій хлориду NaCl в 1 л Н2О |
|
малорозчинні |
від 10–3 г до 10 г речовини в 100 г Н2О |
0,17 г кальцій гідроксиду Са(ОН)2 в 1 л Н2О |
|
|
практично нерозчинні |
< 10–3 г речовини в 100 г Н2О |
2,3∙10–4 г барій сульфату BaSO4 в 1 л Н2О |
11.5. Способи вираження складу розчинів
Важливою характеристикою будь-якого розчину є його склад. Склад розчину можна описати з якісного і з кількісного боку.
Для якісної характеристики розчинів використовують поняття “розведений” (містить відносно невелику кількість розчиненої речовини) і “концентрований” (містить відносно велику кількість розчиненої речовини).
Хімікам при роботі з розчинами необхідно знати їх кількісний склад, який виражається різними величинами.
Кількісно склад розчинів виражають через безрозмірні відносні величини – частки (масову, об’ємну, молярну) і розмірні величини – концентрації (масову, молярну, молярну концентрацію еквівалента).
Частка показує відносну кількість компонента, порівняно із загальною кількістю розчину.
Концентрація показує відношення маси (об’єму або кількості розчиненої речовини) до об’єму (маси) розчину або розчинника.
Розглянемо докладніше вираження складу розчинів у частках. Введемо позначення: m – маса розчину, V – об’єм розчину, r – густина розчину, mS – маса розчинника, mB – маса розчиненої речовини, VB – об’єм розчиненої речовини, nB – кількість моль розчиненої речовини, ![]() – кількість речовини еквівалента розчиненої речовини.
– кількість речовини еквівалента розчиненої речовини.
- Масова частка (ω – омега) – відношення маси компонента mB до маси розчину m:
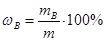 . Виражається у частках від одиниці або у відсотках. Так, запис «масова частка H2SO4 у водному розчині становить 15%», означає, що у 100 г розчину сульфатної кислоти міститься 15% H2SO4 і 85% води.
. Виражається у частках від одиниці або у відсотках. Так, запис «масова частка H2SO4 у водному розчині становить 15%», означає, що у 100 г розчину сульфатної кислоти міститься 15% H2SO4 і 85% води. - Об’ємна частка (φ – фі) – відношення об’єму компонента VB до об’єму розчину V:
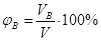 . Виражається у частках від одиниці або у відсотках. Найчастіше використовується для характеристики складу газових сумішей і розчинів, утворених кількома рідинами. Наприклад, склад повітря в об’ємних частках: 21% кисню О2 і 79% азоту N2.
. Виражається у частках від одиниці або у відсотках. Найчастіше використовується для характеристики складу газових сумішей і розчинів, утворених кількома рідинами. Наприклад, склад повітря в об’ємних частках: 21% кисню О2 і 79% азоту N2. - Молярна частка (χ – хі) – відношення кількості моль компонента νB до сумарної кількості компонентів Σν:
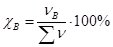 . Виражається у частках від одиниці або у відсотках.
. Виражається у частках від одиниці або у відсотках.
Оскільки переважна кількість розчинів – рідкі, їх зручніше вимірювати за об’ємом, а не за масою, тому у хімії частіше застосовують об’ємні концентрації.
- Молярна концентрація (С – це, молярність) – відношення кількості моль розчиненої речовини νB до об’єму розчину V:
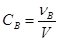 . Оскільки [νB] = моль, а [V] = л, то [С] = моль/л = М.
. Оскільки [νB] = моль, а [V] = л, то [С] = моль/л = М.
Існують загальноприйняті назви розчинів різної молярної концентрації:
1 моль/л – 1 М – одномолярний;
2 моль/л – 2 М – двомолярний;
0,1 моль/л – 0,1 М – децимолярний;
0,02 моль/л – 0,02 М – двосантимолярний;
0,003 моль/л – 0,003 М – тримілімолярний.
2. Масова концентрація (ρ – ро) – відношення маси розчиненої речовини mB до об’єму розчину V: ![]() . Якщо [m] = г (кг), а [V] = л (м3), то [ρ] = г/л (кг/м3).
. Якщо [m] = г (кг), а [V] = л (м3), то [ρ] = г/л (кг/м3).
Для двокомпонентних розчинів числові значення масової концентрації та густини збігаються.
3. Молярна концентрація еквівалента (Сн – це ен, нормальна концентрація, нормальність) – відношення кількості моль еквівалентів розчиненої речовини ![]() , до об’єму розчину V:
, до об’єму розчину V: ![]() . Розмірність така ж як у молярної концентрації.
. Розмірність така ж як у молярної концентрації.
На основі співвідношення для обчислення молярної концентрації еквівалента і наслідку із закону еквівалентів, можна записати:
![]() ,
, ![]() або
або ![]() ,
,
де ![]() і
і ![]() – нормальності розчинів реагентів, у розчинах об’ємом відповідно VB і VA.
– нормальності розчинів реагентів, у розчинах об’ємом відповідно VB і VA.
На основі одержаної залежності можна обчислити потрібні для реакції об’єми розчинів реагентів, і навпаки, знаючи їх об’єми, визначити концентрації. Розрахунки такого типу здійснюють в аналітичній хімії при визначенні концентрацій розчинів методами титриметрії.
Знаючи ![]() (фактор еквівалентності речовини В) можна перейти від Сн до СB і навпаки: СВ =
(фактор еквівалентності речовини В) можна перейти від Сн до СB і навпаки: СВ = ![]() Сн. Це відношення легше запам’ятати, знаючи, що Сн не може бути меншими від СВ.
Сн. Це відношення легше запам’ятати, знаючи, що Сн не може бути меншими від СВ.
Інші назви розчинів різної нормальності:
1н. – 1 моль-екв./л – однонормальний розчин;
0,1н. – 0,1 моль-екв./л – децинормальний розчин;
0,02 н. – 0,02 моль-екв./л – двосантинормальний розчин.
Окреслені вище положення узагальнено в табл. 11.3.
Таблиця 11.3.
Способи вираження концентрації розчинів
|
Характеристика |
Частка |
Концентрація |
|||
|
Масова |
Об’ємна |
Молярна |
Масова |
Об’ємна |
|
|
Символ |
ω | φ | χ | ρ |
СВ, Сн |
|
Рівняння |
|
|
|
|
|
|
Одиниці вимірювання |
частка від 1 або % |
частка від 1 або % |
частка від 1 або % |
кг/м3, г/л, |
моль/м3, |