12. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ
12. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ
| Сайт: | Підготовка до ЗНО - Освітній портал "Академія" |
| Курс: | Підготовка до ЗНО з хімії |
| Книга: | 12. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ |
| Надруковано: | Гість |
| Дата: | Wednesday 2 July 2025 3:33 PM |
Зміст
- 12. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ
- 12.1. Основні положення
- 12.2. Механізм електролітичної дисоціації
- 12.3. Ступінь дисоціації. Фактори, що впливають на ступінь дисоціації
- 12.4. Властивості основ, кислот та солей у світлі теорії електролітичної дисоціації
- 12.5. Константа дисоціації
- 12.6. Дисоціація води. Поняття про рН та кислотно-основні індикатори
- 12.7. Сучасні уявлення про кислоти та основи
- 12.8. Реакції у розчинах електролітів. Іонні рівняння
12. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ
Однією з характерних особливостей водних розчинів солей, кислот та лугів є електропровідність. Дистильована вода майже не проводить електричний струм, а сухі солі, кислоти та луги взагалі не мають такої здатності. Разом з тим, розплави зазначених речовин проводять електричний струм.
12.1. Основні положення
За здатністю проводити електричний струм у водному розчині і розплаві усі речовини поділяють на електроліти і неелектроліти.
Електроліти – речовини, водні розчини або розплави яких проводять електричний струм. Електролітами є солі, кислоти, луги. У їх молекулах є іонні або сильно полярні ковалентні зв’язки.
Неелектроліти – речовини, водні розчини або розплави яких не проводять електричний струм. Це прості речовини елементів-неметалів, багато органічних сполук (вуглеводні, вуглеводи, естери тощо).
Для пояснення електропровідності розчинів і розплавів електролітів С. Арреніус (Швеція) у 1887 р. запропонував теорію електролітичної дисоціації, за що у 1903 р. йому була присуджена Нобелівська премія.
Розглянемо основні положення теорії електролітичної дисоціації.
1. При розчиненні або плавленні електроліту, його молекули розпадаються на іони – відбувається електролітична дисоціація (іонізація).
Іон (гр. ion – той, що іде) – заряджений атом або група атомів. Іони бувають прості (одноатомні: H+, Na+, Cl–, S2– тощо) і складні (багатоатомні: OH–, SO42–, NH4+, H2PO4– тощо). Формули іонів записують вказуючи справа верхнім індексом заряд іона (в умовних одиницях відносно заряду електрона, який рівний ‑1). На відміну від запису ступеня окиснення, при наведенні заряду іона спочатку записують кількість одиниць заряду (число 1 зазвичай опускають), а потім – знак заряду (“+” або “–”), наприклад H+, OH–, NH4+, PO43–.
2. У розчині або розплаві електроліту іони рухаються хаотично (неупорядковано), а при пропусканні електричного струму позитивно заряджені іони рухаються до негативного електрода (катода), а негативно заряджені – до позитивного (анода).
Позитивно заряджені іони називають катіонами (H+, NH4+, іони металів Na+, Al3+ тощо).
Негативно заряджені іони називають аніонами (OH–, кислотні залишки F–, СO32–, HSO4– тощо).
3. Дисоціація – процес оборотний. Паралельно з процесом дисоціації (розпадом молекул на іони) відбувається асоціація (об’єднання іонів у молекули).
Дисоціацію молекул електроліту записують схемами, у яких замість знаку рівності ставлять стрілку. Зліва у схемах записують недисоційовані молекули, а справа – утворені іони:
Al2(SO4)3 → 2Al3+ + 3SO42–
Як бачимо, кількість утворених іонів рівна сумі індексів біля атома металу та кислотного залишку.
Абсолютні сумарні значення зарядів катіонів та аніонів рівні і протилежні за знаком, тому розчини електролітів є електронейтральними.
12.2. Механізм електролітичної дисоціації
Механізм електролітичної дисоціації пояснив у 1891 р. І.А. Каблуков, об’єднавши для цього хімічну теорію розчинів Д.І. Менделєєва та фізичну С. Арреніуса.
Згідно з фізико-хімічною теорією Каблукова, молекули розчинника взаємодіють з молекулами та іонами розчиненої речовини з утворенням нестійких сполук – сольватів (у випадку, коли розчинник вода – гідратів).
Процес розпаду на іони сполук з іонним зв’язком можна представити так: будь-який іон, який перебуває на поверхні кристала, утворює навколо себе електростатичне поле (катіон – позитивне, аніон – негативне). Внаслідок сил притягання полярні молекули води (диполі) орієнтуються відносно кристала так, що позитивна сторона молекули води підходить до негативного поля аніона, а негативна – до позитивного (катіона). В результаті іон-дипольної взаємодії виділяється енергія, що веде до розриву іонних зв’язків у кристалі і переходу іонів у розчин, де їх утримують молекули води (гідратація) (рис. 10.1).
У випадку розчинення полярної молекули HCl (диполь) у воді, орієнтація молекул розчинника (Н2О) навколо молекул HCl відбувається як в іонних сполук. У результаті диполь-дипольної взаємодії електронна хмара, що утворює хімічний зв’язок зміщується до атома хлору, а ковалентний зв’язок перетворюється в іонний – відбувається іонізація зв’язку (рис. 12.1).
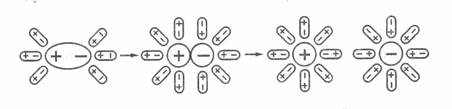
Рис. 12.1. Схема електролітичної дисоціції
Гідратовані іони Н+ записують формулою Н3О+ (точніше Н3О+*nН2О, де n = 0 – 4) і називають іони гідроксонію:
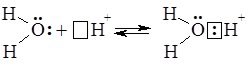
Загальна схема дисоціації електроліту складу KtnAnm:
KtnAnm + xH2O → nKt+∙yH2O + mAn–∙(x – y)H2O,
або без урахування процесу гідратації:
KtnAnm → nKt+ + mAn–.
Останнє рівняння не показує ролі води в процесі дисоціації і тому не розкриває механізм процесу.
Роль розчинника у процесі електролітичної дисоціації проілюструємо прикладом. На відміну від водного розчину HCl, розчин його у бензені С6Н6 не проводить електричний струм, оскільки полярні молекули HCl не дисоціюють у неполярному розчиннику. Отже, дисоціація відбувається лише у полярних розчинниках (вода Н2О, рідкий амоніак NH3, ацетатна кислота СН3СООН тощо).
Іони за фізичними та хімічними властивостями відрізняються від атомів, з яких вони утворені, що пояснюється різною будовою електронних оболонок відповідних атомів та іонів. Іони перебувають у стійкіших електронних конфігураціях, ніж атоми.
У розчинах іони s- i p-елементів зазвичай безбарвні, іони d-елементів забарвлені. Гідратовані і негідратовані іони одного і того ж елемента різноманітно забарвлені: тверді солі кобальту (ІІ) – білого кольору, їх розчини – рожеві (іони Co2+∙nH2O).
12.3. Ступінь дисоціації. Фактори, що впливають на ступінь дисоціації
Для кількісної характеристики електролітичної дисоціації використовують поняття ступінь дисоціації – відношення кількості молекул, що розпались на іони (n) до вихідної кількості молекул (N):
![]()
де a (альфа) – безрозмірна величина, виражається у частках від одиниці або у %.
Якщо електроліт дисоціює повністю, то a = 1 або 100%. Для неелектролітів a = 0 або 0%.
Ступінь дисоціації ацетатної кислоти СН3СООН у 0,01 М водному розчині при 18 0С становить 4,3×10-2 або 4,3%. Це означає, що із 1000 розчинених молекул СН3СООН лише 43 розпадаються на іони за схемою:
СН3СООН ↔ СН3СОО– + Н+
утворюючи при цьому 43 катіони Н+ та 43 аніони СН3СОО–, а решта 957 молекул СН3СООН перебувають у недисоційованому стані.
Ступінь дисоціації залежить від природи розчиненої речовини, розчинника, температури розчину та його концентрації і наявності у розчині інших електролітів.
Розглянемо докладніше вплив цих факторів.
Природа розчиненої речовини суттєво впливає на ступінь дисоціації. Так, ступінь дисоціації 0,1 М водного розчину HClO (0,055%) набагато менший ніж ступінь дисоціації 0,1 М водного розчину СН3СООН (4,3%) за тих же умов.
Природа розчинника. У полярних розчинниках (вода, ацетатна кислота) електролітична дисоціація відбувається в різній мірі. Так. у водних розчинах ступінь дисоціації тих же речовин вищий, ніж у оцтовокислих. Інший приклад – у водному розчині ацетатна кислота дисоціює, а у бензені С6Н6 – перебуває у недисоційованому стані.
Зі зростанням температури ступінь дисоціації, як правило, зростає за рахунок послаблення іонних зв’язків у молекулах електролітів.
При зменшенні концентрації електроліту, тобто при розведенні розчину, ступінь дисоціації зростає, оскільки зростають відстані між іонами в розчині і зменшується ймовірність об’єднання їх в молекули.
Наявність у розчині інших електролітів. Згідно з принципом Ле-Шательє при зростанні концентрації однойменних іонів у розчині електроліту ступінь дисоціації зменшується. Так, при додаванні до водного розчину ацетатної кислоти СН3СООН ацетату натрію СН3СООNa, рівновага зміщується у бік недисоційованих молекул кислоти:
СН3СООН ↔ СН3СОО– + Н+
СН3СООNa → СН3СОО– + Na+.
Аналогічний ефект буде при підкисленні розчину, що веде до зростання концентрації катіонів Н+.
Якщо ж до вихідного розчину кислоти додати лугу (NaOH), то ступінь дисоціації зросте, оскільки з реакційного середовища виводяться іони Н+:
СН3СООН + ОН– ↔ СН3СОО– + Н2О.
За величиною ступеня дисоціації електроліти поділяють на сильні, слабкі та середньої сили.
Електроліти, ступінь дисоціації яких у відносно концентрованих розчинах становить понад 30% називають сильними. Вони практично повністю дисоціюють на іони у розчинах будь-якої концентрації. До них відносять більшість солей, мінеральних кислот, лугів.
Електроліти, ступінь дисоціації яких у відносно розведених розчинах становить менше 3% називають слабкими. До них відносять більшість органічних і деякі мінеральні (HClO, H2S, H2CO3) кислоти, нерозчинні основи (Al(OH)3, Zn(OH)2, NH4OH). Вода теж є слабким електролітом.
Електроліти, ступінь дисоціації яких більший ніж 3% та менший ніж 30% – середньої сили. Вони практично повністю дисоціюють на іони у розчинах будь-якої концентрації. Це – деякі неорганічні кислоти (H2SO3, H3PO4, HNO2) та основи (Mg(OH)2).
Визначити силу мінеральної оксигеновмісної кислоти можна за формулою Е(ОН)nОm, де Е – центральний атом. Якщо m < 2, кислота слабка, m ³ 2 – сильна (табл. 12.1). Це пояснюється тим, що атоми Оксигену відтягують на себе спільні електронні пари і електронна густина від ОН-груп зміщується до атома кислотоутворючого елемента, зв’язок Н–О в ОН-групі стає полярнішим:
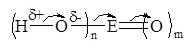
Чим поляризованіший зв’язок, тим він слабший і тому кислота сильніша.
Таблиця 12.1
Сила кислот складу Е(ОН)nОm
|
Формула |
Е(ОН)nОm |
m |
Сила кислоти |
|
HNO2 HNO3 H2SO3 H2SO4 HClO HClO4 |
N(OH)O N(OH)O2 S(OH)2O S(OH)2O2 Cl(OH) Cl(OH)O3 |
1 2 1 2 0 3 |
слабка сильна слабка сильна дуже слабка дуже сильна |
12.4. Властивості основ, кислот та солей у світлі теорії електролітичної дисоціації
Речовини, які належать до одного класу, мають властивості, притаманні цьому класу. Так, усі кислоти кислі на смак, однаково змінюють забарвлення індикаторів, реагують з лугами та основними оксидами тощо. Загальні властивості основ протилежні властивостям кислот – вони реагують з кислотами та кислотними оксидами. Розчинні у воді основи – луги – милкі на дотик, однаково змінюють забарвлення індикаторів, роз’їдають біологічні матеріали.
Виявлення класом сполук однакових властивостей пояснює теорія електролітичної дисоціації.
Дисоціація кислот завжди супроводжується утворенням іона Н+ (точніше Н3О+), який зумовлює описані вище загальні властивості кислот:
HAn ↔ H+ + An– або HAn + H2O ↔ H3O+ + An–,
де An– – аніон кислотного залишку.
Інших катіонів, крім H+ (H3O+) при дисоціації кислот не утворюється, тому, з точки зору теорії електролітичної дисоціації кислоти – це електроліти, які при дисоціації у водних розчинах утворюють лише катіони H+ (H3O+).
Кількість катіонів Н+, що утворюються при дисоціації однієї молекули кислоти, визначає її основність. Розрізняють одноосновні (HHal, HNO3), двоосновні (H2CO3, H2SO4, H2C2O4), триосновні (H3PO4), і поліосновні (багатоосновні) кислоти (H4P2O7, H5IO6).
Кислоти, основність яких більша від одиниці, дисоціюють ступінчато, кількість ступенів дисоціації дорівнює основності кислоти. Наприклад, оксалатна кислота H2С2O4 дисоціює за двома ступенями:
|
H2С2O4 ↔ Н+ + НС2О4– |
І ступінь |
|
НС2О4– ↔ Н+ + С2О4– |
ІІ ступінь |
|
H2С2O4 ↔ 2Н+ + С2О4– |
сумарно |
Дисоціація за першим ступенем проходить максимально, а за кожним наступним зменшується (див. Ступінь дисоціації).
Дисоціація основ супроводжується утворенням аніонів лише одного типу – гідроксид-іонів ОН–, які обумовлюють раніше окреслені загальні властивості даного класу:
KtOH ↔ Kt+ + OH–
де Kt+ – катіон металу або амоніаку NH4+.
Тому основи – електроліти, при дисоціації яких у водних розчинах аніонами є лише гідроксид-іони ОН–.
Кількість гідроксид-іонів ОН–, що утворюються при дисоціації однієї молекули основи, визначає її кислотність. Розрізняють однокислотні (NaOH, NH4OH), двокислотні (Ca(OH)2, Fe(OH)2), трикислотні (Al(OH)3, Fe(OH)3) і полікислотні (багатокислотні) (Pb(OH)4) основи.
Основи, кислотність яких більша від одиниці, дисоціюють ступінчато, кількість ступенів дисоціації дорівнює кислотності основи. Наприклад, барій гідроксид Ba(OH)2 дисоціює за двома ступенями:
|
Ba(OH)2 ↔ Ba(OH)+ + ОH– |
І ступінь |
|
Ba(OH)+ ↔ Ba2+ + ОH– |
ІІ ступінь |
|
Ba(OH)2 ↔ Ba2+ + 2ОH– |
сумарно |
Як і у випадку кислот, дисоціація основ за першим ступенем проходить максимально, а за кожним наступним зменшується (див. Ступінь дисоціації).
Основи та оксигеновмісні кислоти можна розглядати як гідроксиди – сполуки загальної формули R–OH, де R – деяка частинка, наприклад Na‑OH – натрій гідроксид , H2SO4 або SO2(OH)2 – сульфатна кислота або сульфур (VI) дигідроксидіоксид.
Залежно від природи частинки R, гідроксиди можуть дисоціювати за типом кислоти або основи:
R–OH ↔ RO– + H+ – дисоціація за типом кислоти
R–OH ↔ R+ + ОH– – дисоціація за типом основи
Напрям дисоціації визначається положенням елемента, що входить до складу R у Періодичній системі. Посилення дисоціації за типом кислоти і послаблення за типом основи в періодах відбувається зліва направо (табл 12.2), а в групах – знизу вверх (табл. 12.3).
Таблиця 12.2
Характер зміни кислотно-основних властивостей елементів ІІІ періоду
|
Група |
I |
II |
III |
IV |
V |
VI |
VII |
|
Гідроксид |
NaOH |
Mg(OH)2 |
Al(OH)3 |
H2SiO3 |
H3PO4 |
H2SO4 |
HClO4 |
|
Властивості |
сильна основа |
слабка основа |
амфоліт |
слабка кислота |
кислота середньої сили |
сильна кислота |
дуже сильна кислота |
Таблиця 12.3
Характер зміни кислотно-основних властивостей елементів VA підгрупи
|
Період |
2 |
3 |
4 |
5 |
6 |
|
Гідроксид |
HNO3 |
H3PO4 |
H3AsO4 |
Sb(OH)3 |
Bi(OH)3 |
|
Властивості |
сильна кислота |
кислота середньої сили |
слабка кислота |
амфоліт |
слабка основа |
Речовини, які залежно від умов здатні дисоціювати за типом кислоти (з утворенням катіонів Н+) або основи (з утворенням аніонів ОН–) називають амфолітами.
Найпростіший амфоліт – вода:
Н2О ↔ Н+ + ОН–
Розглянемо дисоціацію типового амфоліту алюміній гідроксду Al(OH)3.
За типом основи Al(OH)3:
|
Al(OH)3 ↔ Al(OH)2+ + ОH– |
І ступінь |
|
Al(OH)2– ↔ Al(OH)2+ + ОH– Al(OH)2+ ↔ Al3+ + ОH– |
ІІ ступінь ІІI ступінь |
|
Al(OH)3 ↔ Al3+ + 3ОH– |
сумарно |
За типом кислоти Н3AlO3:
|
Н3AlO3 ↔ H2AlO3– + H+ |
І ступінь |
|
Н2AlO3– ↔ HAlO32– + H+ HAlO32+ ↔ AlO33– + H+ |
ІІ ступінь ІІI ступінь |
|
Н3AlO3 ↔ AlO33– + 3H+ |
сумарно |
Дисоціація солей. Залежно від продуктів дисоціації, розрізняють середні (нормальні), кислі, основні, змішані, подвійні та комплексні солі.
Середні солі дисоціюють з утворенням катіонів металу або NH4+ та аніонів кислотного залишку:
Na3PO4 ↔ Na+ + PO43–
Fe2(SO4)3 ↔ 2Fe3+ + 3SO42–
Кислі солі дисоціюють з утворенням катіонів металу або NH4+, Н+ та аніонів кислотного залишку. Дисоціація відбувається ступінчато, на першій стадії відщеплюється катіон металу (або NH4+), на другій – катіон Н+:
|
NaНСO3 ↔ Na+ + НСO3– |
І ступінь |
|
НСO3– ↔ Н+ + СO32– |
ІІ ступінь |
|
Na2НPO4 ↔ 2Na+ +Н+ + PO43– |
сумарно |
Основні солі дисоціюють з утворенням катіонів металу та аніонів кислотного залишку і гідроксид-іонів. Дисоціація відбувається ступінчато, на першій стадії відщеплюється аніон кислотного залишку, на другій – аніон ОН–:
|
Сa(OH)Cl ↔ Ca(OH)+ + Cl– |
І ступінь |
|
Сa(OH)+ ↔ Ca2+ + ОН– |
ІІ ступінь |
|
Сa(OH)Cl ↔ Ca2+ + Cl– + ОН– |
сумарно |
Змішані солі дисоціюють з утворенням катіонів металу та різних аніонів кислотних залишків. Відщеплення аніонів відбувається одночасно:
Сa(OCl)Cl ↔ Ca2+ + Cl– + ОCl–
Подвійні солі дисоціюють з утворенням катіонів різних металів (або металу та NH4+) та аніона кислотного залишку. Відщеплення катіонів відбувається одночасно:
KAl(SO4)2 ↔ K+ + Al3+ + SО42–
Комплексні солі – електроліти, дисоціація яких супроводжується утворенням комплексних іонів (див. Комплексні сполуки).
12.5. Константа дисоціації
Поділ електролітів на сильні та слабкі в залежності від ступеня дисоціації є умовним, оскільки величина a залежить від багатьох факторів (див. ступінь дисоціації) і може змінюватись у широких межах. Тому з цією метою використовують константу іонізації (дисоціації).
Запишемо схему дисоціації електроліту загальної формули KtAn:
KtAn ↔ Kt+ + An–
Константа рівноваги цього процесу, згідно із законом дії мас, описується рівнянням:
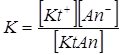
Константа іонізації (дисоціації) К – константа рівноваги процесу дисоціації електроліту.
Константа дисоціації слабких електролітів залежить від температури, природи електроліту, розчинника і не залежить від концентрації.
Чим більше значення К, тим сильніше дисоціює електроліт, і тим сильнішою є відповідна кислота або основа.
Якщо електроліт дисоціює ступінчато, то Кі визначають для кожного ступеня, а загальне значення К дорівнює добутку ступінчатих Кі:
Н3РО4 ↔ Н+ + Н2РО4– ; 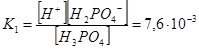
Н2РО4– ↔ Н+ + НРО42–; 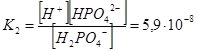
НРО42– ↔ Н+ + РО43– ; 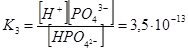
Н3РО4 ↔ 3Н+ + РО43– ; 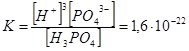
Як бачимо, Н3РО4 максимально дисоціює за першим ступенем і у цьому випадку є сильною кислотою. На кожній наступній стадії дисоціація відбувається у меншій мірі, і тому у розчинах фосфатної кислоти містяться молекули Н3РО4, катіони Н+ та аніони Н2РО4–, НРО42–, РО43–. Кількість кожного наступного компонента поступово зменшується.
Для зручності запису, використовують не абсолютні значення К, а їх десяткові логарифми зі знаком “–”:
–lg K = pK
рК – показник сили електроліту. Якщо ввести індекси а – кислота (англ. acid – кислота), а b – основа (англ. basis – основа), то рКа – показник кислотності, рКb – показник основності (табл. 12.4).
Таблиця 12.4
Значення Кх та рКх деяких слабких кислот та основ
|
Електроліт |
Формула |
Кх |
рКх |
|
Кислоти |
|||
|
Карбонатна |
Н2СО3 |
Ка1 = 4,5∙10–7 Ка2 = 4,7∙10–11 |
рКа1 = 6,35 рКа2 = 10,33 |
|
Нітритна |
HNO2 |
Ка1 = 4,0∙10–4 |
рКа1 = 3,40 |
|
Сульфітна |
H2SO3 |
Ка1 = 1,6∙10–2 Ка2 = 1,6∙10–8 |
рКа1 = 1,80 рКа2 = 7,21 |
|
Сульфідна |
H2S |
Ка1 = 1,0∙10–7 Ка2 = 2,5∙10–13 |
рКа1 = 6,99 рКа2 = 12,60 |
|
Мурашина |
HCOOH |
Ка1 = 1,8∙10–4 |
рКа1 = 3,74 |
|
Оцтова |
CH3COOH |
Ка1 = 1,8∙10–5 |
рКа1 = 4,75 |
|
Основи |
|||
|
Амоніак (водн. розчин) |
NH3∙H2O |
Кb1 = 1,8∙10–5 |
рКb1 = 4,75 |
|
Алюміній гідроксид |
Al(OH)3 |
Кb3 = 1,4∙10–9 |
рКb3 = 8,86 |
|
Ферум (ІІ) гідроксид |
Fe(OH)2 |
Кb2 = 1,3∙10–4 |
рКb2 = 3,89 |
|
Ферум (ІІІ) гідроксид |
Fe(OH)3 |
Кb2 = 1,8∙10–11 Кb3 = 1,4∙10–12 |
рКb2 = 10,74 рКb2 = 11,87 |
Порівнюючи значення рКа, наприклад, для нітритної HNO2 та сульфітної H2SO3 кислот, бачимо, що H2SO3 за першим ступенем дисоціації сильніша, ніж HNO2, а за другим – слабкіша. Аналогічно алюміній гідроксид Al(OH)3 сильніша основа, ніж ферум (ІІІ) гідроксид Fe(OH)3.
Зауважимо, що при наявності у розчині одночасно кількох кислот або основ різної сили, у реакцію, наприклад, нейтралізації, спочатку буде вступати електроліт з найменшим значенням рКх, і далі у порядку зростання рКх. Так, коли у розчині одночасно присутні H2SO3 і HNO2, при додаванні NaOH, спочатку реагує H2SO3 за першим ступенем, потім HNO2, і, нарешті, H2SO3 за другим ступенем (табл. 12.4):
H2SO3 + NaOH = NaHSO3 + H2O;
HNO2 + NaOH = NaNO2 + H2O;
NaHSO3 + NaOH = Na2SO3 + H2O.
Легко показати зв’язок між К та a для слабкого електроліту, наприклад мурашиної кислоти НСООН, яка дисоціює за схемою:
НСООН + Н2О ↔ Н3О+ + НСОО–
Запишемо Ка цього процесу:
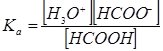
Зі схеми дисоціації видно, що [Н3О+] = [НСОО–] = αНСООНСНСООН, а [НСООН] = СНСООН – αНСООНСНСООН = (1 – αНСООН)СНСООН.
Підставивши одержані значення в рівняння для Ка, одержимо:
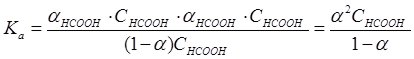
Оскільки у розчинах слабких електролітів значення α дуже мале, то 1 ‑ α » 1, тому Ка = α2СНСООН і ![]() .
.
Наведена формула – математичний вираз закону розведення Оствальда, і показує, що зі зростанням концентрації С електроліту, ступінь дисоціації α зменшується.
Використовуючи дану формулу можна обчислити [Н+] і [ОН–] в розчинах слабких одноосновних кислот та однокислотних основ відповідно. Для прикладу, виведемо формулу для розрахунку [Н+] у розчині мурашиної кислоти НСООН.
Враховуючи, що [Н+] = [ НСОО–], і оскільки НСООН – слабка кислота, то вона у розчині дисоціює незначною мірою, а тому часткою дисоційованих молекул НСООН можна знехтувати, і [НСООН] = СНСООН:
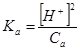 , [Н+]2 = КаСа або [Н+] =
, [Н+]2 = КаСа або [Н+] = ![]() .
.
Аналогічно можна довести, що для слабкої основи [ОН–] = ![]() .
.
12.6. Дисоціація води. Поняття про рН та кислотно-основні індикатори
Чиста вода дуже погано проводить електричний струм, але все ж електропровідність води можна зафіксувати, що пояснюється незначною самодисоціацією води на іони Н+ та ОН– (автопротоліз):
Н2О + Н2О ↔ Н3О+ + ОН–
Експериментально встановлено, що при 25 0С [Н3О+] = [ОН–] = 10–7 моль/л.
Запишемо вираз для визначення КН2О води:
![]() , звідки КН2О[Н2О]2 = [Н3О+][ОН–]
, звідки КН2О[Н2О]2 = [Н3О+][ОН–]
Оскільки ступінь дисоціації води дуже незначний, то [Н2О] = СН2О, тобто СН2О = 55,56 моль/л* і можна прийняти, що в розбавлених розчинах СН2О така ж. Введемо позначення Кw = КН2О[Н2О]2. Одержимо:
Кw = [Н3О+][ОН–] = 10–7∙10–7 = 10–14.
Величину Кw називають іонний добуток води і при незмінній температурі він сталий. При зростанні температури Кw зростає (при 100 0С Кw = 5,5∙10–13).
Якщо [Н3О+] = [ОН–] = 10–7 моль/л, то розчин нейтральний, [Н3О+] > [ОН–] > 10–7 моль/л, розчин кислий, а коли [Н3О+] < [ОН–] < 10–7 моль/л – лужний. Незалежно від значень [Н3О+] та [ОН–], завжди [Н3О+][ОН–] = 10–14.
Для зручності, використовують значення десяткових логарифмів [Н3О+], взяті зі знаком “–”: –lg[Н3О+] = pH (читається “пе аш”) (табл. 12.5).
Таблиця 12.5
Концентрація іонів Н3О+ та рН деяких розчинів
|
[Н3О+] |
рН |
Середовище |
|
10–7 |
7 |
нейтральне |
|
10–3 |
3 |
кисле |
|
10–12 |
12 |
лужне |
Зв’язок між [Н3О+] та рН наведено на схемі.
|
[Н3О+] |
10 |
10–1 |
10–2 |
10–3 |
10–4 |
10–5 |
10–6 |
10–7 |
10–8 |
10–9 |
10–10 |
10–11 |
10–12 |
10–13 |
10–14 |
||
|
рН |
0 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
||
|
середовище |
кислотність зростає |
лужність зростає |
|||||||||||||||
|
|
нейтральне |
|
|||||||||||||||
Аналогічно з рН (водневий показник), введено рОН – гідроксильний показник: рОН = –lg[OH–]. рН та рОН пов’язані відношенням:
рН + рОН = 14
Значення рН розчинів експериментально можна визначити використовуючи кислотно-основні індикатори – речовин, що змінюють забарвлення, залежно від [Н3О+]. Характеристики деяких кислотно-основних індикаторів наведені в табл. 12.6.
Таблиця 12.6
Залежність забарвлення деяких кислотно-основних індикаторів
від рН середовища
|
Індикатор |
Середовище, забарвлення |
||
|
кисле |
нейтральне |
лужне |
|
|
Метиловий оранжевий |
червоний (рН > 3,1) |
оранжевий (3,1 < рН < 4,4) |
жовтий (рН > 4,4) |
|
Метиловий червоний |
червоний (рН > 4,2) |
оранжевий (4,2 < рН < 6,3) |
жовтий (рН > 6,3) |
|
Фенолфталеїн |
безбарвний (рН > 8,0) |
блідо-малиновий (8,0 < рН < 9,8) |
малиновий (рН > 9,8) |
|
Лакмус |
червоний (рН > 5,0) |
фіолетовий (5,0 < рН < 8,0) |
синій (рН > 8,0) |
Існують універсальні індикатори, використовуючи які можна визначити рН будь-якого розчину з точністю до одиниці.
Найточніше значення рН визначають приладами – рН-метрами.
Багато процесів відбуваються лише при певних значеннях рН. Так, рН шлункового соку людини – 1,7, відхилення від цього значення ведуть до порушення процесів травлення. Рослини нормально ростуть на грунтах з відповідним для даного виду значенням рН. Велика роль рН у проходженні окисно-відновних процесів (див. Хімія окисно-відновних процесів).
12.7. Сучасні уявлення про кислоти та основи
Теорія електролітичної дисоціації зробила вагомий внесок у розвиток уявлень про кислоти та основи. Однак, сьогодні назріла потреба розширити уявлення про кислоти та основи для пояснення фактів, які не вкладаються у рамки раніше розглянутої теорії. Вона не пояснює реакцій між кислотами та основами, які не дисоціюють на іони. Зокрема, газоподібний безводний хлороводень HCl реагує з твердими лугами (NaOH, KOH). Відомі речовини, які не маючи ОН-груп, виявляють властивості основ:
NH3 + HCl = NH4Cl
Вивчення цих реакцій та процесів у неводних розчинах призвело до створення загальних теорій кислот та основ.
У 1926 р. І. Бренстед (Данія) і Т. Лоурі (Великобританія) запропонували протолітичну (протонну) теорію кислот та основ.
Згідно з цією теорією, кислота – речовина або частинка, здатна віддавати катіон Н+ (протон) – донор, а основа – речовина або частинка, здатна приєднати протон – акцептор:
|
В + |
Н+ |
↔ А |
|
основа |
протон |
кислота |
|
HSO4– + |
Н+ |
↔ H2SO4 |
Пов’язані цим співвідношенням кислоту та основу називають кон’югованими. Кислоти та основи у загальному називають протоліти.
Якщо в розчині наявні кислота та основа, що не є кон’югованими, то відбуваються процеси:
А1 ↔ Н+ + В1,
В2 + Н+ ↔ А2.
Або сумарно А1 + В2 ↔ В1 + А2.
З позиції протолітичної теорії кислот та основ розглянемо взаємодію сухого амоніаку NH3 з безводним гідроген хлоридом HCl:
|
HCl ↔ Н+ + Cl– А1 ↔ Н+ + В1 NH3 + H+ ↔ NH4+ В2 + Н+ ↔ А2 |
|
HCl + NH3 ↔ NH4+ + Cl– |
Деякі речовини, залежно від умов можуть виявляти властивості кислоти або основи (бути амфотерними):
|
HS– + NH3 ↔ NН4+ + S2– А1 + В2 ↔ А2 + В1 |
|
HS– + HF ↔ Н2S + F– А1 + В2 ↔ А2 + В1 |
Як поведе себе речовина – як кислота чи як основа – визначається енергією зв’язку з протоном. У ряду NH3 – H2O – HF вона максимальна у амоніаку NH3, мінімальна для гідроген фториду HF а у води Н2О має проміжне значення. Тому в сумішах з NH3, Н2О поводить себе як кислота, а з HF – як основа:
NH3 + Н2О ↔ NH4+ + OH–
HF + Н2О ↔ H3O+ + F–
Загальніше визначення кислот та основ запропонував Г. Льюїс (США), припустивши, що кислотно-основні властивості не обов’язково супроводжуються переносом протона. Згідно з його уявленнями, кислота – (кислота Льюїса) – частинка-акцептор електронної пари, а основа (основа Льюїса) – частинка-донор електронної пари. У результаті їх взаємодії утворюються солі:
|
:Cl– + |
PCl5 |
= [PCl6]– |
|
основа |
кислота |
сіль |
Порівняння деяких теорій кислот та основ наведено у табл. 12.7.
Таблиця 12.7
Розвиток уявлень про кислоти та основи
|
Клас речовин |
Визначення |
||
|
Арреніус |
Бренстед-Лоурі |
Льюїс |
|
|
Кислоти |
донори Н+ |
донори Н+ |
акцептори електронних пар |
|
Основи |
акцептори Н+ |
акцептори Н+ |
донори електронних пар |
12.8. Реакції у розчинах електролітів. Іонні рівняння
Згідно з теорією електролітичної дисоціації усі реакції в розчинах електролітів зводяться до міжіонних взаємодій. Якщо при взаємодії різнойменно заряджених іонів утворюються малодисоційовані сполуки, або один чи декілька продуктів виходять з реакційного середовища (утворюється вода, виділяється газ, випадає осад), то реакція відбувається практично повністю, у протилежному випадку встановлюється динамічна рівновага між реагентами і продуктами реакції. При зливанні розчинів натрій хлориду NaCl і калій нітрату KNO3 і наступному випаровуванні, утворюється суміш чотирьох солей (NaCl, KNO3, NaNO3 та KCl):
NaCl + KNO3 ↔ NaNO3 + KCl
Реакції у розчинах електролітів записують у формі іонних рівнянь. При записі цих рівнянь сильні електроліти наводять в іонній формі, а малодисоційовані сполуки (гази, нерозчинні у воді речовини і воду) – у молекулярній формі (табл. 12.8).
Таблиця 12.8
Форма запису деяких речовин у розчинах
|
В іонній формі |
Сильні кислоти (перхлоратну HClO4, сульфатну H2SO4, нітратну HNO3, хлоридну HCl). Луги (NaOH, KOH, Ca(OH)2, Ba(OH)2). Розчинні у воді солі (див. таблицю розчинності). |
|
У молекулярній формі |
Воду H2O. Слабкі кислоти (оцтову СН3СООН, нітритну HNO2, ціанідну HCN, сульфітну H2SO3, силікатну H2SiO3). Слабкі основи (NH4OH, Fe(OH)2, Fe(OH)3, Cu(OH)2). Амфотерні гідроксиди (Zn(OH)2, Al(OH)3, Cr(OH)3). Малорозчинні солі (див. таблицю розчинності). |
При складанні іонних рівнянь слід додержуватись алгоритму:
- Записати схему реакції у молекулярній формі і розставити коефіцієнти.
- Записати повне іонне рівняння з урахуванням електролітичної дисоціації (табл. 12.8).
- Скоротити однакові члени у лівій і правій частинах рівняння.
- Записати скорочене іонне рівняння, що відображає суть хімічного процесу в розчині.
- Перевірити алгебраїчну суму зарядів у лівій і правій частинах рівняння. Якщо вона дорівнює нулю, рівняння складене правильно.
Розглянемо кілька прикладів.
Приклад 1. Реакція нейтралізації сильної кислоти лугом.
- HCl + KOH = H2O + KCl.
- H+ + Cl– + K+ + OH– = H2O + K+ + Cl–.
3, 4. H+ + OH– = H2O.
5. + 1 + (– 1) = 0, скорочене іонне рівняння складене правильно.
Отже, реакція нейтралізації сильної кислоти лугом фактично зводиться до взаємодії іонів Н+ та ОН– з утворенням молекули Н2О. У випадку будь-якої іншої сильної кислоти або лугу, скорочене іонне рівняння буде мати такий же вигляд. Якщо ж узяти слабку кислоту і луг, одержимо:
СН3СООН + КОН = СН3СООК + Н2О
СН3СООН + ОН– = СН3СОО– + Н2О
У випадку сильної кислоти і слабкої основи:
HCl + NH4OH = NH4Cl + H2O
H + NH4OH = NH4+ + H2O
Приклад 2. Реакції з утворенням осаду і/або виділенням газу.
а) Na2CO3 + H2SO4 = Na2SO4 + CO2↑ + H2O
CO32– + 2H+ = CO2↑ + H2O
б) CaCl2 + 2AgNO3 = Ca(NO3)2 + 2AgCl↓
Cl– + Ag+ = AgCl↓
в) BaCO3 + H2SO4 = BaSO4↓ + CO2↑ + H2O
BaCO3 + 2H+ + SO42– = BaSO4↓ + CO2↑
Приклад 3. Оборотні іонні реакції.
NaNO3 + KBr ↔ KNO3 + NaBr
Записати скорочене іонне рівняння у цьому випадку неможливо, тому вважають, що ця реакція не відбувається (див. вище).
Окисно-відновні реакції у розчинах див. Хімія окисно-відновних процесів.