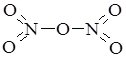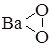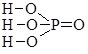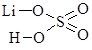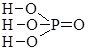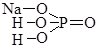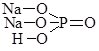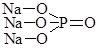13. ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ РЕЧОВИН
13. ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ РЕЧОВИН
| Сайт: | Підготовка до ЗНО - Освітній портал "Академія" |
| Курс: | Підготовка до ЗНО з хімії |
| Книга: | 13. ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ РЕЧОВИН |
| Надруковано: | Гість |
| Дата: | Sunday 25 May 2025 6:44 AM |
13. ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ РЕЧОВИН
На сьогодні відомо понад 10 млн. сполук, серед яких понад 100 тис. – неорганічні. Для зручності вивчення їх класифікують – об’єднують у групи, залежно від будови та властивостей. Знаючи властивості класу, можна легко перенести їх на окремих представників.
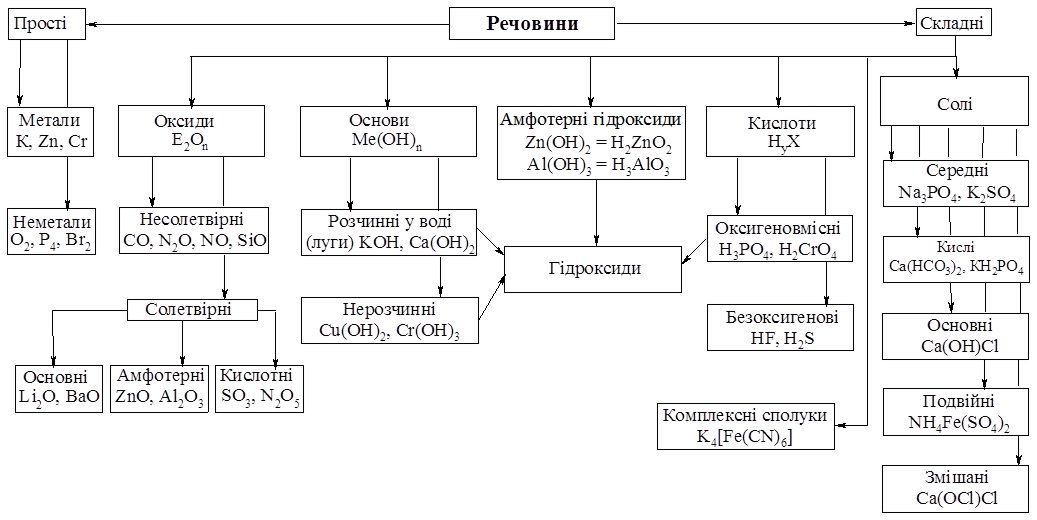
13.1. Класифікація неорганічних речовин
Усі відомі речовини умовно можна розділити на прості та складні. Простих речовин (з урахуванням алотропних модифікації) відомо біля 400. Усі прості речовини поділяють на метали і неметали.
Складні речовини можуть мати неорганічну або органічну природу. Неорганічні речовини класифікують за кількістю елементів, що утворюють сполуки – двоелементні (бінарні), триелементні та багатоелементні. Класифікацію органічних речовин розглянуто у розд. Органічна хімія.
Схема 13.1
Класифікація неорганічних речовин
Бінарні – сполуки утворені атомами двох елементів. Сполуки металів із неметалами класифікують за типом неметалу (табл. 13.1). Сполуки металів з металами називають інтерметалічними (інтерметалідами).
Таблиця 13.1
Класифікація бінарних сполук за типом неметалу
|
Неметал |
Клас |
Формула |
Назва |
|
F, Cl, Br, I |
галогеніди |
KF, FeBr3 |
калій фторид, ферум (ІІІ) бромід |
|
О |
оксиди, пероксиди |
CaO, Nа2O2 |
кальцій оксид, натрій пероксид |
|
S, Se, Te |
халькогеніди |
ZnS, Li2Se |
цинк сульфід, літій селенід |
|
N, P, As |
пніктогеніди |
Na3N, Mg3P2 |
натрій нітрид, магній фосфід |
|
C |
карбіди |
СаС2, Al4C3 |
кальцій карбід, алюміній карбід |
|
Si |
силіциди |
Mg2Si |
магній силіцид |
|
B |
бориди |
Сa3B2 |
кальцій борид |
|
Н |
гідриди |
NaH |
натрій гідрид |
Найважливішими бінарними сполуками є галогеніди, які можна розглядати як солі відповідних безоксигенових кислот та оксиди (схема 11.1).
Гідроліз бінарних сполук веде до утворення відповідних гідрогеновмісних сполук неметалів та гідроксидів:
FeBr3 + 3H2O = Fe(OH)3↓ + 3HBr; Na2O + H2O = 2NaOH;
Al2S3 + 6H2O = 2Al(OH)3↓ + 3H2S; Mg3N2 + 6H2O = 3Mg(OH)2↓ + 2NH3;
CaH2 + H2O = Ca(OH)2↓ + H2; CaC2 + 2H2O = Ca(OH)2↓ + C2H2;
Гідроліз деяких бінарних сполук відбувається необоротно.
Триелементними сполуками є основи, кислоти і деякі солі. Багатоелементними – комплексні сполуки, серед яких виділяють основи, кислоти, солі та неелектроліти.
13.2. Прості речовини. Метали i неметали
Поділ простих речовин на метали і неметали обумовлений різницею будови атомів.
У Періодичній системі Д.І. Менделєєва неметали розміщені в правій верхній частині над діагоналлю В – At, метали – під нею. Елементи, розміщені біля діагоналі виявляють амфотерні властивості.
При переході до кожного наступного елемента в головній підгрупі або періоді Періодичної системи спостерігається плавна зміна металічних і неметалічних властивостей (табл. 13.2, 13.3).
Таблиця 13.2
Деякі характеристики простих речовин елементів VA підгрупи
|
Елемент, символ |
Форма існування простої речовни |
Агрегантний стан |
Фізичні властивості |
|
Нітроген, N |
азот, N2 |
газоподібний |
неелектропровідний, Т. пл. = – 210 0С |
|
Фосфор, Р |
білий фосфор, Р4, червоний фосфор, Рх |
твердий |
неелектропровідний, Т. пл. = 44,1 0С |
|
Арсен, As |
арсен, As |
твердий |
малоелектропровідний, слабкий металічний блиск, Т. субл. = 615 0С |
|
Стибій, Sb |
стибій, Sb |
твердий |
електропровідний, металічний блиск, Т. пл. = 660 0С |
|
Бісмут, Bi |
вісмут, Ві |
твердий |
електропровідний, металічний блиск, Т. пл. = 660 0С |
Таблиця 13.3
Деякі характеристики простих речовин елементів ІІІ періоду
|
Елемент |
Na, Mg, Al |
Si, P, S |
Cl, Ne |
|
Характеристики |
тверді, блискучі, електропровідні |
тверді, без металічного блиску, неелектропровідні |
гази |
Як видно з табл. 13.2 і 13.3, у головній підгрупі металічні властивості посилюються зверху вниз, а в періоді – зі зростанням порядкового номера.
Метали – s-елементи ІА та ІІА груп, усі d- i f-елементи та р-елементи ІІІА (крім В), IVА (Ge, Sn, Pb), VА (Sb, Bi), VIА (Po), VIIА (At) підгруп. Решта 22 елементи – неметали.
Поділ елементів на метали і неметали – умовний. Певні елементи, залежно від умов, можуть виявляти властивості металів або неметалів (Be, Ge, Sn, Pb). Їх називають амфотерними. Деякі відмінності металів і неметалів наведено у табл. 13.4.
Таблиця 13.4
Деякі властивості металів і неметалів
|
Характеристика |
Метали |
Неметали |
|
Електронна будова |
на зовнішньому рівні 1 – 3 електрони (рідше 4 – 7), низькі енергії іонізації, у реакціях віддають електрони і найчастіше є відновниками |
на зовнішньому рівні 4 – 8 електронів, у Н та Не (1 період) – відповідно 1 і 2, у В (3 період) – 3, високі енергії іонізації, у реакціях добудовують електронну оболонку до 8 (Н – до 2) і частіше є окисниками |
|
Будова простих речовин |
в кристалічному стані – атомні металічні кристалічні гратки, у яких спільні електрони вільно рухаються по усьому кристалу |
одноатомні (благородні гази), двоатомні (Н2, О2, N2, галогени), багатоатомні (О3, Р4, S8), полімерні (Рх, Sx), молекулярні кристалічні гратки (у С і Si – атомні) |
|
Фізичні властивості простих речовин |
за н.у. – тверді речовини з металічним блиском, високо тепло- та електропровідні, пластичні, ковкі, високі Т. пл. і Т. кип. |
за н.у. – гази (Н2, О2, F2, Cl2, благородні гази), рідини (Br2), тверді тіла (C, S, P, I2) без металічного блиску, погано проводять тепло та електричний струм, крихкі, низькі Т. пл. і Т. кип. |
13.3. Оксиди
Серед складних неорганічних речовин виділяють оксиди, гідроксиди, кислоти, солі та комплексні сполуки.
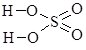
Оксиди – складні речовини, що складаються з двох елементів, один з яких Оксиген у ступені окиснення –2. В оксидах не існує зв’язку між атомами Оксигену. Сполуки, у яких є такий зв’язок, називають пероксидами, ступінь окиснення Оксигену у них –1, їх відносять до класу солей гідроген пероксиду Н2О2 (табл. 13.5).
Хімічну (систематичну назву) оксидів складають з двох слів: перше – назва елемента у називному відмінку, друге – оксид. Якщо елемент може утворювати кілька оксидів, то у назві оксиду, після назви елемента вказують у дужках його ступінь окиснення (римською цифрою, без знаків “–” чи “+”). Іноді оксиди складу ЕО називають монооксидами, ЕО2 – діоксидами тощо. Деякі оксиди мають тривіальні назви (табл. 13.5).
Таблиця 13.5
Деякі бінарні сполуки елементів з Оксигеном
|
Формула |
Графічна формула |
Назва |
|
Н2О |
|
гідроген оксид, вода |
|
СО2 |
|
карбон (IV) оксид, карбон діоксид, вуглекислий газ |
|
N2O5 |
|
нітроген (V) оксид, нітроген пентаоксид, нітратний ангідрид |
|
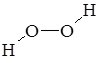
Н2О2 |
|
гідроген пероксид |
|
BaO2 |
|
барій пероксид |
Основні способи одержання оксидів
- Взаємодія простих речовин з киснем, що супроводжується виділенням тепла і світла – горіння:
а) металів: 4Al + 3O2 = Al2O3; 2Сu + O2 = 2CuO;
Таким способом неможливо одержати оксиди лужних металів, які при взаємодії з киснем утворюють пероксиди або надпероксиди (супероксиди):
2Na + O2 = Na2O2, К + O2 = КO2,
тому оксиди таких елементів одержують іншими методами:
Na2O2 + 2Na = 2Na2O; 4КO2 = 2К2O + 3O2
б) неметалів: 2Н2 + O2 = 2Н2O; С + О2 = СО2.
2. Взаємодія складних речовин з киснем:
а) неорганічних: 2H2S + 3O2 = 2H2O + 2SO2; 2SO2 + O2 = 2SO3;
б) органічних: СН4 + 2O2 = СО2 + 2Н2O; С2Н5ОН + 3O2 = 2СО2 + 3Н2O.
3. Термоліз складних речовин:
а) оксидів: 2PbO2 = 2PbO + O2; 2N2O5 = 4NO2 + O2;
а) гідроксидів: Сu(OH)2 = CuO + H2O; 2Fe(OH)3 = Fe2O3 + 3H2O;
а) кислот: 4НNO3 = 4NO2 + 2H2O + O2; H2SO3 = SO2 + H2O;
а) солей: СаСO3 = СаO + СO2; NH4NO3 = N2O + 2H2O;
Існують специфічні способи добування деяких оксидів, їх розглянуто при вивченні відповідних елементів.
Класифікація оксидів
Усі оксиди поділяють на солетвірні і несолетвірні (індиферентні) (схема 13.1).
Несолетвірні (індиферентні) оксиди не утворюють солей у реакціях з кислотами і основами. Таких оксидів 4: карбон (ІІ) оксид СО, силіцій (ІІ) оксид SiO, нітроген (І) оксид N2O, нітроген (ІI) оксид NO. Однак, відомий спосіб одержання натрій форміату базується на реакції:
СО + NaOH = HCOONa (тиск 15 атмосфер).
Солетвірні оксиди у реакціях з кислотами або основами утворюють солі:
СаО + H2SO4 = CaSO4 + H2O; CO2 + 2NaOH = Na2CO3 + H2O.
Серед солетвірних виділяють основні, кислотні та амфотерні оксиди.
Основні – оксиди, гідрати яких – основи. Основними є оксиди лужних (Li, Na, K) і лужноземельних (Ca, Sr, Ba) металів, а також оксиди Cu (II), Fe (II) та Fe (III). У них переважно реалізується іонний хімічний зв’язок, за н. у. усі вони – тверді речовини.
Фізичні властивості оксидів
За н.у. оксиди перебувають у газоподібному (N2O, CO2), рідкому (H2O, SO3) або твердому (оксиди металів) стані.
Хімічні властивості основних оксидів
1. Взаємодія з водою з утворенням лугів:
Na2O + H2O = 2NaOH; CaO + H2O = Ca(OH)2.
Оксиди Cu (II), Fe (II) та Fe (III) з водою не взаємодіють.
2. Взаємодія з кислотами з утворенням солей та води:
Li2O + 2HCl = 2LiCl + H2O; СuO + H2SO4 = CuSO4 + Н2О.
3. Взаємодія з кислотними та амфотерними оксидами з утворенням солей:
K2O + CO2 = K2CO3; Na2O + Al2O3 = 2NaAlO2;
FeO + SO3 = FeSO4; BaO + ZnO = BaZnO2.
4. Взаємодія з амфотерними гідроксидами з утворенням солей та води:
Na2O + Al(OН)3 = 2NaAlO2 + 3Н2О.
5. Участь в окисно-відновних реакціях:
Fe2O3 + 2Al = Al2O3 + 2Fe; 3CuO + 2NH3 =3Cu + N2 + 3H2O.
Кислотні – оксиди, гідрати яких – кислоти. Ці оксиди ще називають ангідридами кислот. Кислотними є оксиди неметалів та металів у високих (+5 – +7) ступенях окиснення. В кислотних оксидах реалізується ковалентний полярний хімічний зв’язок, за н.у. вони перебувають у газовому (СО2, SO3), рідкому (N2O5, Cl2O7) або твердому (Р2О5, Mn2O7) стані.
Хімічні властивості кислотних оксидів.
1. Взаємодія з водою з утворенням кислот:
SO3 + H2O = H2SO4; P2O5 + 3H2O = 2H3PO4.
Кислотні оксиди, утворені елементами, що перебувають у проміжному ступені окиснення у цьому випадку утворюють дві кислоти:
2N+4O2 + H2O = HN+3O2 + HN+5O3; 2Cl+6O3 + H2O = HCl+5O3 + HCl+7O4.
2. Взаємодія з лугами з утворенням солей:
СO2 + Ca(OH)2 = Ca(HCO3)2; SO3 + 2NaOH = Na2SO4 + H2O.
Кислотні оксиди, утворені елементами, що перебувають у проміжному ступені окиснення у цьому випадку утворюють дві солі:
2N+4O2 + 2NaOH = NaN+3O2 + NaN+5O3 + H2O.
3. Взаємодія з основними та амфотерними оксидами з утворенням солей:
P2O5 + 3Na2O + = 2Na3PO4; SO3 + ZnO = ZnSO4.
4. Взаємодія з амфотерними гідроксидами з утворенням солей та води:
3N2O5 + 2Al(OН)3 = 2Al(NO3)3 + 3Н2О.
5. Взаємодія у розчинах із середніми солями відповідних кислот з утворенням кислих солей (якщо це можливо):
СO2 + СаСО3 + Н2О = Са(НСO3)2.
6. Участь в окисно-відновних реакціях:
С+4О2 + С0 = 2С+2О; 4Cr+6O3 + C–42H5OH = 2Cr+32O3 + 2C+4O2 + 3H2O;
S+4O2 + 2H2S–2 = 3S0 + 2H2O; Mn+4O2 + 4HCl–1 = Mn+2Cl2 + Cl02 + 2H2O.
Амфотерні оксиди – залежно від умов виявляють властивості основних або кислотних оксидів. Їх утворюють лише метали побічних підгруп, які перебувають у проміжних ступенях окиснення, а також берилій Be та алюміній Al. В амфотерних оксидах реалізується іонно-ковалентний хімічний зв’язок, за н.у. – усі вони тверді речовини.
Хімічні властивості амфотерних оксидів
- З водою не реагують, амфотерні гідроксиди одержують іншими методами (див. Амфотерні гідроксиди).
- Аналогічно з основними, реагують з кислотами та кислотними оксидами, утворюючи солі:
Al2O3 + 6HCl = 2AlCl3 + 3H2O; Cr2O3 + 3SO3 = Cr2(SO4)3.
- Аналогічно з кислотними, реагують у розплаві з основами та основними оксидами, утворюючи солі:
ZnO + 2KOH = K2ZnO2 + H2O; Al2O3 + Na2O = 2Na2AlO2.
Воду теж можна розглядати як амфотерний оксид, оскільки вона при дисоціації утворює іони Н+ і ОН–:
Н2О ↔ Н+ + ОН–, або Н2О + Н2О ↔ Н3О+ + ОН–,
і реагує з кислотними та основними оксидами з утворенням кислот або основ відповідно.
Застосування оксидів розглянуто при вивченні хімії елементів.
13.4. Основи
Основи – сполуки, що складаються з атома металу та гідроксогруп.
Систематичні назви основ та амфотерних гідроксидів складають аналогічно з назвами відповідних оксидів – із назви елемента (у разі необхідності вказують його ступінь окиснення) і слова гідроксид (назва аніона ОН–): NaOH – натрій гідроксид, Са(ОН)2 – кальцій гідроксид, Fe(OH)3 – ферум (ІІІ) гідроксид.
Для деяких основ збереглися тривіальні (історичні) назви: NaOH – їдкий натр, каустична сода, КОН – їдке калі, Са(ОН)2 – гашене вапно.
Усі основи – тверді речовини. Розчинні у воді основи – луги (гідроксиди лужних і лужноземельних металів) – іонні сполуки. Інші основи у воді нерозчинні, зв’язок у них – ковалентно-іонний.
Одержання основ
- Взаємодія активних металів з водою:
2K + 2H2O = 2KOH + H2; Ba + 2H2O = Ba(OH)2 + H2.
- Взаємодія оксидів активних металів з водою
Na2O + H2O = 2NaOH; CaO + H2O = Ca(OH)2.
- Електроліз водних розчинів солей активних металів:
2NaCl + 2H2O = 2NaOH + Cl2 + H2.
Зазначеними способами можна одержати лише луги.
- Взаємодія солей з водними розчинами лугів:
СuSO4 + 2NaOH = Cu(OH)2 + Na2SO4;
Fe(NO3)3 + 3KOH = Fe(OH)3 + 3KNO3;
K2SO4 + Ba(OH)2 = 2KOH + BaSO4.
Цим способом можна одержати нерозчинні основи. Луги можна одержати за умови утворення в реакції малодисоційваної (вода, газ) сполуки.
Зазначимо, що жодним з перелічених методів не можна одержати гідроксиди AgOH i Hg(OH)2, оскільки вони одразу ж розкладаються на відповідний оксид і воду:
2AgNO3 + 2NaOH = Ag2O↓ + 2NaNO3 + H2O.
Хімічні властивості основ.
- У водних розчинах розчинні у воді основи (луги) дисоціюють практично повністю:
MeOH ↔ Men+ + OH–,
і за рахунок утворення іонів ОН– змінюють колір індикаторів (див. рН), нерозчинні основи колір індикаторів не змінюють.
2. Реагують з водними розчинами кислот з утворенням солей і води. Цю реакцію у випадку використання лугів називають реакцією нейтралізації:
Fe(OH)2 + H2SO4 = FeSO4 + 2H2O, NaOH + HCl = NaCl + H2O.
При використанні у цій реакції багатокислотних основ (Ca(OH)2, Ba(OH)2) або багатоосновних кислот (H2SO4, H3PO4), залежно від співвідношення реагентів можливе утворення середніх, кислих або основних солей (див. Солі).
3. Луги реагують з амфотерними гідроксидами з утворенням комплексних сполук (див. Комплексні сполуки):
NaOH + Al(OH)3 = Na[Al(OH)4],
при надлишку лугу відбувається реакція:
3NaOH + Al(OH)3 = Na3[Al(OH)6].
Проведення цих реакцій у розплаві веде до відщеплення води:
NaOH + Al(OH)3 = NaAlO2 + 2Н2О, 3NaOH + Al(OH)3 = Na3AlO3 + 3Н2О.
Продукти цих реакцій можна розглядати як солі відповідно метаалюмінатної (НAlO2) та ортоалюмінатної (H3AlO3) кислот.
4. При сплавленні лугів з амфотерними оксидами утворюються сіль і вода:
2КOH + Al2O3 = 2КAlO2 + Н2О, 6КOH + Al2O3 = 2К3AlO3 + 3Н2О.
5. Луги реагують з кислотними оксидами з утворенням солей і води:
2NаОН + СО2 = Nа2СО3 + Н2О, 6КOH + Р2O5 = 2К3РO4 + 3Н2О.
При надлишку кислотного оксиду у випадку багатокислотних лугів можливе утворення кислих солей:
Са(ОН)2 + СО2 = Са(HСО3)2.
6. Луги реагують з солями за умови, коли один з продуктів реакції покидає реакційне середовище (осад або газ):
3NaOH + FeCl3 = Fe(OH)3¯ + 3NaCl,
Ca(OH)2 + 2NH4Cl = CaCl2 + 2NH3 + 2H2O.
При нестачі лугу можливе утворення основних солей (див. Солі).
7. При термолізі гідроксиди металів розкладаються на відповідні оксиди та воду:
Сa(OH)2 = CaO + H2O, 2Fe(OH)3 = Fe2O3 + 3H2O.
Гідроксиди лужних металів не розкладаються навіть при плавленні.
Застосування основ буде розглянуто при вивченні відповідних елементів у розділі Неорганічна хімія.
13.5. Кислоти
Кислоти – сполуки, в яких атоми Гідрогену, що входять до їх складу можуть заміщуватись атомами металів з утворенням солей:
2HCl + 2Na = 2NaCl + H2, H2SO4 + Fe = FeSO4 + H2.
Сучасне визначення кислот див. Електролітична дисоціація.
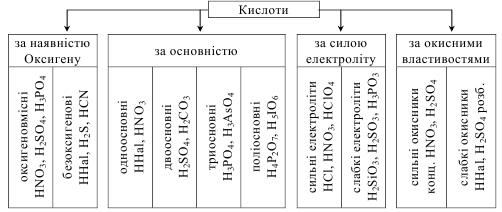
Кислоти класифікують за різними критеріями (схема 13.2).
Схема 13.2
Класифікація неорганічних кислот
Поширені два типи номенклатури кислот – хімічна (систематична або раціональна) і тривіальна. Перша найчастіше застосовується у науковій літературі, друга – у промисловості, побуті. Чіткого розподілу сфер їх використання немає.
Згідно сучасної української хімічної номенклатури систематичні назви кислот складаються з двох слів, друге з яких кислота. Корінь першого слова походить від назви елемента, що утворює кислоту, з додаванням суфікса -ат- (нітратна кислота HNO3 – сполука Нітрогену N, карбонатна кислота H2CO3 – сполука Карбону C тощо). У випадку оксигеновмісної кислоти це слово може включати показник ступеня окиснення елемента. Якщо елемент, який утворює кислоту, перебуває у максимальному ступені окиснення, то його зазвичай не вказують (H2S+6O4 – сульфатна кислота), в іншому випадку ступінь окиснення вказують у дужках (H2S+4O3 – сульфатна (IV) кислота).
Перше слово назви безоксигенової кислоти походить від назви елемента з додаванням суфікса -ід- або -ид- (сульфідна кислота Н2S, йодидна кислота НІ).
Для деяких найважливіших кислот поряд із систематичними назвами збереглися раціональні. У цих назвах різні ступені окиснення елементів, що утворюють кислоти позначаються префіксами і/або суфіксами: Н3Р+3О3 –фосфатсита, Н3Р+5О4 – ортофосфатна, H2S+4O3 – сульфітна, H2S+6O4 – сульфатна, HCl+1O – гіпохлоритна, HCl+3O2 – хлоритна, HCl+5O3 –хлоратна, HCl+7O4 – перхлоратна кислоти.
Раціональні назви аніонів походять від хімічних назв відповідних кислот (табл. 13.7). Номенклатуру органічних кислот детально розглянуто у розд. Органічна хімія.
Таблиця 13.7
Назви деяких кислот та їх аніонів
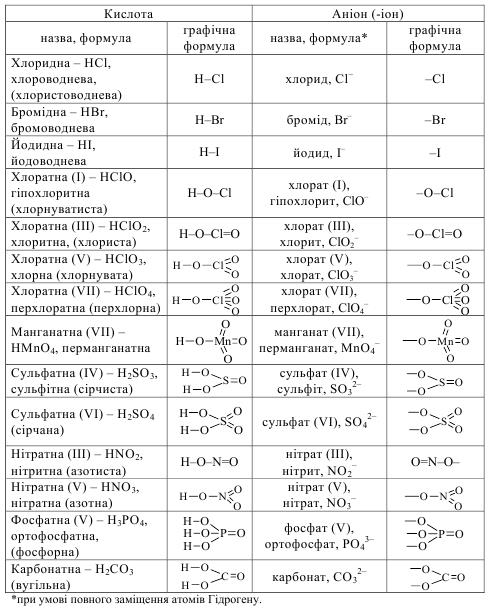
Графічні формули.
В оксигеновмісних кислотах атоми Гідрогену зв’язані з атомом елемента-кислотоутворювача через атоми Оксигену (табл. 13.7).
В оксигеновмісних кислотах, молекули яких містять 2 або більше атомів елемента-кислотоутворювача, ці атоми з’єднані через атоми Оксигену:
Н4Р2О7: 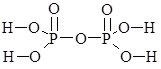 ; H2Cr2O7:
; H2Cr2O7: 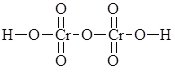
Слід запам’ятати, що не завжди кількість атомів Гідрогену збігається з основністю кислоти, оскільки основність визначають лише атоми Гідрогену, зв’язані з центральним атомом через Оксиген (табл. 13.8).
Таблиця 13.8
Основність деяких оксигеновмісних кислот фосфору
|
Назва |
Формула |
Графічна формула |
Основність |
|
Метафосфатна |
НРО3 |
|
1 |
|
Гіпофосфітна |
Н3PO2 |
|
1 |
|
Фосфітна |
Н3PO3 |
|
2 |
|
Ортофосфатна |
Н3PO4 |
|
3 |
Ще очевидніше це виявляється у молекулах вищих карбонових кислот, які містять велику кількість атомів Гідрогену, залишаючись при цьому одноосновними: С17Н33СООН – олеїнова, С17Н35СООН – стеаринова кислоти.
Одержання кислот.
- Безоксигенові кислоти одержують безпосередньо взаємодією неметалу з воднем:
Н2 + Hal2 = 2HHal, Н2 + S = H2S.
2. Оксигеновмісні кислоти утворюються при взаємодії кислотних оксидів (ангідридів) з водою:
Р2О5 + Н2О = Н3РО4, SO3 + H2O = H2SO4,
СlO2 + H2O = HClO + HClO2
3. Кислоти, ангідриди яких з водою не реагують, добувають з їх солей реакціями обміну:
Na2SiO3 + H2SO4 = Na2SO4 + H2SiO3.
Таким чином можна одержати й деякі інші кислоти, за умови, що у реакції утворяться газоподібні, малорозчинні або малодисоційовані сполуки:
NaCl(тв.) + H2SO4(к.) = HCl + NaHSO4,
FeS + 2HCl = FeCl2 + H2S.
- Безоксигенові та оксигеновмісні кислоти можна одержати гідролізом відповідних галоген- або тіоангідридів:
PCl5 + 4H2O = H3PO4 + 5HCl, POCl3 + 3H2O = H3PO4 + 3HCl,
PBr3 + 3H2O = H3PO3 + 3HBr, SO2Cl2 + 2H2O = H2SO4 + 2HCl,
P2S3 + 6H2O = 2H3PO3 + 3H2S, P2S5 + 8H2O = 2H3PO4 + 5H2S,
2.Деякі кислоти можна одержати шляхом окисно-відновних реакцій:
Сl2 + H2O(гаряча) = HCl + HClO3, Сl2 + H2O(холодна) = HCl + HClO,
3P + 5HNO3 + 2H2O = 3H3PO4 + 5NO, S + 2HNO3 = H2SO4 + 2NO.
Фізичні властивості кислот.
За н. у. кислоти перебувають у твердому (силікатна H2SiO3, боратна H3BO3, ортофосфатна H3PO4) або рідкому (сульфатна H2SO4, нітратна HNO3) стані. Вони добре розчинні у воді (крім H2SiO3). Водні розчини газоподібних сполук гідрогену з деякими неметалами (HHal, H2S, HCN) теж є кислотами.
Розчини кислот кислі на смак, роз’їдають тканини, шкіру. Усі кислоти змінюють забарвлення індикаторів (див. Індикатори).
Хімічні властивості кислот умовно можна розділити на дві групи:
І. Спільні для всіх кислот, пов’язані з наявністю у їх розчинах іонів гідроксонію Н3О+.
ІІ. Специфічні, характерні для конкретних кислот (зокрема якісні реакції), розглянуті при вивченні відповідних елементів.
Розглянемо спільні властивості кислот.
Іон Н+, який обов’язково наявний у водних розчинах усіх кислот у формі Н3О+, з одного боку може вступати в окисно-відновні реакції, відновлюючись при цьому до молекулярного водню Н2, а з іншого – взаємодіяти з негативно зарядженими або нейтральними частинками, які мають неподілені електронні пари (кислотно-основна взаємодія).
Окисно-відновні реакції – взаємодія кислот з металами, які в ряду стандартних електродних потенціалів розміщені до Гідрогену:
2Ме + 2nН+ = 2Меn+ + nH2.
За цією схемою реагують усі кислоти-неокисники.
Кислотно-основними є реакції з основними оксидами, основами (див. вище), середніми, основними та іноді з кислими солями (див. Солі) з утворенням нових солей:
H2SO4 + СаO = CaSO4↓ + H2O, HCl + NaOH= NaCl + H2O,
2HNO3 + BаCO3 = Ba(NO3)2 + CO2↑ + H2O,
4HBr + (CuOH)2CO3 = 2CuBr2 + CO2↑ + 3H2O,
H2SO4 + 2KHSO3 = K2SO4 + 2SO2↑ + 2H2O.
Багатоосновні кислоти, перебуваючи у реакційній суміші у надлишку, реагують із середніми солями утворюючи кислі солі:
Ca3(PO4)2 + 4H3PO4 = 3Ca(H2PO4)2, KOH + H2SO4 = KHSO4 + H2O,
Окремим випадком кислотно-основної взаємодії є кольорові реакції з індикаторами (див. Індикатори).
При нагріванні оксигеновмісні кислоти відщеплюють воду з утворенням ангідридів:
2H3PO4 = P2O5 + 3H2O, 4HNO3 = 4NO2 + 2H2O + O2.
13.6. Амфотерні гідроксиди
Поряд з типовими основами та кислотами існує велика група гідроксидів, які можуть взаємодіяти з кислотами (виявляючи при цьому властивості основ) або з основами (виявляючи кислотні властивості) з утворенням солі та води – амфотерні гідроксиди.
До них належать гідроксиди металів головних підгруп (берилію Ве, алюмінію Al) і багатьох металів побічних підгруп Періодичної системи, які перебувають у проміжних ступенях окиснення: Ве(ОН)2, Al(OH)3, Zn(OH)2, Cr(OH)3, Pb(OH)2 тощо.
Розглянемо амфотерність на прикладі цинк гідроксиду Zn(OH)2.
У водному розчині Zn(OH)2 дисоціює за схемою:
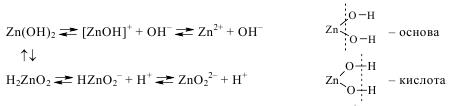
За рахунок однакової кількості утворених іонів Н+ та ОН– амфотерні гідроксиди не змінюють колі індикаторів.
Одержують амфотерні гідроксиди тими ж способами, що й нерозчинні у воді основи – взаємодією солей з лугами:
Al2(SO4)3 + 6NaOH = 2Al(OH)3 + 3Na2SO4.
Для запобігання розчинення утвореного амфотерного гідроксиду у надлишку лугу:
NaOH + Al(OH)3 = Na[Al(OH)4],
останнього беруть менше від розрахованої кількості.
Хімічні властивості амфотерних гідроксидів.
- Кислотні властивості виявляються у реакціях з водними розчинами лугів:
H2ZnO2 + 2NaOH = Na2[Zn(OH)4],
або при сплавленні у твердому стані:
H2ZnO2 + 2NaOH = Na2ZnO2 + 2Н2О.
- Основні властивості виявляються у реакціях з кислотами:
Zn(OH)2 + HСl = ZnCl2 + 2 Н2О.
Схематично запишемо перетворення Zn(OH)2 у водних розчинах, залежно від рН середовища:
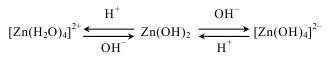
13.7. Солі
Солі – складні речовини, утворені катіонами металів (Men+) або амоніаку NH4+ та аніонами кислотних залишків Anm–: MemAnn, де n i m – відповідно заряди катіона та аніона.
Класифікація солей.
Солі можна розглядати як продукти заміщення атомів Гідрогену у молекулах кислоти на катіони металу або амоніаку, або гідроксогруп в основах на аніони кислотних залишків (див. схема 13.1).
Якщо заміщення повне, утворюються нормальні (середні) солі:
Н2SO4 + 2NaOH = Na2SO4 + 2H2O,
Ca(OH)2 + 2HCl = CaCl2 + 2H2O.
До простих солей також відносять пероксиди металів (Na2O2, ВаО2), бінарні сполуки металів з неметалами (крім оксидів), змішані оксиди (Fe3O4 = Fe(FeO2)2, Pb3O4 = Pb(PbO2)2 тощо).
У випадку неповного заміщення атомів Гідрогену у молекулі кислоти, утворюються кислі солі:
Н3РO4 + NaOH = NaН2РO4 + H2O.
Кислі солі утворюють лише багатоосновні кислоти (Н2СO3, Н2С2O4, Н2SO4, Н2S, Н3РO4 тощо).
При неповному заміщенні гідроксогруп у молекулі основи, утворюються основні солі:
Al(OH)3 + 2HCl = (AlOH)Cl2 + 2H2O.
Основні солі утворюють лише багатокислотні основи (Ca(OH)2, Al(OH)3, Fe(OH)2, Fe(OH)3 тощо).
Змішані солі утворені одним катіоном металу і аніонами різних кислот:
Ca(ОН)(OCl) + HCl = Ca(OCl)Cl + H2O.
Подвійні солі утворені різними катіонами і аніоном однієї кислоти:
KHSO4 + NaOH = KNaSO4 + H2O.
Особливий тип солей – комплексні сполуки, розглянуто нижче.
Номенклатура солей.
Назву солям дають у порядку запису складових частин у формулі: спочатку назва катіона, потім – аніона у родовому відмінку: NaCl – натрій хлорид, CaS – кальцій сульфід.
У випадку катіонів металів зі змінною валентністю, після їх назви у родовому відмінку римською цифрою вказують у дужках валентність катіона: FeSO4 – ферум (ІІ) сульфат, CrCl3 – хром (ІІІ) хлорид.
У назвах кислих солей використовують префікс гідроген-, зазначаючи при цьому кількість атомів гідрогену: NaHCO3 – нaтрій гідрогенкарбонат, Ca(H2PO4)2 – кальцій дигідрогенфосфат.
У назвах основних солей використовують префікс гідроксо-, зазначаючи при цьому кількість гідроксогруп: Са(ОН)Br – кальцій гідроксобромід, Al(OH)2Cl – алюміній дигідроксохлорид.
Назви катіонів або аніонів подвійних чи змішаних солей перелічують у порядку запису їх у формулі: KAl(SO4)2 – калій алюміній сульфат, NH4Fe(SO4)2 – амоній ферум (ІІІ) сульфат, Ca(OCl)Cl – кальцій гіпохлорит хлорид, BiSCl – бісмут (ІІІ) сульфід хлорид.
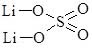
Записуючи графічні формули солей, за основу беруть графічні формули відповідних кислот, заміщуючи у них атоми Гідрогену на катіони металу (табл. 13.9).
Таблиця 13.9
Графічні формули деяких солей
|
Кислота |
Графічна формула |
Кисла сіль |
Середня сіль |
|
|
Сульфідна Н2S |
|
калій гідрогенсульфід |
калій сульфід |
|
|
Сульфатна Н2SО4 |
|
літій гідрогенсульфат |
літій сульфат |
|
|
Фосфатна Н3РО4 |
|
натрій дигідрогенфосфат |
натрій гідрогенфосфат |
натрій фосфат |
Способи одержання солей.
Найважливіші реакції одержання солей розглянуті при описі оксидів, основ та кислот. Узагальнює їх схема 13.3, яка одночасно показує генетичний зв’язок між оксидами, кислотами, основами та солями.
Схема 13.3
Генетичний зв’язок між основними класами неорганічних сполук
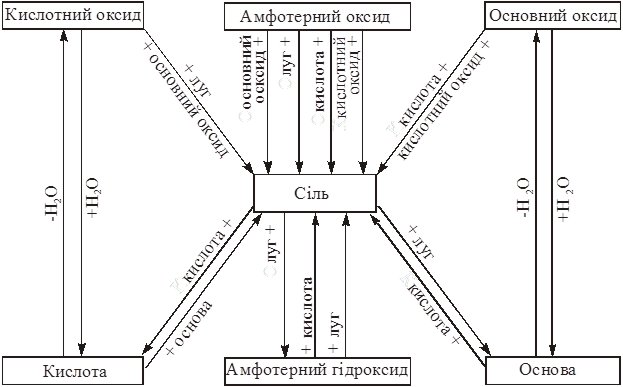
Солі також можна добути взаємодією:
1. простих речовин металу і неметалу:
2K + Cl2 = 2KCl, Fe + S = FeS.
2. металів із кислотами:
Mg + 2HCl = MgCl2 + H2, Fe + H2SO4 = FeSO4 + H2.
3. металів із солями:
Сu + HgCl2 = CuCl2 + Hg↓, Fe + CuSO4 = FeSO4 + Cu↓.
4. солей із солями:
Ba(NO3)2+ Na2SO4 = BaSO4↓ + 2NaNO3, NH4Cl+ AgNO3 = NH4NO3 + AgCl↓.
5. солей з основами:
СuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4, FeCl3 + 3KOH = Fe(OH)3↓ + 3KCl.
6. солей з кислотами:
Na2CO3 + 2HCl = 2NaCl + CO2 + H2O, FeS + 2HNO3 = Fe(NO3)2 + H2S.
7. термолізом солей:
2NaHCO3 = Na2CO3 + H2O + CO2, 2KNO3 = 2KNO2 + O2.
Існує ще багато способів одержання солей, але при виборі того чи іншого способу, перш за все слід враховувати його раціональність.
Кислі солі одержують тими ж методами, що й середні, однак при цьому беруть значний надлишок кислотного компонента:
NaOH + H2SO4 = NaHSO4 + H2O, Ca(OH)2 + CO2 = Ca(HCO3)2.
Діючи кислотою на середню сіль, можна перетворити її у кислу:
K3PO4 + 2H3PO4 = 3KH2PO4, Na2CO3 + HCl = NaHCO3 + NaCl.
Основні солі одержують аналогічно, але у надлишку беруть основу:
Ca(OH)2 + HCl = Ca(OH)Cl, 2Cu(OH)2 + CO2 = (CuOH)2CO3 + H2O.
Діючи основою на середню сіль, можна перетворити її в основну:
Al2(SO4)3 + 2NaOH = 2Al(OH)(SO4) + Na2SO4,
Bi(NO3)3 + 2KOH = Bi(OH)2NO3 + 2KNO3.
Подвійні солі одержують дією іншої кислоти на основну сіль:
Ca(OH)Cl + HClO = Ca(OCl)Cl + H2O.
Змішані солі утворюються при дії на кислі солі інших лугів:
KHSO4 + NaOH = KNaSO4 + H2O.
Одержання комплексних солей див. Комплексні сполуки.
Фізичні властивості солей.
За нормальних умов усі солі – тверді кристалічні речовини з високими температурами плавлення. Тип хімічного зв’язку – іонний. Забарвлення солей змінюється від безбарвного до темно-коричневого.
За розчинністю у воді виділяють легкорозчинні (NaCl, NH4NO3), важкорозчинні (PbCl2, CaSO4) і нерозчинні (AgCl, CaCO3, BaSO4) (див. Розчинність).
Хімічні властивості солей.
Солі взаємодіють з металами, неметалами, кислотами, основами і між собою. Ці реакції розглянуті при вивченні способів одержання солей.
Важливою хімічною властивістю солей є їх гідроліз.
Гідроліз солей.
Раніше показано (див. рН), що чиста вода має нейтральне середовище (рН = 7), водні розчини кислот створюють кисле (рН < 7), а основ – лужне (рН > 7) середовище.
Водні розчини солей мають різне значення рН. Так, водні розчини NaCl, KNO3 мають рН = 7, Na2CO3, CH3COONa – pH > 7, NH4Cl, FeSO4 – pH < 7. Причиною цього є гідроліз.
Гідроліз – реакція обміну солі з водою, в результаті якої утворюються малодисоційовані або малорозчинні сполуки.
Залежно від сили кислот та основ, які утворили сіль, виділяють 4 типи солей, гідроліз яких відбувається по-різному:
- утворені сильною кислотою і сильною основою;
- утворені сильною кислотою і слабкою основою;
- утворені слабкою кислотою і сильною основою;
- утворені слабкою кислотою і слабкою основою.
Розглянемо детально гідроліз перелічених типів солей.
1. Солі, утворені сильною кислотою і сильною основою (NaCl, KNO3).
У водному розчині NaCl відбувається процес:
NaCl ↔ Na+ + Cl–
2. Солі, утворені сильною кислотою і слабкою основою (СuCl2, FeSO4).у результаті його не утворюються слабкі електроліти чи малорозчинні сполуки, тому гідроліз не відбувається і у розчинах таких солей рН = 7.
Якщо гідролізу піддається сіль, утворена багатоосновною кислотою чи багатокислотною основою, процеси відбуваються ступінчато.
Гідроліз CuCl2. Спочатку сіль дисоціює:
СuCl2 ↔ Cu+ + 2Cl–
|
I ступінь: |
Cu2+ + H2O ↔ Cu(OH)+ + H+ CuCl2 + H2O ↔ Cu(OH)Cl + HCl |
|
|
II ступінь: |
Cu(OH)+ + H2O ↔ Cu(OH)2 + H+ Cu(OH)Cl + H2O ↔ Cu(OH)2 + HCl |
|
|
Сумарно |
CuCl2 + 2H2O ↔ Cu(OH)2↓ + 2HCl |
|
У результаті реакції утворюється малодисоційована сполука Cu(OH)2 і створюється надлишок катіонів Н+, тому середовище кисле – рН < 7.
Гідроліз солей такого типу називають ще гідролізом по катіону оскільки слабкий електроліт утворюється за участю саме катіону (у нашому випадку Сu2+).
3. Солі, утворені слабкою кислотою і сильною основою (NaNO2, K2S).
Гідроліз K2S проходить у 2 ступені. Спочатку сіль дисоціює:
K2S ↔ 2K+ + S2–.
|
I ступінь: |
S2– + H2O ↔ HS– + OH– K2S + H2O ↔ KHS + KOH |
|
|
II ступінь: |
HS– + H2O ↔ H2S + OH– KHS + H2O ↔ H2S + KOH |
|
|
Сумарно |
K2S+ 2H2O ↔ H2S + 2KOH |
|
У результаті реакції утворюється малодисоційована сполука H2S і створюється надлишок аніонів ОН–, тому середовище лужне – рН > 7.
Гідроліз солей такого типу називають ще гідролізом по аніону оскільки слабкий електроліт утворюється за його участю (у нашому випадку S2–).
В обох випадках гідроліз максимально відбувається за І ступенем.
Як правило, гідроліз – оборотний процес, проходженню реакції до кінця перешкоджає зворотна реакція нейтралізації утвореної кислоти (або основи) аніонами ОН– (або катіонами Н+).
4. Солі, утворені слабкою кислотою і слабкою основою (CaC2, Ca3P2, Al2S3, (NH4)2CO3, NH4CN, CH3COONH4) гідролізують необоротно:
Al2S3 + 6Н2О = 2Al(OH)3↓ + 3H2S.
Гідроліз відбувається одночасно по катіону і по аніону, рН = 7.
У випадку гідролізу NH4CN, CH3COONH4, рН розчину залежить від сили утворених кислоти (рКа) та основи (pКb). У реакції
CH3COONH4 + Н2О = CH3COOН + NH4ОН,
рКа(CH3COOH) = рКb(NH4ОН) = 4,75, тому середовище нейтральне (рН = 7).
Отже, рН водного розчину солі визначає сильний електроліт, іони якого входять до складу солі, що гідролізує.
На процес гідролізу впливає концентрація солі і температура.
Згідно принципу Ле-Шательє, розбавлення розчину рівноцінне збільшенню концентрації одного з реагентів – води, тому рівновага зміщується вправо і гідроліз посилюється.
Зміна температури впливає на ступінь дисоціації води. Зі зростанням температури кількість іонів Н+ і ОН– у розчині зростає, тому збільшується ймовірність взаємодії їх з іонами, утвореними при дисоціації молекул солі, з утворенням малодисоційованої кислоти чи основи. Тому при нагріванні гідроліз відбувається повніше.
Кількісно гідроліз характеризує ступінь гідролізу h – відношення концентрації гідролізованих молекул N1 до загальної концентрації солі N0:
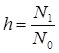 .
.
13.8. Комплексні сполуки
Як зазначалось раніше, у результаті деяких реакції утворюються сполуки, будова і властивості яких однозначно не входять у розглянуті нами досі класи неорганічних речовин.
Ці речовини відносять до комплексних сполук. Утворюються вони при взаємодії простих неорганічних речовин – солей, кислот, основ:
FeCl2 + 6KCN = K4[Fe(CN)6] + 2KCl, Al(OH)3 + 3NaOH = Na3[Al(OH)6],
AgNO3 + 2NH3 = [Ag(NH3)2]NO3, Au + HNO3 + 4HCl = H[AuCl4] + NO + 2H2O.
Основи вчення про комплексні сполуки заклав А. Вернер у 1893 р. Згідно його координаційної теорії кожна комплексна сполука містить комплексний іон, утворений центральним атомом – комплексоутворювачем та розміщеними навколо нього лігандами – нейтральними молекулами або іонами. Загальна кількість зв’язків центрального атома з лігандами – його координаційне число. Комплексоутворювач і ліганди утворюють внутрішню сферу комплексу, або комплексний іон, який при написанні виділяють квадратними дужками. За межами комплексного іона розміщена зовнішня сфера, утворена катіонами або аніонами. Існують комплексні сполуки без зовнішньої сфери.
Проілюструємо сказане схемою:
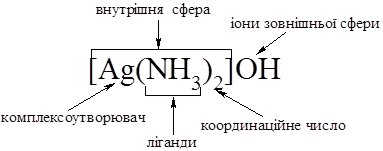
На основі будови комплексних сполук базується їх сучасне визначення.
Комплексними називають складні сполуки, які містять комплексний іон, що складається із комплексоутворювачів і лігандів та здатний до самостійного існування у розчині і /або в розплаві.
Типовими комплексоутворювачами є d- та f-елементи і їх катіони: Cr, Fe, Mn, Ag+, Cu2+, Hg2+, Zn2+, Cr3+, Fe2+, Fe3+, Co3+, Ni2+, Pt4+ тощо.
Катіони s- i p-елементів (Be2+, Al3+, Sn4+, Pb4+) та атоми неметалів (N, P, Si, B) теж можуть бути комплексоутворювачами.
Лігандами можуть бути нейтральні молекули (H2O, CO, NH3, C6H6) або аніони кислот. У складі ліганду обов’язково має бути атом з неподіленою електронною парою.
Внутрішня сфера комплексних сполук може бути нейтральною або зарядженою (позитивно чи негативно):
[Ni(CO)4] – нейтральна внутрішня сфера;
K4[Fe(CN)6] – негативно заряджена внутрішня сфера (комплексний аніон);
[Ag(NH3)2]Сl – позитивно заряджена внутрішня сфера (комплексний катіон).
Якщо внутрішня сфера нейтральна, зовнішньої сфери немає. Якщо ж заряджена, то зовнішня сфера має такий же заряд, протилежний за знаком. Найчастіше зовнішню сферу утворюють катіони лужних, лужноземельних металів, амонію, аніони безоксигенових, оксигеновмісних кислот, гідроксогрупи ОН–.
Розглянемо механізм виникнення хімічних зв’язків між комплексоутворювачем і лігандами на прикладі [Zn(NH3)4]Cl2.
Будова зовнішнього електронного рівня атома Zn зображається формулою 3d104s2, а іона Zn2+ – 3d104s0:
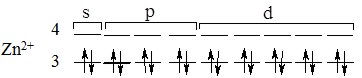
На зовнішньому електронному рівні іона Zn2+ є вільні орбіталі, які можуть бути задіяні в утворенні хімічних зв’язків за донорно-акцепторним механізмом. Для утворення чотирьох таких зв’язків використовується одна s- і три р-орбіталі четвертого електронного рівня іона Zn2+.
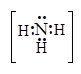 Молекули NH3 (ліганди) несуть неподілену електронну пару на атомі Нітрогену, яку вони надають як донори для утворення зв’язків з іоном Zn2+ – акцептором.
Молекули NH3 (ліганди) несуть неподілену електронну пару на атомі Нітрогену, яку вони надають як донори для утворення зв’язків з іоном Zn2+ – акцептором.
Таким чином, між іонами Zn2+ і молекулами NH3 виникає чотири зв’язки за донорно-акцепторним механізмом:
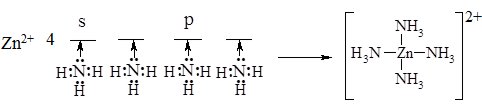
За цим механізмом утворюються зв’язки в усіх комплексних сполуках. Зв’язок між внутрішньою і зовнішньою сферами утворюється за іонним механізмом.
У водних розчинах комплексні сполуки (крім тих, що складаються лише з внутрішньої сфери) дисоціюють практично повністю і є сильними електролітами:
K2[PtCl6] ↔ 2K+ + [ PtCl6]2–; [Ag(NH3)2]Cl ↔ [Ag(NH3)2]+ + Cl–.
Комплексні іони дисоціюють дуже незначною мірою за першим ступенем, а за кожним наступним ще менше:
І ступінь: [Ag(NH3)2]+ ↔ [Ag(NH3)]+ + NH3;
ІІ ступінь: [Ag(NH3)]+ ↔ Ag+ + NH3.
Координаційну формулу комплексної сполуки можна встановити реакціями подвійного обміну. Так, Платина Pt утворює комплексні сполуки складу PtCl4×6NH3, PtCl4×4NH3, PtCl4×2NH3, PtCl4×2KCl. Якщо на розчини цих сполук подіяти AgNO3, то осад AgCl утвориться лише у перших двох випадках, причому у другому буде осаджено лише ½ хлору. Очевидно, що у сполуці PtCl4×6NH3 всі атоми хлору містяться у зовнішній сфері, і її формула [Pt(NH3)6]Cl4. Аналогічно у PtCl4×4NH3 у зовнішній сфері міститься два атоми хлору і її формула [Pt(NH3)4Cl2]Cl2. Сполука PtCl4×2NH3 має формулу [Pt(NH3)6Сl4]. У розчині PtCl4×2KCl можна виявити іони К+, тобто її формула К2[PtCl6].
Комплексні сполуки застосовують як реагенти в аналітичній хімії. Велика роль природних комплексних сполук у процесах фотосинтезу (хлорофіл – комплексна сполука магнію), біологічного окиснення, дихання та ферментативного каталізу (гемоглобін – комплексна сполука Феруму (ІІІ)). Вітамін В12 – комплексна сполука кобальту (ІІ).