15. ГІДРОГЕН. ВОДЕНЬ
15. ГІДРОГЕН. ВОДЕНЬ
Електронна структура.
Гідроген – перший елемент періодичної системи. Заряд ядра +1, будова електронної оболонки 1s1, відносна атомна маса 1,008. Відносна електронегативність 2. Два атоми Гідрогену утворюють молекулу водню Н2 з коротким (0,07 нм) і міцним (436 кДж/моль) зв’язком.
Будова електронного рівня атома Гідрогену:
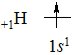
Подібно до галогенів, Гідроген може приєднувати один електрон з утворенням завершеної електронної конфігурації найближчого благородного газу – Гелію – 1s2 і виявляти окисні властивості в реакціях з лужними та лужно-земельними металами
2Na + H2 = 2NaH,
утворюючи солеподібні гідриди.
Разом з тим, подібно до лужних металів, атом Гідрогену може віддавати один електрон, виявляючи відновні властивості у реакціях з більш електронегативними елементами:
H2 + F2 = 2HF.
У зв’язку з цим однозначно розмістити Гідроген у Періодичній системі важко, але високі температури плавлення та кипіння, будова молекули, хімічні властивості наближають його до галогенів, тому часто його розміщують у VIIА підгрупі.
Назву Гідроген (гр. Hydro genium – воду утворює) вперше запропонував А. Лавуазьє у 1783 р.
Поширення в природі.
Гідроген – найпоширеніший елемент космосу. Його масова частка у земній корі становить 0,15% (атомна – 80%). Понад 95% відомих речовин містять водень – вода, нафта, вугілля, природні гази, мінерали, органічні сполуки, усі рослинні і тваринні організми. Водень – важливий компонент атмосфери Сонця, планет, міжпланетного простору, туманностей.
Природний Гідроген складається із суміші ізотопів ![]() – протію і
– протію і ![]() – дейтерію у відношенні 6700 : 1. Штучно одержаний ізотоп
– дейтерію у відношенні 6700 : 1. Штучно одержаний ізотоп ![]() – тритій. Іноді ізотопи дейтерію та тритію записують відповідно D та Т.
– тритій. Іноді ізотопи дейтерію та тритію записують відповідно D та Т.
Фізичні властивості.
У вільному стані молекулярний водень Н2 – безбарвний газ без смаку і запаху, у 14,4 раз легший за повітря, погано розчинний у воді, добре поглинається деякими металами (1 об’єм паладію Pd поглинає до 900 об’ємів Н2), що використовується для транспортування водню. Температура плавлення –259 0С, температура кипіння –263 0С.
Рідкий водень вперше добув Дж. Дьюар (Шотландія) у 1898 р.
Одержання в лабораторії.
- Водень вперше добув Г. Кавендіш у 1766 р. дією хлоридної кислоти на неблагородні метали:
Fe + 2HCl = FeCl2 + H2.
- Розчиненням алюмінію або цинку в лугах:
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2,
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2.
- Дією води на лужні та лужно-земельні метали або на їх гідриди:
2Na + 2H2O = 2NaOH + H2, CaH2 + 2H2O = Ca(OH)2 + H2.
Одержання в промисловості.
- Відновленням пари води над розпеченим коксом (газифікація вугілля):
С + 2Н2О = СО + Н2.
- Конверсією карбон (ІІ) оксиду СО або метану СН4 з парою води:
СО + Н2О = СО2 + Н2, СН4 + Н2О = СО2 + 3Н2.
Утворену суміш СО2 та Н2 називають водяним газом.
- Електролізом водних розчинів галогенідів лужних металів:
2NaCl + 2H2O = 2NaOH + Cl2 +H2.
- Найчистіший водень утворюється на катоді при електролізі води, підкисленої сульфатною кислотою для збільшення електропровідності:
2Н2О = 2Н2 + О2.
Хімічні властивості.
Хімічний зв’язок у молекулі Н2 – ковалентний неполярний, внаслідок чого водень хімічно малоактивний, більшість реакцій за його участю відбуваються при нагріванні.
Найчастіше водень виявляє відновні властивості.
- Взаємодія з неметалами. Майже з усіма неметалами водень утворює леткі сполуки типу ЕНх, де Е – атом неметалу. За нормальних умов водень безпосередньо реагує лише з F2 і О2:
H2 + F2 = 2HF, 2H2 + O2 = 2H2O.
Суміш водню та кисню у співвідношенні 2:1 при підпалюванні вибухає і називається “гримучий газ”.
З іншими неметалами водень реагує лише при підвищеній температурі:
H2 + S = H2S, 3H2 + N2 = 2NH3, 2H2 + C = CH4.
Реакції водню з киснем та хлором відбуваються за вільно-радикальним ланцюговим механізмом:
- Ініціювання ланцюга – Cl2
 2Cl·.
2Cl·. - Ріст ланцюга – Cl· + Н2 → HCl + H·,
Н· + Сl2 → HCl + Cl·.
- Обрив ланцюга – Н· + Cl· → HCl,
Н· + H· → H2,
Cl· + Cl· → Cl2.
Стадія 2 (ріст ланцюга) відбувається, поки у реакторі є водень та хлор. Обрив ланцюга (стадія 3) відбувається при закінченні одного з реагентів.
В усіх сполуках водню з немеатлами реалізується ковалентний полярний тип хімічного зв’язку, між молекулами деяких з них (рідкі HF, H2O, NH3) виникають водневі зв’язки.
- Взаємодія з оксидами металів. При високій температурі водень відновлює оксиди багатьох металів:
Fe2O3 +3H2 = Fe + 3H2O, CuO +H2 = Cu + H2O.
На цій властивості базується застосування водню як відновника при добуванні деяких металів. У такі реакції набагато легше вступає атомарний водень, що утворюється в момент виділення.
- Взаємодія з органічними речовинами. Водень вступає у реакції приєднання за кратними зв’язками або відновлює органічні речовини. Детально ці реакції розглянуті у розд. Органічна хімія.
- Взаємодія з металами. Водень реагує з лужними та лужноземельними металами з утворенням солеподібних гідридів складу МеНх, де Ме – лужний або лужноземельний метал:
Са + Н2 = СаН2.
У гідридах ступінь окиснення Гідрогену –1, тобто Н2 є окисником. Гідриди металів легко розкладаються водою та кислотами:
NaH + H2O = NaOH + H2, BaH2 + 2H2O = Ba(OH)2 + 2H2.
Застосування водню.
Водень у значних кількостях використовують у хімічній промисловості для одержання амоніаку, хлороводню, метанолу тощо. Гідрогенізацією рідких жирів у харчовій промисловості одержують маргарин (див. Органічна хімія).
Широко досліджуються можливості використання водню у двигунах внутрішнього згоряння. Як джерело водню у них використовують прості (NaH, CaH2) та комплексні (Li[AlH4], Li[BH4]) гідриди. У зв’язку з тим, що при окисненні водню утворюється лише вода Н2О, атмосфера залишається чистою і тому водень є екологічно чистим паливом.
Реакцію горіння водню в кисні, яка створює температуру 2800 0С використовують при автогенному різанні металів.