16. ЕЛЕМЕНТИ VIIA ГРУПИ. ЗАГАЛЬНА ХАРАКТЕРИСТИКА ГАЛОГЕНІВ
16. ЕЛЕМЕНТИ VIIA ГРУПИ. ЗАГАЛЬНА ХАРАКТЕРИСТИКА ГАЛОГЕНІВ
| Сайт: | Підготовка до ЗНО - Освітній портал "Академія" |
| Курс: | Підготовка до ЗНО з хімії |
| Книга: | 16. ЕЛЕМЕНТИ VIIA ГРУПИ. ЗАГАЛЬНА ХАРАКТЕРИСТИКА ГАЛОГЕНІВ |
| Надруковано: | Гість |
| Дата: | Sunday 29 June 2025 2:35 PM |
16. ЕЛЕМЕНТИ VIIA ГРУПИ. ЗАГАЛЬНА ХАРАКТЕРИСТИКА ГАЛОГЕНІВ
До галогенів (гр. галогени – “солетвірні”) відносять елементи, розміщені у VIIA підгрупі Періодичної системи (крім Гідрогену): Флуор F, Хлор Cl, Бром Br, Йод I, Астат At.
Електронна структура.
На зовнішньому електронному рівні атомів галогенів є 7 електронів, електронна конфігурація – ns2np5. До набуття стійкої електронної конфігурації благородного газу (ns2np6) атомам галогенів не вистачає одного електрона, тому усі галогени є високоелектронегативними елементами і сильними окисниками. Найхарактерніший ступінь окиснення у галогенів ‑1.
Усі атоми галогенів (крім Флуору) мають незаповнений d-підрівень, за рахунок чого можуть переходити у збуджений стан, виявляючи валентність 3, 5, 7 та позитивні ступені окиснення.
Усі галогени – типові неметали, у вільному стані утворюють двоатомні молекули з ковалентним неполярним зв’язком. За рахунок малої енергії зв’язку галогени хімічно активні.
У підгрупі галогенів зверху вниз зростає радіус атома, зменшуються електронегативність та неметалічні властивості, у ряду HF – HCl – HBr – HI – HAt зростають кислотні і відновні властивості.
Найпоширенішими в природі є Хлор і Флуор. За н. у. фтор, хлор – гази, бром – рідина, йод та астат – тверді речовини. Усі галогени отруйні.
Природні сполуки галогенів.
У зв’язку з високою хімічною активністю галогени у природі зустрічаються виключно у зв’язаному стані – в основному у формі солей відповідних галогеноводневих кислот.
Найпоширенішими мінералами Флуору є плавиковий шпат CaF2, кріоліт Na3[AlF6] та фтороапатит Ca5(PO4)3F.
Бром у вигляді бромідів міститься у морській воді, яка є основним джерелом його добування.
Йод не утворює власних мінералів, а міститься у вигляді KIO3 та KIO4 у покладах чилійської селітри NaNO3. У великих кількостях йод міститься у деяких видах морських водоростей та підземних бурових водах.
Одержання галогенів.
- Дією окисників (K2Cr2O7, KMnO4, KClO3, MnO2) на галогеніди:
2Hal– – 2e– = Hal2.
- Електролізом розплавів галогенідів лужних металів (див Електроліз).
Бром і йод добувають дією Cl2 на розчини їх солей (див. Хлор).
16.1. Хлор
Електронна структура.
Хлор – елемент 3 періоду VIIА групи. Заряд ядра + 17, будова зовнішнього електронного рівня 3s23p5. Приймаючи один електрон, хлор набуває електронної конфігурації аргону. Має високі електронегативність (3,0) і спорідненість до електрона.
Молекула Cl2 складається із двох атомів Хлору зв`язаних ковалентним неполярним зв`язком. Довжина зв`язку 0,198 нм, енергія – 243 кДж/моль.
Перехід атома у збуджений стан супроводжується розпаровуванням електронів 3p- і 3s-підрівнів та переходом їх на вільні орбіталі близького за енергією 3d-підрівня:
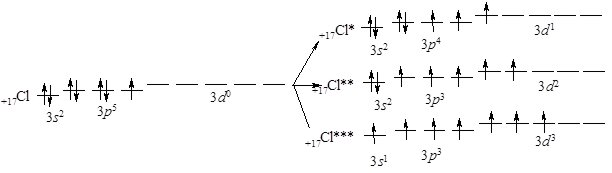
Внаслідок цього кількість неспарених електронів зростає від 1 (у незбудженого атома) до 3, 5 або 7, що дає змогу виявляти ступені окиснення + 1, + 3, + 5, + 7, а також + 4 і + 6 (див. Оксигеновмісні сполуки Хлору).
Поширення у природі.
Масова частка хлору в земній корі становить 0,045%. У вільному стані хлор не зустрічається, найчастіше існує у формі хлоридів. Мінерали: NaCl – галіт, KCl – сильвін, KCl∙NaCl сильвініт, KCl∙MgCl2∙6H2O – карналіт. Багато хлоридів міститься у морській воді.
Природні ізотопи: ![]() і
і ![]() (75,4% і 24,6% відповідно).
(75,4% і 24,6% відповідно).
Одержання в лабораторії.
1. Окисненням хлоридної кислоти або хлоридів у кислому середовищі:
2KMnO4 + 16HCl = 5Cl2 + 2KCl + 2MnCl2 + 8H2O
PbO2 + 2NaCl + 4H2SO4 = Cl2 + Pb(HSO4)2 + 2NaHSO4 + 2H2O
Як окисники використовують KMnO4, K2Cr2O7, KClO3, PbO2.
2. Взаємодією HCl з хлорним вапном:
4HCl + Ca(OCl)Cl = CaCl2 + Cl2 + 2H2O
3. Методом Велдона:
MnO2 + 4HCl = MnCl2+ Cl2 + 2H2O
Одержання в промисловості.
- Електролізом розплавів або водних розчинів хлоридів:
2NaClрозпл. ![]() 2Na + Cl2,
2Na + Cl2,
2NaCl + 2H2O = 2NaOH + Cl2 + H2.
Хлор утворюється на аноді.
- Електролізом HCl:
2HCl = Cl2 + H2,
хлор утворюється на аноді.
- Методом Дікона за наявності CuCl2:
4HCl + O2 = 2Cl2 + 2H2O.
Фізичні властивості.
За н. у. хлор – жовто-зелений газ з різким запахом, важчий за повітря. Розчиняється у воді, взаємодіючи з нею.
Отруйний, викликає подразнення органів дихання, у високій концентрації – задуху і смерть. Температура плавлення –101,0 0С, температура кипіння –34,1 0С.
Хімічні властивості.
Зв`язок у молекулі Cl2 легко руйнується при дії УФ-світла (сонячні промені), що веде до утворення частинок з неспареними електронами і високою хімічною активністю – радикалів:
Cl2 ![]() 2Cl·.
2Cl·.
1. Хлор легко реагує практично з усіма металами (навіть із золотом) окиснюючи їх до найвищого ступеня окиснення і утворюючи солі – хлориди:
2Na + Cl2 = 2NaCl, 2Fe + 3Cl2 = 2FeCl3, Cu + Cl2 = CuCl2,
2.Реагує з більшістю неметалів (крім O2, N2, C):
Cl2 + H2= 2HCl, 5Cl2 + 2P = 2PCl5, 3Cl2 + P = PCl3.
Сполуки Хлору з неметалами (крім Гідрогену) називають галогенангідридами відповідних кислот.
3. З водою:
Cl2 + H2O ↔ HCl + HClO.
Розчин хлору у воді називають хлорною водою.
4. З водними розчинами лугів:
а) за н. у.: Cl2 +NaOH = NaCl + NaClO + H2O,
б) при 1000С: 3Cl2 + 6NaOH = 5NaCl + NaClO3 + 3H2O.
5. Взаємодія з галогенідами. Хлор витісняє інші галогени (крім Флуору) з їх солей у розплавах і водних розчинах:
Cl2 +KBr = KCl + Br2, Cl2 +KI = KCl + I2.
Ці реакції використовують для одержання Br2 і I2 в промисловості.
6. Окиснення інших речовин. Хлор окиснює інші галогени (крім F2):
Br2 + 5Cl2 + 12KOH = 2KBrO3 + 10KCl + 6H2O.
Реагує з типовими відновниками:
Cl2 + SO2 + 2H2O = H2SO4 + 2HCl.
7. З органічними речовинами хлор вступає у реакції приєднання та заміщення (див. Органічна хімія).
Застосування галогенів.
Фтор використовують для одержання тефлону (політетрафторетилену, фторопласту) стійкого до дії агресивних реагентів і високих (до 3000С) температур, який застосовують у виробництві хімічної апаратури. Сполуки фтору використовують у медицині (компоненти зубних паст). В холодильних установках використовують фреони (фреон-12 CF2Cl2) – холодоагенти.
Хлор використовують для промислового одержання HCl, синтезу хлороорганічних сполук (пестицидів, розчинників, лікарських засобів) та дезинфекції води.
Розчин йоду (0,5% у спирті) застосовують для дезинфекції ран.
16.2. Галогеноводні та галогеніди.
Галогени утворюють з Гідрогеном сполуки типу H–Hal, водні розчини яких є кислотами.
У галогеноводнях зв`язок – ковалентний полярний. У цих сполуках галогени виявляють найнижчий ступінь окиснення –1.
Одержання галогеноводнів.
- Взаємодія простих речовин H2 і Hal2:
H2 + Hal2 = 2HHal.
2. Дією концентрованої сульфатної кислоти на тверді солі галогеноводневих кислот:
CaF2 + H2SO4 = CaSO4 + 2 HF, NaCl + H2SO4 = NaHSO4 + 2HCl.
Одержати HBr і HI цим методом неможливо:
2KBr + 3H2SO4 = Br2 + 2KHSO4 + 2H2O + SO2,
8KI + 9H2SO4 = 4I2 + 8KHSO4 + 4H2O + H2S.
Фізичні властивості.
За н. у. HF – рідина, решта галогеноводнів – безбарвні гази. Висока температура кипіння HF пояснюється утворенням водневих зв`язків.
H–F∙∙∙H–F∙∙∙H–F
Усі галогеноводні добре розчинні у воді. Так 1 об`єм води розчиняє 500 об`ємів HCl. Розчин HF у воді – фторидна (плавикова) кислота, розчин HCl у воді – хлоридна (соляна) кислота.
Хімічні властивості.
Сила кислот у ряду HF – HCl – HBr – HI зростає. HF – кислота середньої сили, усі інші – сильні.
HF реагує зі склом за схемою:
40HF + CaO∙Na2O∙6SiO2 = CaF2 + 2NaF + 6H2[SiF6] + 14H2O,
тому плавикову кислоту зберігають у тефлонових балонах.
Реакція розчинення скла у HF лежить в основі процесу травлення – нанесення написів та візерунків на скляні вироби.
Газоподібний HCl реагує з амоніаком NH3, лугами, органічними речовинами (реакції приєднання):
NH3 + HCl = NH4Cl (або NH3∙HCl, [NH4+]Cl–),
NaOH+ HCl = NaCl + H2O
Хлоридна кислота – безбарвна рідина з різким запахом. Масова частка HCl – 37%.
Хлоридна кислота виявляє усі характерні властивості кислот: реагує з металами, оксидами, основами і деякими солями, з утворенням хлоридів.
Fe + 2HCl = FeCl2 + H2, CaO + 2HCl = CaCl2 + H2O,
Al(OH)3 + 3HCl = AlCl3 + H2O, NaHCO3+ HCl = NaCl + H2O + CO2.
При взаємодії HCl із сильними окисниками (KMnO4, K2Cr2O7, MnO2, PbO2) утворюється газоподібний Cl2:
14HCl + K2Cr2O7 = 3Cl2 + 2KCl + 2CrCl3 + 7H2O,
що застосовують для добування Cl2 у лабораторії.
Хлоридна кислота входить до складу шлункового соку і підтримує його pH ≈ 1,2. Її використовують для добування хлоридів, травлення металів при паянні та у гальванопластиці.
Солі галогеноводневих кислот – галогеніди (фториди, хлориди, броміди, йодиди). Більшість галогенідів добре розчинні у воді.
Галогеніди (крім фторидів) виявляють відновні властивості:
6NaI + K2Cr2O7 + 7H2SO4 = 3I2 + Cr2(SO4)3 + K2SO4 + 3Na2SO4 + 7H2O.
Якісні реакції на галогенід-іони.
Якісними називають реакції, якими можна виявити у досліджуваному розчині дану речовину. Якісними реакціями на галогенід-іони є взаємодія з аргентум нітратом AgNO3, у результаті якої утворюються малорозчинні солі:
Ag+ + Cl– = AgCl↓, Ag+ + Br– = AgBr↓, Ag+ + I– = AgI↓.
Вони утворюють осади характерного вигляду і забарвлення: AgCl – білий сирнистий, AgBr – світло-жовтий дрібнокристалічний, AgI – жовтий.
Усі галогеніди аргентуму нерозчинні у нітратній кислоті, але розчинні в амоніаку:
AgCl + NH3 = [Ag(NH3)2]Cl
При підкисленні нітратною кислотою відбувається зворотний процес:
[Ag(NH3)2]Cl + 2HNO3 = AgCl¯ + 2NH4NO3.
Застосування галогенідів.
Натрій хлорид використовують як харчову приправу, у виробництві хлору, хлороводню, мила. Калій хлорид – калійне добриво. Кальцій хлорид – осушуючий реагент і компонент охолоджуючих сумішей (суміш CaCl2 і льоду у відношенні 1:1,43, знижує температуру до –55 0С).
Броміди і йодиди використовують у фотографії як світлочутливі реагенти та у виробництві лікарських засобів.
16.3. Оксигеновмісні сполуки хлору
В усіх оксигеновмісних сполуках Хлор виявляє позитивні ступені окиснення (табл. 16.1).
Таблиця 16.1
Оксигеновмісні сполуки Хлору
|
Ступінь окиснення |
Оксид |
Кислота |
Аніон |
|
|||
|
формула |
систематична назва |
історична назва |
формула |
назва |
|||
|
+1 |
Cl2O |
HClO |
гіпохлоритна |
хлорнуватиста |
ClO– |
гіпохлорит |
|
|
Cl2O2 |
|||||||
|
+3 |
HClO2 |
хлоритна |
хлориста |
ClO2– |
хлорит |
||
|
Cl2O3 |
|||||||
|
Cl2O4 |
|||||||
|
+5 |
HClO3 |
хлоратна |
хлорнувата |
ClO3– |
хлорат |
||
|
Cl2O5 |
|||||||
|
Cl2O6 |
|||||||
|
+7 |
HClO4 |
перхлоратна |
хлорна |
ClO4– |
перхлорат |
||
|
Cl2O7 |
|||||||
Оксиди хлору – ангідриди відповідних кислот. Оксиди Cl2O2, Cl2O4, Cl2O6 при взаємодії з водою або лугами утворюють два аніони, за рахунок диспропорціювання:
Cl2O2 + 2KOH = KClO + KClO2 + H2О,
Cl2O4 + 2H2О = НClO2 + НClO3,
Cl2O6 + 2NaOH = NaClO3 + NaClO4 + H2О.
Оксиди ClO, Cl2O3, Cl2O5 та Cl2O7 при гідролізі утворюють лише один аніон.
Усі оксиди хлору – термодинамічно нестійкі речовини, при незначному струшуванні вибухають.
Сила оксокислот хлору та їх стійкість зростає зі збільшенням ступеня окиснення центрального атома. Окисна здатність кислот зменшується зі зростанням ступеня окиснення атома хлору. Перхлоратна кислота HClO4 – найсильніша і найстійкіша з усіх відомих кислот є найслабкішим окисником серед оксокислот хлору.
Гіпохлоритна кислота HClO є найсильнішим окисником, під дією світла розкладається:
HClO = HCl + O·,
утворений атомарний кисень зумовлює сильні окисні властивості.
Солі гіпохлоритної кислоти утворюються при дії вільного хлору на розчини лугів при охолодженні:
Cl2 + КОН = КClO + КCl + H2O.
Утворений розчин хлориду та гіпохлориту калію (або натрію) називають “жавелева вода”.
Дією хлору на сухий кальцій гідроксид Са(ОН)2 (гашене вапно) одержують хлорне вапно:
2Cl2+ 2Са(ОН)2 = Са(ClO)2 + СаCl2 + 2H2O.
Хлорне вапно можна розглядати як змішану сіль хлоридної та гіпохлоритної кислот Cl–O–Са–Cl.
Дезинфікуюча і відбілююча дія жавелевої води та хлорного вапна зумовлена наявністю атомарного кисню, який утворюється за реакцією:
3КClO + H2O + СО2 = К2СО3 + КClO + 2НCl + 2О·.
У промисловості жавелеву воду одержують електролізом холодного розчину натрій хлориду:
NaCl + H2O ![]() NaClO + H2.
NaClO + H2.
При електролізі гарячого розчину NaCl утворюється натрій хлорат:
NaCl + 3H2O ![]() NaClO3 + 3H2.
NaClO3 + 3H2.
Хлорати лужних металів – сильні окисники. Суміші калій хлорату КClO3 (бертолетової солі) із сіркою або червоним фосфором (суміші Армстронга) від удару або тертя вибухають:
2КClO3 + 3S = 2KCl + 3SO2,
5КClO3 + 2P = 5KCl + P2O5.
Термічний розклад хлоратів може відбуватися за двома напрямками. За наявності каталізатора (манган (IV) оксид) утворюється відповідний хлорид та молекулярний кисень О2 (напрямок А), а за відсутності каталізатора – проходить реакція диспропорціювання (напрямок Б):
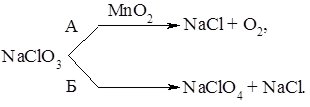
Хлорати використовують у виробництві сірників та вибухових речовин.
Перхлорати у промисловості добувають електролізом водних розчинів хлоратів:
КClO3 + Н2О ![]() КClO4 + Н2.
КClO4 + Н2.
Перхлорати – сильні окисники. У гарячих концентрованих розчинах миттєво реагують з органічними речовинами. В розбавлених розчинах за звичайних умов перхлорати стійкі.
Перхлорати використовують для добування прехлоратної кислоти НClO4:
КClO4 + Н2SO4 = НClO4 + KHSO4.
НClO4 використовують для кількісного визначення органічних речовин у неводних розчинах.
Іноді солі безоксигенових галогеноводневих кислот (MeHalx) називають солями типу А, а оксигеновмісних кислот (MeHalОx) – солями типу В.