16. ЕЛЕМЕНТИ VIIA ГРУПИ. ЗАГАЛЬНА ХАРАКТЕРИСТИКА ГАЛОГЕНІВ
16. ЕЛЕМЕНТИ VIIA ГРУПИ. ЗАГАЛЬНА ХАРАКТЕРИСТИКА ГАЛОГЕНІВ
16.3. Оксигеновмісні сполуки хлору
В усіх оксигеновмісних сполуках Хлор виявляє позитивні ступені окиснення (табл. 16.1).
Таблиця 16.1
Оксигеновмісні сполуки Хлору
|
Ступінь окиснення |
Оксид |
Кислота |
Аніон |
|
|||
|
формула |
систематична назва |
історична назва |
формула |
назва |
|||
|
+1 |
Cl2O |
HClO |
гіпохлоритна |
хлорнуватиста |
ClO– |
гіпохлорит |
|
|
Cl2O2 |
|||||||
|
+3 |
HClO2 |
хлоритна |
хлориста |
ClO2– |
хлорит |
||
|
Cl2O3 |
|||||||
|
Cl2O4 |
|||||||
|
+5 |
HClO3 |
хлоратна |
хлорнувата |
ClO3– |
хлорат |
||
|
Cl2O5 |
|||||||
|
Cl2O6 |
|||||||
|
+7 |
HClO4 |
перхлоратна |
хлорна |
ClO4– |
перхлорат |
||
|
Cl2O7 |
|||||||
Оксиди хлору – ангідриди відповідних кислот. Оксиди Cl2O2, Cl2O4, Cl2O6 при взаємодії з водою або лугами утворюють два аніони, за рахунок диспропорціювання:
Cl2O2 + 2KOH = KClO + KClO2 + H2О,
Cl2O4 + 2H2О = НClO2 + НClO3,
Cl2O6 + 2NaOH = NaClO3 + NaClO4 + H2О.
Оксиди ClO, Cl2O3, Cl2O5 та Cl2O7 при гідролізі утворюють лише один аніон.
Усі оксиди хлору – термодинамічно нестійкі речовини, при незначному струшуванні вибухають.
Сила оксокислот хлору та їх стійкість зростає зі збільшенням ступеня окиснення центрального атома. Окисна здатність кислот зменшується зі зростанням ступеня окиснення атома хлору. Перхлоратна кислота HClO4 – найсильніша і найстійкіша з усіх відомих кислот є найслабкішим окисником серед оксокислот хлору.
Гіпохлоритна кислота HClO є найсильнішим окисником, під дією світла розкладається:
HClO = HCl + O·,
утворений атомарний кисень зумовлює сильні окисні властивості.
Солі гіпохлоритної кислоти утворюються при дії вільного хлору на розчини лугів при охолодженні:
Cl2 + КОН = КClO + КCl + H2O.
Утворений розчин хлориду та гіпохлориту калію (або натрію) називають “жавелева вода”.
Дією хлору на сухий кальцій гідроксид Са(ОН)2 (гашене вапно) одержують хлорне вапно:
2Cl2+ 2Са(ОН)2 = Са(ClO)2 + СаCl2 + 2H2O.
Хлорне вапно можна розглядати як змішану сіль хлоридної та гіпохлоритної кислот Cl–O–Са–Cl.
Дезинфікуюча і відбілююча дія жавелевої води та хлорного вапна зумовлена наявністю атомарного кисню, який утворюється за реакцією:
3КClO + H2O + СО2 = К2СО3 + КClO + 2НCl + 2О·.
У промисловості жавелеву воду одержують електролізом холодного розчину натрій хлориду:
NaCl + H2O ![]() NaClO + H2.
NaClO + H2.
При електролізі гарячого розчину NaCl утворюється натрій хлорат:
NaCl + 3H2O ![]() NaClO3 + 3H2.
NaClO3 + 3H2.
Хлорати лужних металів – сильні окисники. Суміші калій хлорату КClO3 (бертолетової солі) із сіркою або червоним фосфором (суміші Армстронга) від удару або тертя вибухають:
2КClO3 + 3S = 2KCl + 3SO2,
5КClO3 + 2P = 5KCl + P2O5.
Термічний розклад хлоратів може відбуватися за двома напрямками. За наявності каталізатора (манган (IV) оксид) утворюється відповідний хлорид та молекулярний кисень О2 (напрямок А), а за відсутності каталізатора – проходить реакція диспропорціювання (напрямок Б):
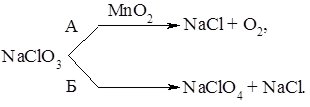
Хлорати використовують у виробництві сірників та вибухових речовин.
Перхлорати у промисловості добувають електролізом водних розчинів хлоратів:
КClO3 + Н2О ![]() КClO4 + Н2.
КClO4 + Н2.
Перхлорати – сильні окисники. У гарячих концентрованих розчинах миттєво реагують з органічними речовинами. В розбавлених розчинах за звичайних умов перхлорати стійкі.
Перхлорати використовують для добування прехлоратної кислоти НClO4:
КClO4 + Н2SO4 = НClO4 + KHSO4.
НClO4 використовують для кількісного визначення органічних речовин у неводних розчинах.
Іноді солі безоксигенових галогеноводневих кислот (MeHalx) називають солями типу А, а оксигеновмісних кислот (MeHalОx) – солями типу В.