17. ЕЛЕМЕНТИ VIА ГРУПИ. ЗАГАЛЬНА ХАРАКТЕРИСТИКА ХАЛЬКОГЕНІВ
17. ЕЛЕМЕНТИ VIА ГРУПИ. ЗАГАЛЬНА ХАРАКТЕРИСТИКА ХАЛЬКОГЕНІВ
| Сайт: | Підготовка до ЗНО - Освітній портал "Академія" |
| Курс: | Підготовка до ЗНО з хімії |
| Книга: | 17. ЕЛЕМЕНТИ VIА ГРУПИ. ЗАГАЛЬНА ХАРАКТЕРИСТИКА ХАЛЬКОГЕНІВ |
| Надруковано: | Гість |
| Дата: | Sunday 25 May 2025 4:59 AM |
17. ЕЛЕМЕНТИ VIА ГРУПИ. ЗАГАЛЬНА ХАРАКТЕРИСТИКА ХАЛЬКОГЕНІВ
До халькогенів (гр. халькогени – “утворенні міддю”) відносять елементи, розміщені у VIA підгрупі Періодичної системи: Оксиген O, Сульфур S, Селен Se, Телур Te, Полоній Ро. На зовнішньому електронному рівні атомів халькогенів є 6 електронів, електронна конфігурація його ns2np4. Це – p-елементи.
Усі халькогени (крім Оксигену) мають на зовнішньому електронному рівні вільні d-орбіталі, на які під час збудження атомів можуть переходити розпаровані електрони s- і p-орбіталей зовнішнього електронного рівня.
Халькогени – неметали (крім Полонію), у вільному стані утворюють молекули з ковалентним неполярним зв’язком. За рахунок малої енергії зв’язку халькогени хімічно активні.
У підгрупі халькогенів зверху вниз:
- зростає атомний радіус;
- зменшується енергія іонізації і спорідненість до електрона;
- зменшуються неметалічні і зростають металічні властивості;
- у ряду H2O – H2S – H2Se – H2Te зростають кислотні і відновні властивості.
Гідриди, оксиди та їх гідрати (крім Оксигену та Полонію) виявляють кислотні властивості. Сполуки цих елементів (крім Оксигену) з лужними і лужноземельними металами є солями. Гідриди елементів VIА підгрупи – відновники. Оксиди елементів у вищих ступенях окиснення – окисники. Найпоширенішим в природі є Оксиген.
17.1. Оксиген. Кисень. Озон
Оксиген – типовий елемент VIА підгрупи ІІ періоду. На зовнішньому електронному рівні міститься 6 електронів (2s22p4). Висока спорідненість до електрона і неможливість переходу у збуджений стан зумовлює високу хімічну активність кисню, як неметалу. За електронегативністю Оксиген поступається лише Флуору (3,5 і 4,0 відповідно).
Будова зовнішнього електронного рівня атома Оксигену:
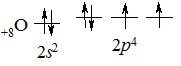
Найпоширеніші ступені окиснення Оксигену –2, –1, 0. За рахунок двох неспарених електронів, Оксиген найчастіше виявляє ступінь окиснення –2 і лише у сполуках з Флуором +2 (оксиген фторид ОF2). Існують сполуки, у яких Оксиген виявляє ступінь окиснення –1 (пероксиди H2O2, Na2O2, BaO2). У пероксидах існує зв’язок між атомами Оксигену О–О. Гідроген пероксид – кислота, пероксиди – солі.
Проста речовина Оксигену – кисень – двоатомна молекула О2, у якій атоми зв’язані ковалентним неполярним зв’язком.
Оксиген вперше добув Дж. Прістлі (Англія) у XVIII ст. термічним розкладом HgO. Назву Оксиген (гр. oxy genes – кислоти утворює) запропонував А. Лавуазьє.
Природні сполуки Оксигену.
Оксиген – найпоширеніший елемент на Землі, масова частка – 47,2%, атомна – 58%. Основна маса Оксигену міститься в повітрі (табл. 17.1).
Вода містить 89% Оксигену. Він також входить до складу оксидів, багатьох солей, рослинних і тваринних організмів.
Одержання кисню у лабораторії.
1. Термічний розклад сполук з високим вмістом Оксигену (KMnO4, KClO3, NaNO3, HgO):
2KMnO4 = O2 + K2MnO4 + MnO2, 2KClO3![]() 2KCl + 3O2,
2KCl + 3O2,
2NaNO3 = 2NaNO2 + O2, 2HgO = 2Hg + O2.
2. З пероксидів:
BaO2 + CO2 = BaCO3 + O2, Na2O2 + H2O = 2NaOH + O2.
3. Електролізом води, підкисленої сульфатною кислотою для збільшення електропровідності:
2H2O ![]() 2Н2 + О2.
2Н2 + О2.
Вперше електроліз води провели У. Ніколсон та Е. Карслайл (Англія) у XIX ст.
Одержання кисню у промисловості.
У промисловості кисень одержують електролізом води та багатоступеневою перегонкою рідкого повітря. Останній спосіб базується на різниці температур кипіння його компонентів.
В природі кисень утворюється шляхом фотосинтезу у зелених рослинах за схемою:
6СО2 + 6Н2О ![]() С6Н12О6 + 6О2.
С6Н12О6 + 6О2.
Фізичні властивості.
За н.у. кисень – безбарвний газ, без запаху і смаку, погано розчинний у воді (масова частка О2 0,004%). Температура плавлення –219,0 0С, температура кипіння –183,0 0С. Рідкий кисень блакитного кольору. Рідкий кисень вперше добув Дж. Дьюар у 90-х рр. XIX ст., і зберігав його у спеціальній посудині з подвійними посрібленими стінками, між якими було викачане повітря – посудині Дюара. Сучасний побутовий термос – це посудина Дьюара з пробкою.
Хімічні властивості.
Кисень – сильний окисник, сильніший від нього лише фтор. Безпосередньо кисень реагує з:
І. Простими речовинами.
Реакція взаємодії кисню з речовинами, що супроводжується значним виділенням тепла і світла називається горінням. Механізм процесу горіння встановив А. Лавуаз’є (Франція, 1774).
1. Неметалами (крім галогенів) з утворенням ангідридів відповідних кислот:
S + O2 = SO2, 4P + 5O2 = 2P2O5,
або індиферентних оксидів:
2С + O2 = 2СO.
2. Металами (крім золота та платинових металів) з утворенням оксидів:
5O2 + 2Ca = 2CaO, 3O2 + 2Al = 2Al2O3, 3O2 +2Fe = Fe2O3.
З лужних металів з киснем лише літій утворює оксид:
O2 + 4Li = 2Li2O,
а решта – пероксиди (Na2O2) або надпероксиди (супероксиди) (КО2):
О2 + 2Na = Na2O2, О2 + К = КО2.
Оксиди галогенів, золота, благородних металів одержують непрямим шляхом.
ІІ. Складними речовинами.
1. Оксидами елементів у нижчих ступенях окиснення:
2CО + О2 = 2СО2, 2SО2 + О2 = 2SО3.
2. Гідридами неметалів:
4NH3 + 5O2 ![]() 4NO + 6H2O,
4NO + 6H2O,
4NH3 + 3O2 = 2N2 + 6H2O, 2H2S + 3O2 = 2SO2 + 2H2O.
3. Сульфідами:
2ZnS + 3O2 = 2ZnO + 2SO2, 4FeS2 + 11O2 = 2Fe2O3 + 8SO2.
4. Органічними речовинами:
СH4 + 2O2 = CO2 + 2H2O.
Застосування кисню.
Кисень відіграє велику роль у життєдіяльності людини. Він підтримує процеси дихання та горіння. На підводних човнах і космічних кораблях кисень використовують для життєзабезпечення людей, у медицині – для полегшення дихання хворих.
У промисловості кисень застосовують для випалювання руд металів при одержанні чавуну і сталі. Кисень застосовують як окисник органічних речовин, у виробництві нітратної кислоти з амоніаку та сульфатної кислоти з піриту тощо.
При горінні багатьох газів (Н2, С2Н2) виділяється багато теплоти, що використовують для зварювання і різання металів.
Озон
Озон відкрив швейцарський хімік Х. Шенбайн (1799 – 1868 рр.).
Будову молекули озону можна представити формулою:
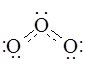
Ступінь окиснення Оксигену в озоні +4 та –2 (О+4О–22).
Одержують озон в озонаторах дією електричного струму, робота їх базується на реакції:
3О2 ↔ 2О3.
Вихід озону – 10%.
В атмосфері озон утворюється з кисню під час грози, на висоті 20 – 30 км під дією УФ-світла. При повільному окисненні смоли хвойних дерев утворюється озон, тому в хвойних лісах, як і під час грози, відчувається запах озону. На висоті 25 – 28 км над Землею розміщений озоновий шар товщиною до 5 км, що захищає планету від УФ-опромінення сонця і затримує ІЧ-промені від Землі, запобігаючи її охолодженню.
Озон утворюється при роботі копіювальних приладів (“ксероксів”) і при тривалому вдиханні порушує репродуктивну функцію чоловіків.
Озон – важкий газ, синього кольору (температура кипіння –110 0С) з різким запахом, у високій концентрації – отруйний.
Озон – сильний окисник за рахунок утворення при розкладі атомарного кисню:
О3 = О2 + О·; 2О· = О2,
окиснює навіть срібло, золото і платинові метали з утворенням пероксидів:
2Ag + 3O2 = Ag2O2 + 2O2.
З лужними металами утворює яскраво забарвлені озоніди:
К + О3 = КО3.
Якісною реакцією на О3 є взаємодія з розчинами йодидів:
2КІ + О3 + Н2О = 2КОН + І2 +О2.
За рахунок виділення молекулярного йоду, розчин забарвлюється у бурий колір.
Озон використовують для відбілювання матеріалів, дезинфекції води та повітря, очистки димових газів і стічних вод.
17.2. Повітря
Атмосферне повітря - суміш газів (табл. 17.1).
Таблиця 17.1
Склад повітря
|
Складова частина |
Вміст |
|
|
за об’ємом, φ, % |
за масою, ω, % |
|
|
Азот |
78,0 |
75,3 |
|
Кисень |
20,6 |
23,1 |
|
Благородні гази |
0,7 |
1,2 |
|
Інші компоненти |
0,7 |
0,4 |
Крім перелічених компонентів у повітрі містяться пари води та механічні домішки. Азот, кисень і благородні гази називають постійними компонентами повітря, основний їх вміст практично завжди сталий. Вміст інших компонентів може змінюватись, залежно від умов.
У забрудненому повітрі можуть міститись H2S, NH3, SO2, N2Ox, що утворюються при хімічному виробництві. Для запобігання попадання цих речовин на хімічних заводах встановлюють газоуловлювачі, які нейтралізують шкідливі викиди.
17.3. Вода
Вода – найпоширеніша хімічна сполука. Це гідроген оксид – Н2О.
Будова молекули.
У молекулі води атоми Гідрогену та Оксигену з’єднані ковалентним полярним зв’язком. Валентний кут » 104,50С, що свідчить про sp3-гібридизацію атомних орбіталей Оксигену і утворення міцних зв’язків з атомами Гідрогену.
Таким чином молекула води – кутова полярна (рис. 17.1). На атомі Оксигену виникає частковий негативний заряд, на атомах Гідрогену – позитивний.
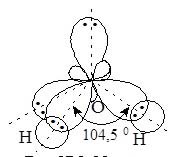
Рис. 17.1. Молекула води
У воді розчиняється багато речовин, при цьому деякі з них дисоціюють на іони. Виходячи з будови молекули – вода сильно полярний розчинник. Є розчинники полярніші за воду: HF, H2SO4, H2O2, HCN, N,N-диметилформамід (ДМФА) (CH3)2NCOH, ацетон CH3COCH3. Усі вони крім двох останніх є високореакційноздотними і тому їх широко не використовують. Вода за фізико-хімічними властивостями є унікальним розчинником.
У твердому стані (лід) вода має тетраедричну структуру – кожна молекула води з’єднана водневими зв’язками з чотирма іншими (рис. 17.2).
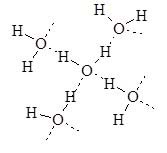
Рис. 17.2. Структура льоду.
Оксид дейтерію D2O (важка вода) міститься у незначній кількості у природній воді. Виділяють D2O виморожуванням води (т. пл. D2O 3,81 0С, т. кип. 101,43 0С). Густина важкої води вища від густини звичайної.
Фізичні властивості.
За н. у. вода – безбарвна рідина без смаку і запаху. Т. пл. води 0 0С або 273 К, Т. кип. 100 0С або 373 К. Густина льоду 0,916 г/см3, густина води при 0 0С 0,999 г/см3, при 4 0С 1,000 г/см3. За рахунок цього, водойми взимку не промерзають до дна.
У ряду гідридів елементів VIA групи H2O – H2S – H2Se – H2Te, вода має аномально високі температури кипіння і плавлення за рахунок утворення водневих зв’язків (див. Водневий зв’язок) і є добрим розчинником.
У воді розчиняються гази, які вступають у хімічну взаємодію з нею (амоніак NH3, ангідриди кислот) (див. Розчини), електроліти (солі, кислоти, луги), органічні сполуки з полярними групами (-OH, -COOH, -NH2).
Поширення у природі.
Поверхня Землі на 4/5 вкрита шаром води; маса води становить 1018 т. Це єдина речовина, яка в природі існує одночасно в твердому (лід), рідкому і газоподібному (пара) стані. 2/3 людського тіла складає вода, багато продуктів містять велику кількість води (табл. 17.2).
Таблиця 17.2
Вміст води у деяких продуктах
|
Продукт |
Вміст води, % |
|
Томати |
95 |
|
Молоко |
87 |
|
Яблука |
84 |
|
Риба |
82 |
|
Картопля |
76 |
|
Яйця |
75 |
|
М’ясо (яловичина) |
64 |
Хімічні властивості.
1. Електролітична дисоціація:
Н2О + Н2О ↔ Н3О+ + ОН–
Н2О – амфоліт, оскільки при дисоціації утворює іони Н3О і ОН– (див. Електролітична дисоціація).
2. Гідратація – приєднання молекул води до речовин з утворенням гідратів. Гідрати утворюють практично усі речовини. Благородні гази (крім гелію) утворюють кріогідрати складу Е∙6Н2О, які називають сполуками вкорінення або клатратами.
Гідрати основних оксидів – основи (NaOH, Ca(OH)2).
Гідрати кислотних оксидів – кислоти (HNO3, H2SO4, H3PO4).
Усі іони в розчинах існують у гідратованому стані: Н+ у формі H3O+, Cu2+ – [Cu(H2O)5]2+ тощо.
При випаровуванні розчинів солей утворюються тверді кристалогідрати: FeSO4∙7H2O, CuSO4∙5H2O, Na2SO4∙10H2O, тощо (див. Кристалогідрати).
Взаємодією органічних речовин з водою добувають спирти, кетони:
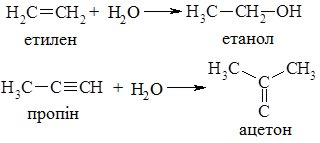
3. Гідроліз – реакція обмінного розкладу речовини з водою. Гідролізу піддаються галогени (крім F2, який розкладає воду):
Cl2 + H2O = HCl + HClO,
8F2+ 14H2O = 14HF + H2O2 + O2 + O3 + OF2,
галогенангідриди (див. Добування кислот):
PCl3+ 3H2O = 3HCl + H3PO4,
солі (див. Гідроліз солей).
Гідроліз органічних сполук розглянуто у розд. Органічна хімія.
4. Взаємодія з металами. Безпосередньо вода реагує лише з металами ІА та ІІА підгруп:
2Na + 2H2O = 2NaOH + H2,
за високих температур – з рештою (крім благородних):
3Fe + 4H2O = Fe3O4 + 4H2,
5. З неметалами за високих температур:
C + H2O = CO + H2,
2P + 8H2O = 2H3PO4 + 5H2.
6. Зі складними речовинами:
NaH + H2O = NaOH + H2, 2BaO2 + 2H2O =2Ba(OH)2 + O2,
CO + H2O = CO2 + H2, CH4 + H2O = CO + 3H2
Останню реакцію – конверсію метану – використовують у промисловості для одержання водяного газу (суміші СО + Н2).
Використання води.
Велика кількість води використовується у побуті: життєдіяльність людини, приготування їжі, прання, тощо.
У промисловості воду використовують як розчинник, реагент, охолоджувач, теплоносій в електростанціях, при виробництві ліків.
Щорічно у світі використовується на різні потреби 2500 – 3000 км3 прісної води.
Забруднення та очистка води.
З усієї маси води на Землі, прісної лише 3%, з них 80% знаходиться на полюсах у формі льоду.
Використання прісної води є багаторазове і безповоротне. Судноплавство, риборозведення, гідроелектроенергетика – багаторазове. Безповоротно використаною є вода, непридатна для повторного використання. Сюди входить вода, яка випарувалась, хімічно зв’язана і змішана з солоною. Прісну воду добувають із солоної шляхом опріснення останньої. Найчастіше вода забруднена твердими відходами, хімічними речовинами (мінеральні добрива, пестициди), мікроорганізмами, радіоактивними речовинами.
Для повернення забрудненої води у використання її очищають фізичними та хімічними методами.
Основними фізичними методами очистки води є:
зрешечування – видалення з води твердих матеріалів шляхом пропускання через систему сит з різним діаметром отворів;
аерування – пропускання через воду повітря для видалення розчинених газів і очищення від деяких домішок;
флокуляція – збовтування води з флокулянтами (H2SiO3) для укрупнення дрібних завислих частинок у більші, які швидше осідають на дно;
флотація – спливання на поверхню частинок, утворених при флокуляції;
седиментація – видалення осілих при флокуляції частинок;
фільтрування – пропускання води через пісок, змішаний з деревним вугіллям для видалення дрібного завислого матеріалу.
Найпоширенішими хімічними методами очистки води є:
коагуляція – видалення з води колоїдних частинок введенням коагулянтів (Al2(SO4)3, Na3[Al(OH)6]);
дезинфекція – обробка води хлором або озоном для знищення мікроорганізмів;
пом’якшення – усунення твердості води, зумовленої наявністю гідрогенкарбонатів кальцію та магнію Ca(HCO3)2 і Mg(HCO3)2, додаванням Ca(OH)2 або Na2CO3;
адсорбція – поглинання органічних сполук з води активованим вугіллям;
окиснення – переведення токсичних речовин в нешкідливі шляхом окисненням озоном: NaCN + O3 = NaCNО + O2.
Дистиляція – випаровування і конденсація води в дистиляторах. При цьому утворюється обезсолена вода. Цим способом опріснюють морську воду.
Очистка стічних вод має поєднуватись із економним використанням води, впровадженням технологій багаторазового застосування та зменшенням забруднення води.
В основі безвідходних виробництв лежить багаторазове використання води в замкнутому циклі з очисними спорудами.
Кругообіг води в природі.
Щорічно в кругообіг води у результаті випаровування і випадання у формі дощу і снігу задіяно понад 500000 км3 води (рис. 17.3). За теоретичними підрахунками максимальна кількість прісної води, доступної для використання становить майже 40000 км3 за рік.
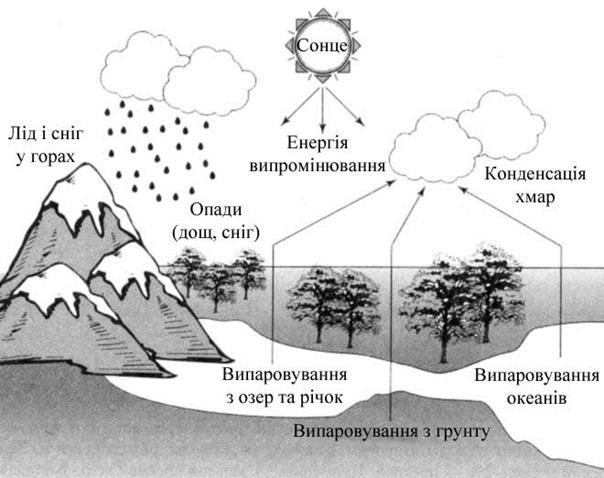
Рис. 17.3. Кругообіг води в природі
17.4. Гідроген пероксид. Пероксиди
Ще однією сполукою Оксигену з Гідрогеном є гідроген пероксид (перекис водню), у якому ступінь окиснення Оксигену становить –1. Атоми Гідрогену в молекулі Н2О2 лежать у двох площинах, атоми Оксигену зв’язані σ-зв’язком (рис. 17.4). Молекула гідроген пероксиду сильно полярна, що веде до утворення водневих зв’язків.
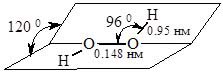
Рис. 17.4. Молекула гідроген пероксиду
Фізичні властивості.
За н. у. гідроген пероксид – безбарвна рідина з характерним запахом. Густина 1,04 г/см3, температура кипіння 152 0С. Необмежено розчинний у воді з утворенням стійких розчинів, однак при нагріванні або дії світла гідроген пероксид розкладається.
У лабораторії H2O2 одержують дією сульфатної кислоти на твердий барій пероксид BaO2:
BaO2 + H2SO4= H2O2 +BaSO4↓.
У промисловості H2O2 одержують анодним окисненням сульфатної кислоти з подальшим гідролізом утвореного продукту:
2H2SO4 – 2е = H2S2O8 + 2Н+,
H2S2O8 + 2Н2О = 2H2SO4 + H2O2.
Хімічні властивості.
1. Зв’язок О–О слабкий, при кімнатній температурі гідроген пероксид розкладається за реакцією диспропорціювання:
2H2O2 = 2H2O + O2.
Реакцію прискорює каталітична кількість MnO2.
2. Кислотні властивості:
2H2O2 = 2H+ + O22–.
- Реагує з основами з утворенням пероксидів:
H2O2 + Ba(OH)2 = 2H2O +BaO2↓.
4. Відновні властивості:
H2O2 + Ag2O = H2O + O2 + 2Ag.
5. Окисні властивості:
H2O2 + NaNO2 = H2O + KNO3, 4H2O2 + PbS = 4H2O + PbSO4.
Останню реакцію використовують для реставрації написаних масляними фарбами почорнілих картин (відновлення чорного PbS до білого PbSO4).
Використовують H2O2 для відбілювання тканин, хутра, паперу, дезинфекції (30% водний розчин – пергідроль), або 3% розчин як дезинфікуючий засіб у медицині.
17.5. Сульфур. Сірка
Будова атома.
На зовнішньому енергетичному рівні атома Сульфуру є незаповнений 3d-підрівень і внаслідок збудження атома розпаровані електрони можуть переходити на нього:
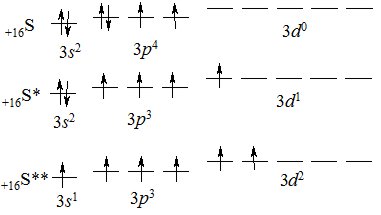
Згідно з кількістю неспарених електронів, атом Сульфуру може виявляти ступені окиснення –2, 0, +4, +6.
Будова речовини.
Сірка має кілька алотропних модифікацій. Найважливішими і найстійкішими є α-сірка (ромбічна) і β-сірка (моноклинна). Вони відрізняються формою кристалів і фізичними властивостями. α- і β-модифікації сірки побудовані з молекул S8 (рис. 17.5).
![]()
Рис. 17.5. Форма молекули S8.
При швидкому охолодженні розплавленої сірки утворюється нестійка пластична сірка, яка складається з полімерних молекул Sх. В парах сірки існують молекули S8, S6, S4, S2 та вільні атоми S.
Фізичні властивості.
Сірка – тверда речовина жовтого кольору. Ромбічна сірка плавиться при 112,80С, моноклинна – при 119,30С. Густина їх – 2,07 г/см3 та 1,96 г/см3 відповідно. Сірка нерозчинна у воді, добре розчинна у сірковуглеці CS2, бензені C6H6 та інших органічних розчинниках.
Добування.
У природі сірка знаходиться у самородному стані та у формі сполук: FeS2 – пірит, FeS – залізний колчедан, ZnS – цинкова обманка, CaSO4 – гіпс тощо.
У лабораторії сірку можна одержати:
1. при неповному згорянні H2S:
2H2S + O2 = 2S + 2H2O,
2. дією сульфатної кислоти на тіосульфати:
Na2S2O3 + H2SO4 = Na2SO4 + H2O + SO2↑ + S↓
У промисловості сірку добувають методом Фраша – розплавляючи підземні поклади сірки перегрітою водяною парою з подальшою очисткою одержаного продукту – технічної сірки. Таким способом видобувають сірку в Україні, біля м. Новояворівськ (Львівська обл.).
Хімічні властивості.
У формі простої речовини сірка може бути окисником (відновлюватись до ступеня окиснення –2) або відновником (окиснюватись до ступенів окиснення +4 і +6). Сірка не реагує лише з азотом та благородними металами.
Окисні властивості.
1. З металами реагує при нагріванні, з утворенням сульфідів:
2Na + S = Na2S, Fe + S = FeS.
З ртуттю реакція іде за н. у.:
Hg + S = HgS,
що використовують для знешкодження розлитої ртуті (демеркуризації).
2. З неметалами:
S + H2 = H2S 2S + C ![]() CS2, 5S + 2P = P2S5.
CS2, 5S + 2P = P2S5.
Тіоангідрид фосфатної кислоти P2S5 використовують для добування кислот, з лугами він утворює солі.
3. З лугами при нагріванні (реакція диспропорціювання):
3S + 6NaOH = 2Na2S + Na2SO3 + 3H2O.
Відновні властивості.
1. З киснем:
S +O2 = SO2.
2. З галогенами (з F2 за н. у., з Cl2 при нагріванні):
S +2F2 = SF4, 2S +Cl2 = S2Cl2.
3. З розбавленою нітратною кислотою:
3S + 4HNO3 = 3SO2 + 4NO + 2H2O, S + 2HNO3 = H2SO4 + 2NO.
4. З концентрованими нітратною та сульфатною кислотами:
S + 6HNO3 = H2SO4 + 6NO + 2H2O, S + 2H2SO4 = SO2 + 2H2O.
Використання.
Сірку використовують для одержання сульфур (IV) оксиду SO2 (проміжного продукту у виробництві сульфатної кислоти), сульфатної кислоти H2SO4, гідроген сульфіду Н2S, сірковуглецю CS2 – поширеного розчинника. Застосовують при вулканізації гуми, одержанні проміжних продуктів у виробництві синтетичних миючих засобів, пороху, косметичних кремів та ліків, засобів захисту рослин.
17.6. Гідроген сульфід. Сульфіди
Будова молекули.
Молекулярна формула гідроген сульфіду (сірководню) – H2S. Зв’язок S–H ковалентний полярний, молекула кутова, валентний кут HSH = 920. У гідроген сульфіді та у сульфідах окиснення атом S виявляє найнижчий можливий ступінь окиснення –2.
Одержання.
1. Взаємодією простих речовин:
H2 + S = H2S.
2. Дією кислот на сульфіди:
FeSтв. + 2HClконц. = H2S + FeCl2.
3. Дією води на сульфіди амфотерних гідроксидів (Cr2S3, Al2S3):
Al2S3(тв.) + 6H2O = 2Al(OH)3 + 3H2S.
Цим способом одержують дуже чистий гідроген сульфід.
У природі гідроген сульфід утворюється при гнитті органічних решток.
Фізичні властивості.
Гідроген сульфід – безбарвний газ із запахом тухлих яєць, важчий за повітря, т кип. –60,3 0С, т. пл. –85,6 0С.
При 20 0С в 1 л води розчиняється 2,5 л гідроген сульфіду – утворюється сірководнева вода (масова частка гідроген сульфіду 0,36%).
Гідроген сульфід – отруйний газ, тривале вдихання його може призвести до смерті.
Хімічні властивості.
1. На повітрі горить блакитним полум’ям:
2H2S + 3O2 = 2SO2 + 2H2O.
При нестачі кисню відбувається неповне окиснення:
2H2S + O2 = 2S + 2H2O.
2. У водному розчині гідроген сульфід реагує з окисниками, відновлюючись при цьому до сполук сульфуру з різними ступенями окиснення (0, +4, +6):
H2S + I2 = S + 2HI, H2S + 2HNO3(розб.) = SO2 + 2NO + 2H2O,
3H2S + 8HNO3(конц.) = 3H2SO4 + 8NO + 4H2O.
У кислих розчинах калій перманганату KMnO4 та калій дихромату K2Cr2O7 гідроген сульфід окиснюється до вільної сірки:
3H2S + K2Cr2O7 + 4H2SO4 = 3S + Cr2(SO4)3 + K2SO4 + 7H2O.
3. У водному розчині гідроген сульфід є слабкою двоосновною кислотою і дисоціює за двома ступенями:
І ступінь: H2S ↔ H+ + HS–,
ІІ ступінь: HS– ↔ H+ + S2–.
За ІІ ступенем дисоціація відбувається незначною мірою.
1. Реагує з лугами, утворюючи солі. Середні солі – сульфіди, кислі – гідроген сульфіди (утворюються при надлишку H2S):
2NaOH + H2S = Na2S + 2H2O, KOH + H2S = KHS + H2O,
Na2S+ H2S= 2NaHS.
2. Нерозчинні у воді сульфіди утворюються в реакціях гідроген сульфіду із солями відповідних металів:
Pb(NO3)2 + H2S = PbS↓ + 2HNO3.
У результаті утворюється чорний осад PbS, нерозчинний у розбавлених кислотах – якісна реакція на іони S2–.
Сульфіди різноманітно забарвлені: сульфіди лужних металів – білого кольору, PbS – чорний, MnS – тілесний, CuS – коричнево-металевий.
У воді розчинні сульфіди лужних, лужно-земельних металів та амоніаку. Решта сульфідів нерозчинні у воді, а деякі (CuS, PbS, HgS, CdS) і у розбавлених розчинах мінеральних кислот (HCl, H2SO4).
У нітратній кислоті сульфіди важких металів розчиняються з утворенням сполук Сульфуру у вищих ступенях окиснення:
FeS–12 + 18HN+5O3(конц.) = Fe(NO3)3 + 2H2S+6O4 + 15N+4O2 +7H2O,
3Cu2S–2 + 22HN+5O3(розб.) = 6Сu(NO3)2 + 3H2S+6O4 + 10N+2O +8H2O.
Водні розчини сульфідів лужних металів, за рахунок гідролізу створюють лужне середовище (рН > 7):
Na2S + H2O ↔ 2NaOH + H2S.
Застосування.
Гідроген сульфід і сульфіди застосовують в якісному аналізі при розділенні сумішей аніонів та катіонів за сульфідним методом, який базується на різній розчинності сульфідів у воді, водних розчинах амоніак сульфіду та кислотах.
17.7. Оксиди сульфуру (IV) та сульфуру (VI)
Сульфур утворює два оксиди: SO2 (ступінь окиснення Сульфуру +4) та SO3 (+6). Молекула SO2 – кутова (а), SO3 – трикутна (б):
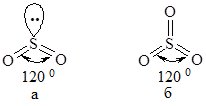
Інші назви SO2 – сульфур діоксид, сірчистий газ, сульфітний ангідрид; SO3 – сульфур триоксид, сульфатний ангідрид.
Одержання.
У лабораторії сульфур діоксид одержують:
1. Дією розбавленої хлоридної або сульфатної кислот на сульфіти чи гідрогенсульфіти лужно-земельних металів:
2KHSO3 + H2SO4 = 2SO2 + K2SO4 + 2H2O.
2. Реакцією міді з концентрованою сульфатною кислотою при нагріванні:
Cu + 2H2SO4 = SO2 + CuSO4 + H2O.
У промисловості сульфур діоксид одержують випалюванням сульфідів:
4FeS2 + 11O2 = 8SO2 + 2Fe2O3, 2PbS + 3O2 = 2SO2 + 2PbO.
Сульфур триоксид у промисловості одержують спалюванням сульфур діоксиду у присутності V2O5:
2SO2 + O2 ![]() 2SO3.
2SO3.
Фізичні властивості.
Сульфур (IV) оксид – безбарвний газ, з різким запахом, при 10 0С зріджується.
Сульфур (VI) оксид – безбарвна рідина, при 44,7 0С переходить у газ. При температурі нижче 17 0С кристалізується.
Хімічні властивості.
Оксиди сульфуру (IV) та (VI) – кислотні оксиди, виявляють усі характерні властивості класу.
1. Взаємодіють з основними оксидами з утворенням солей – сульфітів та сульфатів відповідно:
СаO + SO2 = СаSO3, K2O + SO3 = K2SO4.
2. Реагують з лугами з утворенням відповідних солей
Ba(OH)2 + SO2 = BaSO3 + 2H2O, NaOH + SO3 = Na2SO4 + H2O.
3. Взаємодіють з водою з утворенням відповідно сульфітної H2SO3 та сульфатної кислот H2SO4:
SO2 + H2O = H2SO3, SO3 + H2O = H2SO4.
H2SO3 – слабка кислота, H2SO4 – сильна кислота.
Середні солі сульфітної кислоти – сульфіти (натрій сульфіт Na2SO3, кальцій сульфіт CaSO3), кислі – гідрогенсульфіти (калій гідрогенсульфіт KHSO3, амоніак гідрогенсульфіт NH4HSO3).
Сульфіти вступають в окисно-відновні реакції, окиснюючись до сульфатів:
3Na2SO3 + K2Cr2O7 + 4H2SO4 = 3Na2SO4 + Cr2(SO4)3 + K2SO4 + 4H2O.
4. Сульфур (IV) оксид може виступати відновником у реакціях з окисниками:
2SO2 + O2 = 2SO3,
5SO2 + 2KMnO4 + 2H2O = 2H2SO4 + 2MnSO4 + K2SO4.
5. Менш характерними для сульфур (IV) оксиду є окисні властивості:
2H2S + SO2 = 2H2O + 3S.
6. Сульфур (VI) оксид – сильний окисник, відновляється до сульфур (IV) оксиду:
SO3 + 2HCl = Cl2 + SO2 + H2O
Використання.
Сульфур (IV) оксид використовують у виробництві сульфатної кислоти, для добування сульфур (VI) оксиду, відбілювання різних матеріалів, дезинфекції; обкурювання овочів у сховищах для запобігання їх псуванню.
Сульфур (VI) оксид використовують для добування сульфатної кислоти контактним способом.
17.8. Сульфатна кислота. Сульфати
Сульфатна кислота вперше описана у XIV ст. в Іспанії.
У сульфатній кислоті H2SO4, атом Cульфуру виявляє максимальний ступінь окиснення +6. Просторова структура H2SO4 – тетраедрична молекула (кут OSO = 120 0):
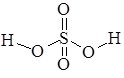
Старі назви сульфатної кислоти – сірчана кислота, купоросне масло.
Одержання.
У промисловості використовують контактний спосіб одержання сульфатної кислоти.
Раніше у промисловості використовували нітрозний спосіб:
SO2 + NO2 + H2O = H2SO4 + NO, NO + O2 = NO2.
Фізичні властивості.
Безводна сульфатна кислота – безбарвна масляниста рідина, при 10,3 0С кристалізується. Густина – 1,84 г/см3. Добре розчинна у воді (за рахунок хімічної взаємодії).
Хімічні властивості.
1. Концентрована H2SO4 – сильний окисник. При нагріванні реагує з усіма металами з утворенням сульфатів і різних продуктів відновлення сульфуру (H2S, S, SO2). Водень при цьому не утворюється:
4Mg + 5H2SO4 = 4MgSO4 + H2S + 4H2O,
3Zn + 4H2SO4 = 3ZnSO4 + S + 4H2O, Cu + 2H2SO4 = CuSO4 + SO2+ 2H2O.
Гідроген сульфід та сірка утворюються у реакціях з активними металами, а SO2 – з малоактивними.
Безводна сульфатна кислота не реагує із залізом внаслідок пасивації металу (утворюється FeSO4, який не розчиняється у сульфатній кислоті і перешкоджає подальшій реакції). Цю властивість використовують для перевезення концентрованої сульфатної кислоти у залізній тарі. Концентрована сульфатна кислота пасивує також Al, Ni, Cr, Ti.
2. Концентрована сульфатна кислота окиснює багато неметалів, відновлюючись при цьому до SO2:
S + 2H2SO4 = SO2 + 2H2O, C + 2H2SO4 = CO2 + SO2 + 2H2O
3. Окиснює броміди та йодиди до вільних галогенів:
8HI + H2SO4 =4I2 + H2S + 4H2O,
2KBr + 2H2SO4 = Br2 + SO2 + K2SO4 + 2H2O.
4. Взаємодія сульфатної кислоти з водою веде до утворення гідратів:
nH2O + H2SO4 = nH2O∙H2SO4.
Реакція супроводжується виділенням великої кількості теплоти. Для розбавлення сульфатної кислоти слід повільно приливати кислоту до води (а не навпаки), енергійно перемішуючи розчин для запобігання викидання кислоти з посудини.
5. Концентрована сульфатна кислота відбирає воду від органічних сполук:
C12H22O11 + H2SO4 = 12C + H2SO4∙11H2O,
2C2H5OH + H2SO4 = (C2H5)2O + H2SO4∙H2O
6. Безводна сульфатна кислота практично не дисоціює і є слабкою кислотою.
7. У водному розчині сульфатна кислота – сильна двоосновна кислота, виявляє усі характерні властивості кислот.
Розбавлена H2SO4 реагує з багатьма металами (крім Cu, Ag, Au, Pt), оксидами, основами, солями з утворенням солей – сульфатів (середніх Na2SO4) та гідрогенсульфатів (кислих KHSO4).
Сульфати добре розчинні у воді (крім CaSO4, BaSO4, SrSO4, PbSO4, Ag2SO4), виявляють типові властивості солей.
Реакція утворення нерозчинного у воді та у мінеральних кислотах BaSO4 широко використовується для виявлення катіонів Ba2+ та аніонів SO42– і є якісною на них.
Кристалогідрати сульфатів називають купоросами.
Сульфати термодинамічно стійкі, при нагріванні не розкладаються (крім FeSO4):
2FeSO4(тв.) ![]() Fe2O3 + SO3 + SO2.
Fe2O3 + SO3 + SO2.
Застосування.
Сульфатну кислоту використовують у виробництві мінеральних добрив, волокон, пластмас, барвників, вибухових речовин, як осушувач газів.
Широко застосовують сульфати.
Глауберова сіль (Na2SO4∙10H2O), мірабіліт (лат. sal mirabile – чудова сіль), яку вперше добув І. Глаубер у XVII ст., виявляє сильну послаблюючу дію.
Магній сульфат MgSO4∙7H2O використовують у медицині як антидот (протиотруту) при алкогольному сп’янінні під назвою “гірка сіль”.
Гіпс (CaSO4∙2H2O) використовують у будівництві, медицині. При прожарюванні гіпсу утворюється алебастр – важливий будівельний матеріал:
2CaSO4∙4H2O = 2CaSO4∙H2O + 3H2O.
Мідний (CuSO4∙5H2O) і залізний (FeSO4∙7H2O) купороси використовують у сільському господарстві для боротьби з шкідниками.
Подвійні сульфати (галуни) – алюмокалієвий галун KAl(SO4)2∙12H2O, залізоамонійний галун NH4Fe(SO4)2∙12H2O – використовують як дубильні речовини при обробці шкіри.
17.9. Промислове одержання сульфатної кислоти контактним способом
У промисловості сульфатну кислоту одержують окисненням сульфур оксиду (IV) до сульфур (VI) оксиду з наступною взаємодією його з водою.
Основними стадіями цього процесу є:
- добування сульфур (IV) оксиду;
- окиснення сульфур (IV) оксиду до сульфур (VI) оксиду;
- взаємодія Сульфур (VI) оксиду з водою.
Розглянемо кожну стадію.
1. Найчастіше сульфур (IV) оксид добувають при випалюванні піриту:
4FeS2 + 11O2 = 2Fe2O3 + 8SO2,
або халькопіриту:
4CuFeS2 + 13O2 = 4CuO + 2Fe2O3 + 8SO2,
у спеціальних печах. В піч знизу вдувають повітря для розпушення шару мінералу. Цей процес називають випалюванням у “киплячому шарі”. У результаті випалювання утворюється випалювальний газ, який крім SO2 містить О2, N2 та інші домішки. Вони отруюють каталізатор – погіршують його активність.
Одержаний газ очищають від домішок, пропускаючи через спеціальні фільтри, промивну і сушильну башти. Як осушувач використовують концентровану сульфатну кислоту.
Чистий сульфур (IV) оксид утворюється при спалюванні сірки:
S + O2 = SO2,
що дозволяє оминути стадію додаткової очистки.
2. Очищений сульфур (IV) оксид окиснюють до сульфур (VІ) оксиду контактним способом киснем повітря при 100 – 600 0С у присутності каталізаторів (V2O5 або Fe2O3):
2SO2 + O2 ↔ SO3.
Цей процес екзотермічний, виділена теплота іде на підігрів випалювального газу.
Зміщенню рівноваги вправо сприяє надлишок кисню і підвищення температури. Так, при 450 0С і надлишку кисню вихід сульфур (VI) оксиду становить 95 – 97%.
3. Одержаний сульфур (VI) оксид надходить у поглинальну башту, де зрошується концентрованою (98%) сульфатною кислотою. Утворюється олеум – розчин сульфур (VI) оксиду в сульфатній кислоті – H2SO4∙nSO3. Олеум розбавляють водою до необхідної концентрації.
Більшість сульфатної кислоти, яку випускає промисловість, має густину 1,82 – 1,84 г/см3 і масову частку H2SO4 91 – 94%.