18. ЕЛЕМЕНТИ VА ГРУПИ. ЗАГАЛЬНА ХАРАКТЕРИСТИКА
18. ЕЛЕМЕНТИ VА ПІДГРУПИ. ЗАГАЛЬНА ХАРАКТЕРИСТИКА
| Сайт: | Підготовка до ЗНО - Освітній портал "Академія" |
| Курс: | Підготовка до ЗНО з хімії |
| Книга: | 18. ЕЛЕМЕНТИ VА ГРУПИ. ЗАГАЛЬНА ХАРАКТЕРИСТИКА |
| Надруковано: | Гість |
| Дата: | Sunday 25 May 2025 5:08 AM |
18. ЕЛЕМЕНТИ VА ПІДГРУПИ. ЗАГАЛЬНА ХАРАКТЕРИСТИКА
До VА групи належать: Нітроген N, Фосфор P, Арсен As, Стибій Sb та Бісмут Bi.
На зовнішньому електронному рівні атоми елементів VА групи містять 5 електронів, будова зовнішнього електронного рівня ns2np3nd0, для них характерні основний і збуджений стани (крім Нітрогену, див. нижче).
У збудженому стані максимальна валентність елементів VА пгрупи становить 5 (крім Нітрогену).
У групі зверху вниз посилюються металічні властивості: Нітроген і Фосфор – типові неметали, Арсен і Стибій – виявляють деякі ознаки металів, Бісмут – типовий метал.
У сполуках з Гідрогеном внаслідок малої різниці електронегативностей зв’язок Е—Н малополярний, тому ці сполуки не виявляють кислотних властивостей.
Гідриди Нітрогену і Фосфору виявляють основні властивості за рахунок приєднання протона за донорно-акцепторним механізмом, гідриди інших елементів VA підгрупи цієї здатності не мають.
Вищі оксиди елементів VА підгрупи та їх гідрати мають виражені кислотні властивості, що зменшуються зі зростанням заряду ядра центрального атома.
18.1. Нітроген. Азот
Нітроген (лат. nitrogen – утворює селітру) – перший елемент VА групи Періодичної системи. На зовнішньому електронному рівні містить 5 електронів – 2s22p3:
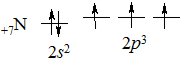
Завдяки наявності трьох неспарених р-електронів, атом Нітрогену може утворювати три ковалентні хімічні зв’язки за обмінним механізмом і ще один – за донорно-акцепторним, за рахунок неподіленої пари 2s-електронів. Тому максимальна валентність Нітрогену дорівнює 4. Ступені окиснення Нітрогену змінюються від –3 (приймає 3 електрони) до +5 (віддає 5 електронів).
Проста речовина – азот (гр. безжиттєвий) – двоатомний газ N2, атоми у молекулі якого сполучені трьома ковалентними неполярними зв’язками: N≡N. Завдяки такому зв’язку молекула азоту міцна і хімічно інертна. Механізм утворення ковалентного зв’язку у молекулі азоту розглянуто в розд. Ковалентний зв’язок.
Поширення у природі.
Основна маса азоту зосереджена в атмосферному повітрі (78% за об’ємом). У великій кількості зв’язаний азот міститься в чилійській селітрі NaNO3.
Зв’язаний азот міститься в усіх живих організмах у складі білків та нуклеїнових кислот.
Загальний вміст азоту в земній корі (включаючи атмосферу і гідросферу) становить 0,04% за масою.
Одержання.
У лабораторії азот одержують нагріванням амоній нітриту NH4NO2:
NH4NO2 = N2 + 2H2O,
або дією газоподібного амоніаку NH3 на розпечений CuO:
3CuO + 2NH3 = N2 + Cu + 3H2O.
У промисловості азот одержують з повітря шляхом глибокого охолодження і наступною фракційною перегонкою.
Фізичні властивості.
За н. у. азот – безбарвний газ без запаху і смаку, легший за повітря. При –195,8 0С зріджується. Малорозчинний у воді (при 20 0С у 100 г води розчиняється 15,4 мл азоту).
Хімічні властивості.
1. За звичайних умов азот реагує з літієм, а при нагріванні і з іншими металами, утворюючи нітриди:
6Li + N2 = 2Li3N, 3Mg + N2 = Mg3N2.
Нітриди – солеподібні сполуки, які можна розглядати як продукти повного заміщення атомів Гідрогену у молекулі амоніаку на атоми металу. При дії води нітриди розкладаються на гідроксид відповідного металу та амоніак:
AlN + 3H2O = Al(OH3)¯ + NH3.
2. При високій температурі і тиску азот сполучається з воднем з утворенням амоніаку:
N2 + 3H2 = 2NH3.
3. При температурі вищій 3000 0С або під дією електричного розряду азот реагує з киснем з утворенням NO:
N2 + O2 ↔ 2NO,
який на повітрі окиснюється до NO2:
2NO + O2 ↔ NO2.
Застосування.
Основну масу азоту використовують у промисловості для синтезу амоніаку за процесом Габера (див. Амоніак).
Азотом заповнюють електролампи, використовують для створення інертної атмосфери при зварювальних роботах. Рідкий азот використовують у холодильних установках для одержання низьких температур.
18.2. Амоніак. Солі амоніаку
Найважливішою сполукою Нітрогену з Гідрогеном є амоніак NH3. Молекула амоніаку – пірамідальна, полярна (рис. 14.1). Ступінь окиснення атома Нітрогену –3. Атомні орбіталі Нітрогену перебувають у стані sp3-гібридізації і утворюють три s-зв’язки з трьома атомами Гідрогену. Молекула амоніаку – яскраво виражений донор електронної пари, що дає можливість утворювати хімічні зв’язки за донорно-акцепторним механізмом.
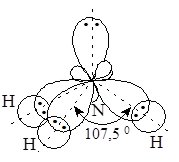
Рис. 14. 1. Молекула амоніаку.
Одержання.
У лабораторії амоніак одержують шляхом нагрівання хлориду амонію NH4Cl з гашеним вапном Ca(OH)2:
NH4Cl + Ca(OH)2 = 2NH3+ CaCl2 + 2H2O.
У промисловості раніше амоніак одержували ціаноамідним способом у дві стадії. На першій стадії проводили реакцію N2 з кальцій карбідом CaC2 при нагріванні:
CaC2 + N2 = CaCN2 + C.
Далі дією води на утворений продукт одержували амоніак:
CaCN2 + 3H2O = CaCO3 + 2NH3.
Сьогодні амоніак одержують виключно безпосередньою взаємодією простих речовин H2 і N2 при високій (5000С) температурі і тиску (30 мПа) за наявності каталізатора Fe/Al2O3:
N2 + 3H2 ↔ 2NH3, ΔH = –92 кДж.
Рівновага реакції зміщена ліворуч, тому з реакційної суміші при охолодженні виділяють амоніак, а азот і водень, що не прореагували вводять у наступний цикл. Описану технологію вперше застосував у 1908 р. Ф. Габер (Німеччина), тому її називають процес Габера.
Фізичні властивості.
За н. у. амоніак – безбарвний газ з різким запахом, легший за повітря. При –33,4 0С зріджується, а при –77,8 0С кристалізується.
Висока температура кипіння газоподібного амоніаку зумовлена утворенням міжмолекулярних водневих зв’язків.
Амоніак дуже добре розчинний у воді: в 1 об’ємі води розчиняється 700 об’ємів амоніаку. Максимальна масова частка амоніаку у воді – 25%. Такий розчин амоніаку називають аміачною водою, 10% розчин – нашатирний спирт. Зі зростанням температури розчинність амоніаку зменшується і він виділяється з розчинів.
Хімічні властивості.
1. Горить у кисні зеленим полум’ям:
4NH3 + 3O2 = 2N2 + 6H2O.
2. За наявності каталізаторів (Pt, Fe2O3) горить з утворенням NO:
4NH3 + 5O2 = 4NO + 6H2O.
Цю реакцію використовують у виробництві нітратної кислоти.
3. Реагує з окисниками:
2NH3 + 3CuO = N2 + 3Cu + 3H2O, 2NH3 + 3Br2 = N2 + 6HBr.
4. При пропусканні над розплавленими активними металами утворює аміди:
2NH3 + 2Na = 2NaNH2 + H2,
які при дії води розкладаються на луг і амоніак:
NaNH2 + H2O = NaOH + NH3.
5. При нагріванні амоніак знебарвлює розчини перманганатів:
2NH3 + 2KMnO4 = N2 + 2MnO2 + 2KOH + 2H2O.
6. Основні властивості виявляє за рахунок утворення водневих зв’язків з молекулами води і встановленням рівноваги:
NH3 + H2O ↔ NH3∙H2O ↔ NH4+ + OH–.
Розчин амоніаку у воді – електроліт зі слабкими основними властивостями. Оскільки концентрація іонів ОН– у розчині дуже незначна, то говорити про існування іонної сполуки NH4OH не можна.
Комплексний іон NH4+ тетраедричної будови утворюється за донорно-акцепторним механізмом, усі зв’язки N—Н у ньому рівноцінні:
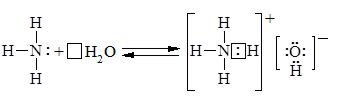
Аналогічно амоніак реагує з кислотами, утворюючи солі амоніаку:
NH3 +HCl = NH4Cl, 2NH3 + H2SO4 = (NH4)2SO4.
У цих реакціях амоніак є основою Льюїса (акцептором протона).
- За схожим механізмом відбувається утворення комплексних сполук – амоніакатів:
AgCl + 2NH3 = [Ag(NH3)2]Cl.
8. Аналогічно амоніак реагує з галогенопохідними вуглеводнів з утворенням солей алкіламоніаку – реакція Гофмана (див. Органічна хімія):
СН3І + 2NH3 = [СН3N+H3]І–.
Солі амоніаку.
Солі амоніаку – іонні сполуки, легко розчинні у воді.
1. У воді солі амоніаку гідролізують, створюючи кисле середовище (рН < 7):
NH4Cl + H2O ↔ NH3 + H2O + HCl.
2. Виявляють усі характерні властивості солей. У реакціях обміну іон NH4+ зберігається:
NH4Cl + AgNO3 = NH4NO3+ AgCl↓.
3. При дії лугів утворюються амоніак і вода:
NH4NO3 + NaOH = NH3 + H2O + NaNO3.
Це – якісна реакція на іон NH4+. Якщо при нагріванні речовини з лугом відчувається запах амоніаку, а вологий індикаторний папірець, піднесений до отвору пробірки синіє – це вказує на наявність іона NH4+ у складі речовини.
4. Солі амоніаку – термічно нестійкі, їх розклад може відбуватись оборотно або необоротно.
Оборотно розкладаються солі амоніаку, утворені аніонами кислот-неокисників:
NH4Cl ↔ NH3 + HCl, (NH4)2SO4 ↔ NH3 + NH4HSO4,
(NH4)2CO3 ↔ 2NH3 + CO2 + H2O, NH4HCO3 ↔ NH3 + CO2 + H2O.
Необоротно розкладаються солі амоніаку, утворенні аніонами кислот-окисників:
(NH4)2NO2 = N2 + 2H2O, NH4NO3 = N2O+ 2H2O,
(NH4)2Cr2O7 = N2 + Cr2O3 + 4H2O.
Остання реакція супроводжується виділенням великої кількості тепла і світла, розбризкуванням іскор та утворенням зеленого попелу Cr2O3, тому називається “вулкан”.
18.3. Оксиди Нітрогену
Нітроген утворює 6 оксидів (табл. 18.1), у яких виявляє ступені окиснення від +1 до +5. В їх молекулах реалізується ковалентний полярний зв’язок.
Таблиця 18.1
Оксиди нітрогену
|
Ступінь окиснення |
Формула |
Назви |
Фізичні властивості |
|
+1 |
N2O |
нітроген (І) оксид, |
безбарвний газ з характерним солодким запахом, мало розчинний у воді |
|
+2 |
NO |
нітроген (ІІ) оксид, монооксид азоту |
безбарвний газ без запаху, мало розчинний у воді |
|
+3 |
N2O3 |
нітроген (ІІІ) оксид, |
темно-синя рідина, реагує з водою |
|
+4 |
NO2 |
нітроген (ІV) оксид, |
бурий отруйний газ з характерним запахом, при 21 0С утворює червону рідину, з водою не реагує |
|
N2O4 |
нітроген (ІV) оксид, тетраоксид діазоту |
при –11,2 0С – тверда, безбарвна, кристалічна речовина, реагує з водою |
|
|
+5 |
N2O5 |
нітроген (V) оксид, |
білі кристали, при 20 0С розкладаються на NO2 та О2, реагує з водою |
Усі оксиди Нітрогену (крім N2O та NO) є солетвірними.
Нітроген (І) оксид (N2O) утворюється при розкладі амоній нітрату:
NH4NO3 = N2O + H2O.
Молекула лінійна N2O: [N≡N+–O–].
Реагує з воднем при нагріванні:
N2O + H2 = N2 + H2O.
Використовують у медицині для наркозу.
Нітроген (ІI) оксид (NO) утворюється при каталітичному окисненні амоніаку:
4NH3 + 5O2 = 4NO + 6H2O,
при дії розбавленої нітратної кислоти на малоактивні метали:
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O,
при безпосередній взаємодії азоту з киснем при 3000 0С:
N2 + O2 = 2NO.
На повітрі окиснюється до нітроген (ІV) оксиду:
2NO + O2 = 2NO2,
реагує з активними металами:
2NO + 2Mg = 2MgO + N2.
Нітроген (ІV) оксиди NO2 та N2O4 утворюються при окисненні NO, термічному розкладі плюмбум (ІІ) нітрату:
2Pb(NO3)2 = 2PbO + 4NO2 + O2,
при дії концентрованої нітратної кислоти на малоактивні метали:
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O.
NO2 та N2O4 є димерами, які перебувають у рівновазі:
2NO2 ↔ N2O4.
Вище 135 0С існує лише NO2, від –11 0С до 135 0С – існує їх суміш, а при температурі нижчій –12 0С – лише N2O4.
NO2 – змішаний ангідрид, при дії холодної води утворює нітритну та нітратну кислоти:
2NO2 + H2O = HNO3 + HNO2,
при нагріванні утворюється нітратна кислота та NO:
6NO2 + 2H2O = 4HNO3 + 2NO.
З лугами утворює дві солі:
2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O.
У надлишку кисню утворюється лише нітратна кислота:
4NO2 + O2 + 2H2O = 4HNO3.
Взаємодіє з воднем з утворенням амоніаку (каталізатор Pt):
2NO2 + 7H2 = 4H2O + 2NH3,
при нагріванні NO2 розкладається:
2NO2 = 2NO + O2.
Застосовують як окисник ракетного палива та проміжний продукт у виробництві нітратної кислоти.
Нітроген (ІІІ) оксид N2O3 утворюється при дії водовіднімаючих реагентів на кислі розчини нітритів:
P2O5 + 6KNO2 + 6HCl = 3N2O3 + 6KCl + 2H3PO4.
При розчиненні у воді утворює нітритну кислоту:
N2O3 + H2O = 2HNO2,
при взаємодії з лугами – нітрити:
2NaOH + N2O3 = 2NaNO2 + H2O.
Hітроген (V) оксид N2O5 утворюється при дії P2O5 на нітратну кислоту:
P2O5 + 2HNO3 = N2O5 + 2HPO3.
N2O5 – кислотний оксид, йому відповідає нітратна кислота.
18.4. Нітритна кислота. Нітрити
Нітритна кислота існує лише у розбавлених розчинах.
Одержують HNO2 дією кислот-неокисників (HCl) на холодні розчини нітритів:
NaNO2 + HCl = HNO2+ NaCl.
HNO2 – дуже слабка одноосновна кислота, при нагріванні і в концентрованих розчинах розкладається:
2HNO2 = NO + NO2 + H2O.
Солі цієї кислоти – нітрити утворюються при нагріванні нітратів лужних і лужноземельних металів у присутності свинцю:
KNO3 + Pb = KNO2 + PbO.
Нітрити (крім AgNO2) добре розчинні у воді, гідролізують, створюючи лужне середовище (рН > 7).
Оскільки ступінь окиснення Нітрогену +3, є проміжним, то нітрити можуть виявляти окисні (реакція а) або відновні (реакція б) властивості:
2NaNO2 + 2NaI + 2H2SO4 = 4NO + I2 + 2Na2SO4 + 2H2O (а),
5KNO2 + 2KMnO4 + 3H2SO4 = 5KNO3 + K2SO4 + 2MnSO4 + 3H2O (б).
Натрій нітрит NaNO2 застосовують у харчовій промисловості, виробництві барвників, в органічному синтезі.
18.5. Нітратна кислота. Нітрати
Атом Нітрогену в нітратній кислоті виявляє максимальну валентність –4. Ступінь окиснення Нітрогену +5, він перебуває у стані sp2-гібридізації. Графічно молекула нітратної кислоти зображується у вигляді двох резонансних структур:
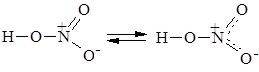
Одержання.
В лабораторії HNO3 одержують дією концентрованої сульфатної кислоти на тверді нітрати лужних або лужноземельних металів:
NaNO3 + H2SO4 = HNO3 + NaHSO4,
з наступною відгонкою HNO3 з реакційної суміші.
У промисловості добування HNO3 ведуть за процесом Оствальда, який складається із стадій:
1. окиснення амоніаку киснем повітря у присутності каталізатора Pt/Rh при 900 0С:
3NH3 + 5O2 = 4NO + 6H2O, ΔH = – 906 кДж/моль,
реакція екзотермічна, що дозволяє підтримувати температуру 900 0С без додаткового нагрівання;
2. окиснення NO до NO2 киснем повітря при охолодженні:
2NO + O2 = 2NO2;
3. поглинання NO2 водою в присутності кисню:
4NO2 + O2 + 2H2O = 4HNO3.
Утворюється розчин з масовою часткою НNO3 60%, який перегонкою концентрують до масової частки НNO3 68%, одержуючи при цьому азеотропну суміш*.
Подальше концентрування (до 98%) проводять перегонкою з сульфатною кислотою або P2O5.
Концентровану НNO3 перевозять в алюмінієвих цистернах, розбавлену – у посуді з кислотостійких матеріалів.
Фізичні властивості.
Чиста НNO3 – безбарвна рідина, густина 1,51 г/см3, кристалізується при ‑42 0С у прозору кристалічну масу. Температура кипіння 86 0С.
На повітрі димить, з водою змішується у будь-яких відношеннях. Технічна НNO3 забарвлена в жовтий колір за рахунок розчиненого у ній NO2.
Хімічні властивості.
І. Кислотні властивості. У водному розчині НNO3 практично повністю дисоціює на іони:
HNO3 + H2O = H3O+ + NO3–,
і є однією з найсильніших кислот. Виявляє усі характерні властивості кислот (реагує з оксидами, основами, солями) з утворенням солей – нітратів.
ІІ. При нагріванні на світлі частково розкладається:
4HNO3 = 4NO2 + O2 + 2H2O,
ІІІ. Окисні властивості.
Безводна НNO3 та у водних розчинах (розбавлених і концентрованих) виявляє сильні окисні властивості.
1. Взаємодія з неметалами:
а) концентрована НNO3 окиснює неметали до вищого ступеня окиснення, відновлюючись до NO2:
S + 6HNO3 = 6NO2 + H2SO4 + H2O, C + 4HNO3 = 4NO2 + CO2 + 2H2O,
P + 5HNO3 = 5NO2 + H3PO4 + H2O, I2 + 10HNO3 = 10NO2 + 2HIO3 + 4H2O.
б) розбавлена НNO3 відновлюється до NO, неметали окиснює до вищого ступеня окиснення:
S + 2HNO3 = 2NO + H2SO4, C + 4HNO3 = 4NO + 3CO2 + 2H2O,
3P + 5HNO3 + 2H2O = 5NO + 3H3PO4.
2. Взаємодія з металами.
а) Концентрована НNO3 при взаємодії з активними метали (лужними і лужноземельними) відновлюється до N2O:
4Mg + 10HNO3 = N2O + 4Mg(NO3)2+ 5H2O.
У реакції з металами середньої активності (Zn, Cd, Sn, Pb, Cu, Ag, Hg) НNO3 відновлюється до NO2:
Cu + 4HNO3 = NO2 + Cu(NO3)2+ 2H2O.
Концентрована НNO3 не реагує з Au, Pt і платиновими металами, а також не діє на Cr, Fe та Al внаслідок їх пасивації.
б) Розбавлена НNO3 при дії на метали (лужні та лужноземельні) відновлюється до NH4NO3:
4Ca + 10HNO3 = 4Ca(NO3)2 + NH4NO3 + 3H2O.
Менш активні метали (Fe, Co, Ni, Sn) відновлюють розбавлену HNO3 до N2O:
8Fe + 30HNO3 = 8Fe(NO3)3 + 3N2O + 15H2O.
При дії розбавленої HNO3 на Pb, Cu, Bi виділяється NO:
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O.
Розбавлена HNO3 на Ag, Hg, Au і платинові метали не діє.
Слід зазначити, що у реакціях HNO3 з металами не виділяється водень, а утворюється суміш продуктів відновлення HNO3, співвідношення яких залежить від концентрації HNO3, активності металу, температури тощо.
Отже, чим більш розбавлена нітратна кислота і активніший метал, тим глибше відновлення атому Нітрогену.
3. Метали, які не розчиняються у нітратній кислоті будь-яких концентрацій, розчиняються у суміші концентрованих HNO3 та HCl (1:3) – “царська вода” (нім. Kaiser wasser). Вона розчиняє золото та платинові метали.
Сильна окисна здатність її зумовлена утворенням атомарного хлору:
3HClк. + HNO3к. = 3Сl·+ NO + 2H2O,
Au + 4HCl + HNO3 = H[AuCl4] + NO + H2O.
Суміш концентрованих HF та HNO3 – “пекельна суміш” переводить малоактивні метали в комплексні сполуки:
3Ta + 21HF + 5HNO3 = 3H2[TaF7] + NO + 10H2O.
гексафлуоротанталова (V) кислота
4. Взаємодіє з бінарними сполуками:
карбідами: 3CaC2 + 16HNO3к. = 3Ca(NO3)2 + 6CO2 + 10NO + 8H2O,
сульфідами: 3As2S3+ 28HNO3к. + 4H2O = 6H3AsO4 + 9H2SO4 + 28NO,
гідридами: 3H2S + 2HNO3р. = 3S + 2NO + 4H2O,
фосфідами: Mg3P2 + 14HNO3к. = 3Mg(NO3)2 + 2H3PO4 + 8NO2 + 4H2O,
оксидами: As2О3 + 2HNO3к. + 2H2O = 2H3AsO4 + N2O3.
IV. Взаємодія з органічними речовинами. При дії концентрованої HNO3 більшість органічних речовин обвуглюється. Вуглеводні з нітратною кислотою утворюють нітропохідні (реакція Коновалова), спирти – естери (нітрати – нітрогліцерин, нітроцелюлоза). Характерною реакцією на білки є дія концентрованої нітратної кислоти з появою жовтого забарвлення – ксантопротеїнова реакція. Детально взаємодію нітратної кислоти з органічними речовинами розглянуто в розд. Органічна хімія.
Застосування.
Більшість нітратної кислоти використовують на виготовлення азотних добрив, вибухових речовин, барвників, для виробництва сульфатної кислоти нітрозним способом, виготовлення лаків, кіноплівки (нітроцелюлоза).
Солі нітратної кислоти – нітрати – кристалічні іонні сполуки, добре розчинні у воді.
Нітрати одержують дією нітратної кислоти на метали, оксиди, основи або солі летких кислот (карбонати).
1. Окисні властивості нітрати виявляють у розчинах лугів:
4Zn + NaNO3 + 7NaOH + 6H2O = 4Na2[Zn(OH)4] + NH3.
2. Сильними окисниками нітрати є у розплавах:
Fe2O3 + 3KNO3 + 4KOH = 2K2FeO4 + 3KNO2 + 2H2O.
3. При нагріванні нітрати розкладаються, залежно від природи катіона утворюються різні продукти:
а) нітрати лужних і лужноземельних кислот розкладаються до нітриту і кисню:
2KNO3 = 2KNO2 + O2;
б) нітрати металів середньої активності утворюють оксид металу, NO2 і кисень:
Cu(NO3)2 = 2CuO + 4NO2 + O2;
в) нітратів малоактивних металів утворюють метал, NO2 і кисень:
Hg(NO3)2 = Hg + 2NO2 + O2.
Залежно від місця металу в ряду стандартних електродних потенціалів нітрати розкладаються за схемою (включаючи зазначений метал):
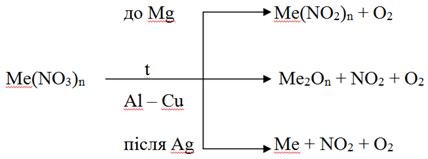
Амоніак нітрат NH4NO3 при розкладі утворює N2O і воду:
NH4NO3 = N2O + H2O
4. Оскільки при розкладі нітратів утворюється кисень, їх використовують для виготовлення чорного пороху:
2KNO3 + 3C + S = N2 + 3CO2 + K2S.
Якісною реакцією на іони NO3– є нагрівання нітратів з концентрованою сульфатною кислотою і порошком міді – утворюється бурий газ NO2:
Me(NO3)2 + Cu + H2SO4 = Cu(NO3)2 + NO2 + H2O + MeSO4.
Нітрати використовують у сільському господарстві як азотні добрива, у піротехніці для виготовлення чорного пороху і вибухових речовин.
* Азеотропна (неподільнокипляча) суміш – суміш рідин, яка кипить при певній температурі без розділення на компоненти. Так, медичний спирт (суміш 96% етанолу та 4% води) є азеотропною сумішшю.
18.6. Фосфор
Електронна будова.
Фосфор Р – другий елемент VА підгрупи Періодичної системи. Електронна конфігурація зовнішнього електронного рівня атома фосфору 3s23p3. Він – повний електронний аналог Нітрогену, однак за рахунок більшого атомного радіуса і наявності вакантного 3d-підрівня їх хімічні властивості відрізняються. Неподілена електронна пара на 3s-підрівні може розпаровуватись (атом переходить у збуджений стан) і один електрон переходить на 3d-підрівень, за рахунок чого фосфор виявляє максимальний ступінь окиснення +5 (утворює 5 ковалентних зв’язків за обмінним механізмом:
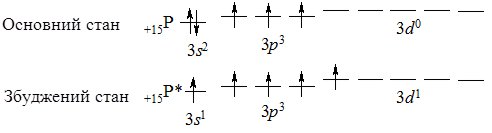
Алотропія та фізичні властивості.
Фосфор утворює кілька алотропних модифікацій з різними властивостями.
Білий фосфор – м`яка кристалічна речовина з т. пл. 44,1 0С. Розчинний у сірковуглеці CS2 та органічних розчинниках, нерозчинний у воді, тому білий фосфор зберігають під шаром води. У парах простої речовини містяться молекули P4 (рис. 18.2). Отруйний!
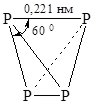
Рис. 18.2. Молекула Р4.
Ця модифікація є найбільш реакційноздатною. Нагрівання P4 без доступу повітря при 300 0С веде до утворення червоного фосфору з т. пл. 585 – 600 0С і полімерними молекулами Pn. Він менш реакційноздатний.
Чорний фосфор утворюється при нагріванні білого фосфору при 200 0С і тиску 1200 кПа. Це найстійкіша модифікація, на вигляд нагадує графіт. Чорний фосфор хімічно стійкий, не розчинний у сірковуглеці та неотруйний.
Поширення у природі.
Вміст фосфору у земній корі становить біля 0,1%. Через високу хімічну активність у вільному стані він не зустрічається, а перебуває лише у формі сполук. Найважливішими мінералами фосфору є фосфорит Ca3(PO4)2 і апатит 3Ca3(PO4)2∙CaX (X = OH, F, Cl – відповідно гідроксил-, флуоро- або хлорапатит) або Ca3(PO4)2X.
Одержання.
Фосфор вперше добув перегонкою сечі Х. Брандт (Німіччина) у 1670 р.
Сировиною для промислового одержання фосфору є апатит або фосфорит, у яких фосфор знаходиться у максимальному ступені окиснення +5. Мінерали відновлюють в електропечах у присутності вугілля і піску:
2Ca3(PO4)2 + 10C + 6SiO2 = P4↑+ 6CaSiO3 + 10CO.
Утворену пару білого фосфору P4 конденсують під водою.
Хімічні властивості.
У хімічних реакціях найактивніший білий фосфор, який записують “P4”. Інші модифікації, або коли модифікація невідома, записують “Р”.
1. Взаємодія з неметалами. Залежно від співвідношення реагентів (нестача чи надлишок фосфору) можуть утворюватись сполуки Р+3 або Р+5:
4P + 3O2 = 2P2O3, 4P + 5O2 = 2P2O5,
2P + 3Cl2 = 2PCl3, 2P + 5Cl2 = 2PCl5,
2P + 3S = P2S3, 2P + 5S = P2S5.
При гідролізі оксидів Фосфору утворюється одна з фосфатних кислот (див. Кислоти фосфору). Галогеніди і сульфіди Фосфору розкладаються водою з утворенням двох кислот:
PCl3 + 3H2O = H3PO3 + 3HCl, PCl5 + 4H2O = H3PO4 + 5HCl,
P2S3 + 6H2O = 2H3PO3 + 3H2S, P2S5 + 8H2O = 2H3PO4 + 5H2S,
тобто вони – галоген- і тіоангідриди фосфітної H2PHO3 (двоосновна кислота, її формула Н2[HPO3]) і ортофосфатної H3PO4 кислот.
З воднем фосфор безпосередньо не реагує.
2. Взаємодія з металами відбувається при нагріванні:
6Ca + P4 = 2Ca3P2.
Утворені фосфіди – солеподібні сполуки. Ступінь окиснення Фосфору у їх складі –3.
Деякі фосфіди гідролізують з утворенням газоподібного фосфіну РН3:
Mg3P2 + 6H2O = 3Mg(OH)2 + 2PH3.
РН3 – безбарвний газ із запахом гнилої риби, за будовою молекули схожий на амоніак, однак основні властивості РН3 виражені слабше (зокрема, не розчиняється у воді за рахунок відсутності водневих зв’язків).
Утворює солі з сильними кислотами (HCl, HI, HClO4):
PH3 + HCl = [PH4+]Cl–.
фосфонію хлорид
Солі фосфонію утворені аналогічно солям амоніаку. Гідролізують необоротно:
PH4Cl + H2O = PH4ОН+ HCl↑.
У природі фосфін утворюється при гнитті органічних решток. На повітрі він димеризується у Р2Н6, що самозаймається і горить блакитним полум`ям:
P2H6 + 4O2 = P2O5 + 3H2O.
З цим пов`язане виникнення “блукаючих вогників” на цвинтарях і болотах («вогні святого Ельма»).
3. Взаємодія з лугами при нагріванні супроводжується диспропорціюванням:
P4 + 3NaOH + 3H2O = PH3 + 3NaH2PO2.
Натрій гіпофосфіт NaH2PO2 – сіль слабкої одноосновної кислоти Н3PO2 (точніше Н[Н2PO2]).
4. Взаємодія з кислотами-окисниками веде до утворення фосфатної кислоти:
P + 5HNO3к. = H3PO4 + 5NO2 + H2O,
2P + 5H2SO4к. = 5H3PO4 + 3SO2 + H2O.
5. Суміш Армстронга використовують у виробництві сірників. При терті сірникової голівки (K2Cr2O7 + KClO3 + S + MnO2/Fe2O3) до намазки коробки (Pчерв.+скло) відбувається реакція:
6P + 5KClO3 = 5KCl + 3P2O5.
Застосування.
Фосфор використовують у виробництві сірників, димоутворюючих речовин, інсектицидів, у металургії.
У природі фосфор входить до складу нуклеїнових кислот, білків крові, мозкових, нервових тканин. У кістках хребетних тварин фосфор перебуває у вигляді кальцій ортофосфату Ca3(PO4)2.
18.7. Оксигеновмісні сполуки фосфору
Фосфор з Оксигеном утворює оксиди фосфору (III) та (V).
Фосфор (III) оксид (фосфористий ангідрид). Йому відповідає формула P4O6 (рис. 18.3).
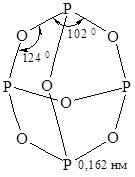
Рис. 18.3. Молекула Р4О6.
Утворюється при горінні фосфору за нестачі кисню. P4O6 – біла кристалічна речовина. Реакція його з водою веде до утворення фосфористої кислоти:
P4О6 + 6H2O = 4H3PO3.
Оксид фосфору (III), фосфориста кислота та її солі – фосфіти – сильні відновники.
Фосфор (V) оксид (фосфатний ангідрид). Йому відповідає формула P4O10 (рис. 18.4).
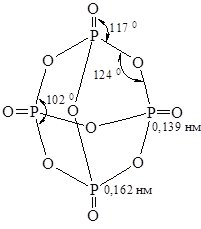
Рис. 18.4. Молекула Р4О10.
Утворюється при горінні фосфору в надлишку кисню. P4O10 – білий гігроскопічний порошок. Типовий кислотний оксид. При взаємодії з водою, залежно від умов, утворюються різні кислоти фосфору. На холоді утворюється тетраметафосфатна кислота :
P4О10 + 2H2O = (HPO3)4.
З більшою кількістю води утворюється дифосфатна (пірофосфатна) кислота:
P4О10 + 4H2O = 2H2P4O7.
При надлишку води утворюється фосфатна кислота:
P4О10 + 6H2O = 4H3PO4.
Кип`ятіння (HPO3)4 та H2P4O7 з надлишком води веде до утворення фосфатної кислоти:
(HPO3)4 + 4H2O = 4H3PO4, H2P4O7 + H2O = 4H3PO4.
Аналогічно, з лугами Р4О10 утворює солі – мета- або ортофосфати:
Р4О10 + 4NaOH = 4NaPO3 + 2H2O Р4О10 + 12NaOH = 4Na3PO3 + 6H2O
натрій метафосфат натрій ортофосфат
Р4О10 енергійно віднімає воду від кислот, що дає можливість одержувати ангідриди відповідних кислот:
Р4О10 + 4HNO3 = 4HPO3 + 2N2O5, Р4О10 + 4HClO4 = 4HPO3 + 2Cl2O7.
При сплавленні Р4О10 з карбонатами або гідрогенкарбонатами лужних і лужноземельних металів утворюються метафосфати:
4NaHCO3 + P4O10 = 4NaPO3 + 4CO2 + 2H2O.
Найважливішою з кислот фосфору є ортофосфорна кислота H3PO4 зі ступенем окислення Фосфору +5.
Одержують H3PO4 у лабораторії взаємодією фосфору з 30% нітратною кислотою:
3P + 5HNO3 + 2H2O = 3H3PO4 + 5NO.
У промисловості H3PO4 – дією концентрованої сульфатної кислоти на фосфорит Ca3(PO4)2:
Ca3(PO4)2 + 2H2SO4 = H3PO4 + СaSO4↓,
або спалюванням фосфору з надлишком кисню і наступним розчиненням P4O10 у надлишку води. Останній метод дозволяє одержати дуже чисту концентровану фосфатну кислоту.
Фізичні властивості. Безводна H3PO4 – безбарвні прозорі кристали з т. пл. 42 0С. Дуже добре розчинна у воді, нелетка.
Хімічні властивості. У водному розчині H3PO4 – кислота середньої сили. Дисоціює ступінчато:
І ступінь: H3PO4 ↔ H2PO4– + H+,
ІІ ступінь: H2PO4– ↔ HPO42–+ H+,
ІІІ ступінь: HPO42– ↔ PO43–+ H+.
H3PO4 виявляє усі властивості, характерні для кислот-неокисників. Реагує з активними металами, основними оксидами, солями слабких кислот (карбонатами, силікатами) з утворенням солей – фосфатів (ортофосфатів). H3PO4, як триосновна кислота утворює три типи солей: середні і кислі з одним або двома атомами гідрогену у складі кислотного залишку:
K3PO4, Ca3(PO4)2 – середні солі – ортофосфати,
K2HPO4, CaHPO4 – дизаміщені кислі солі – моногідрогенфосфати,
KH2PO4, Ca(H2PO4) – монозаміщені кислі солі – дигідрогенфосфати.
Дигідрогенфосфати розчинні у воді, із моногідрогенфосфатів та ортофосфатів у воді розчинні лише солі лужних металів і амоніаку.
У водних розчинах середніх і дизаміщених фосфатів лужних металів рН > 7, у монозаміщених – рН < 7 (табл 18.2).
Таблиця 18.2
рН 1% розчинів натрій фосфатів
|
Сіль |
рН |
|
Na3PO4 |
12,1 |
|
Na2HPO4 |
8,9 |
|
NaH2PO4 |
6,4 |
Ортофосфати одержують дією надлишку лугу на фосфатну кислоту:
H3PO4 + 3NaOH = Na3PO4 + 3H2O,
або дією лугу на кислі фосфати:
Na2HPO4 + NaOH = Na3PO4 + H2O, NaH2PO4 + 2NaOH = Na3PO4 + 2H2O.
Моногідрогенфосфати утворюються при взаємодії лугу з фосфатною кислотою у відношенні 2 : 1:
H3PO4 + 2NaOH = Na2HPO4 + 2H2O,
при дії лугу на NaH2PO4 або NaH2PO4:
NaH2PO4 + NaOH= Na2HPO4 + H2O,
при дії фосфатної кислоти на Na3PO4:
2Na3PO4 + H3PO4 = 3Na2HPO4.
або взаємодією NaH2PO4 та Na3PO4:
NaH2PO4 + Na3PO4 = 2Na2HPO4.
Дигідрогенфосфати утворюються при взаємодії лугу з фосфатною кислотою у співвідношенні 1:1:
NaOН + H3PO4 = 3NaН3PO4 + Н2О,
або при дії фосфатної кислоти на Na3PO4 чи Na2HPO4:
2H3PO4 + Na3PO4 = 3NaH2PO4, H3PO4 + Na2HPO4 = 2NaH2PO4.
Під дією сильних кислот нерозчинні фосфати переходять у розчинні форми:
Ca3(PO4)2 + 4HNO3 = 2Ca(H2PO4)2 + 2Ca(NO3)2.
Якісною реакцією на фосфати є взаємодія з AgNO3 з утворенням яскраво-жовтого осаду Ag3РO4, розчинного у кислотах:
PO43– + 3Ag+ = Ag3РO4↓,
HPO42– + 3Ag+ = Ag3РO4↓ + H+,
H2PO4– + 3Ag+ = Ag3РO4↓ + 2H+.
Застосування оксигеновмісних сполук фосфору.
Оксид Р4О10 застосовують у хімічних лабораторіях для осушення речовин кислої природи (SO3, SO2, CO2, CH3COOH тощо).
Фосфатну кислоту використовують при виготовленні мінеральних добрив і миючих засобів.
18.8. Мінеральні добрива
Вивченням питань живлення рослин і підвищення їх врожайності шляхом використання добрив займається агрохімія.
Необхідні для росту і розвитку рослин елементи (N, P, K та ін.) вносяться в грунт в формі органічних (гній, торф) і мінеральних (неорганічні солі) добрив.
За вмістом поживних елементів розрізняють азотні, фосфорні, калійні, мікродобрива (містять мікроелементи) і комплексні (містять одночасно кілька поживних елементів) добрива.
Азотні добрива.
Нітроген – обов`язковий елемент білків, необхідний для живлення усіх живих істот. Однак атмосферний азот не можуть засвоювати ні тварини, ні рослини (крім бобових). Рослини беруть азот з ґрунту, де він перебуває у формі органічних речовин та мінеральних солей. Грунт містить незначну кількість азоту, який постійно виноситься з полів при зборах урожаю. Тому для поповнення запасів азоту у грунт періодично вносять азотні добрива.
Основні азотні добрива – нітратні і аміачні.
Нітратні добрива – солі нітратної кислоти. Їх ще називають селітрами: NaNO3 – чилійська, KNO3 – індійська, Ca(NO3)2 – норвезька (за місцем добування) селітри.
Аміачні – солі амоніаку ((NH4)2SO4 та NH4Cl) або розчини амоніаку у воді (аміачна вода).
Аміачно-нітратним добривом є NH4NO3 – аміачна селітра.
Одним з найкращих азотних добрив є сечовина (карбамід) (NH2)2CO.
Фосфорні добрива.
Фосфор відіграє важливу роль в енергетичному обміні, оскільки входить до складу аденозинфосфатних кислот (АМФ, АДФ, АТФ). При нестачі фосфору сповільнюється ріст рослин. Фосфорні добрива одержують з фосфоритів. Природні сполуки фосфору – фосфорит і апатит – нерозчинні у воді, тому фосфор з них не засвоюється рослинами. Для підвищення розчинності їх перетворюють у кислі фосфати дією мінеральних кислот:
Ca3(PO4)2 + 2H2SO4 = 2CaSO4 + Са(H2PO4)2.
Утворена суміш солей називають суперфосфат.
При дії H3PO4 на фосфорит утворюється подвійний суперфосфат.
Ca3(PO4)2 + 4H3PO4 = 3Са(H2PO4)2.
Преципітат СаHPO4 утворюється при дії H3PO4 на CaCO3 або Са(ОН)2:
CaCO3 + H3PO4 = СаHPO4 + H2O + CO2.
Із мелених кісток тварин готують фосфоритне борошно, яке теж є цінним добривом.
Калійні добрива.
Калій бере участь у синтезі вуглеводів, в обміні енергії, підвищує стійкість рослин до хвороб. Джерелом калію є природні відклади калійних солей. В Україні значні поклади калійних добрив знаходяться біля м. Калуш і Стебник (Львівська обл.). Тут добувають карналіт KCl∙MgCl2∙6H2O, сильвініт KCl∙NaCl, сильвін KCl.
Мікродобрива.
Для нормального росту і розвитку рослин необхідні мікроелементи Mg, Fe, B, Mo, Mn, Zn, Co. Вони підвищують активність ферментів, синтез основних органічних компонентів (білків, вуглеводів, нуклеїнових кислот, вітамінів). Мікроелементи вносять у грунт у складі мікродобрив, які називають за вмістом основного мікроелемента (борні, мідні, тощо).
Комплексні добрива.
Описані вище добрива – прості, оскільки містять один поживний елемент. Набагато ефективнішими є комплексні добрива, що містять одночасно кілька елементів.
Основними комплексними добривами є: калійна селітра KNO3, амофоси – суміш фосфатів амоніаку (NH4)3PO4, NH4H2PO4, (NH4)2HPO4 у різних співвідношеннях; нітрофоси (суміш нітратних і фосфатних добрив), амофоси (аміачні і фосфорні), нітрофоски (нітратні, фосфорні і калій) тощо.
Промисловість, що випускає добрива називають туковою, а добрива – туками. Основну масу добрив виробляють у формі гранул або рідин. Рідкі добрива краще засвоюються рослинами.
Основна характеристика добрив – вміст поживних елементів (N, P, K) у відсотках умовно засвоєної форми N, P2O5 або K2O. Так, якщо кажуть, що у грунт внесли 10 кг азоту, 30 кг фосфору і 20 кг калію (умовно N10P30K20), то це означає, що на 1 га поля внесли 10 кг N, 30 кг P2O5 і 20 кг K2O у складі різних сполук.