19. ЕЛЕМЕНТИ IVА ГРУПИ. ЗАГАЛЬНА ХАРАКТЕРИСТИКА
19. ЕЛЕМЕНТИ IVА ГРУПИ. ЗАГАЛЬНА ХАРАКТЕРИСТИКА
| Сайт: | Підготовка до ЗНО - Освітній портал "Академія" |
| Курс: | Підготовка до ЗНО з хімії |
| Книга: | 19. ЕЛЕМЕНТИ IVА ГРУПИ. ЗАГАЛЬНА ХАРАКТЕРИСТИКА |
| Надруковано: | Гість |
| Дата: | Sunday 25 May 2025 5:37 AM |
19. ЕЛЕМЕНТИ IVА ГРУПИ. ЗАГАЛЬНА ХАРАКТЕРИСТИКА
До головної підгрупи IV групи входить 5 елементів – Карбон С, Силіцій Si, Германій Ge, Станум Sn і Плюмбум Pb.
Електронна конфігурація зовнішнього електронного рівня ns2np2, де n – номер періода. Це р-елементи:
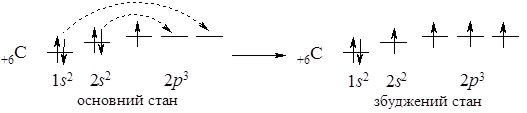
За рахунок існування основного і збудженого стану характерні ступені окиснення елементів –4, 0, +2, +4.
Атомні радіуси елементів IVА групи зростають зверху вниз, енергія іонізації і відносна електронегативність зменшуються, послаблюються неметалічні, посилюються металічні властивості. Карбон і Силіцій – типові неметали, Германій – перехідний елемент, Станум і Плюмбум – типові метали.
Сполуки елементів IVА підгрупи з гідрогеном не виявляють кислотно-основних властивостей через близькі значення електронегативностей елементів і неполярності молекул.
Вищі оксиди та їх гідрати виявляють кислотні (C, Si) або амфотерні (Sn, Pb) властивості.
19.1. Карбон. Вуглець
Карбон – перший елемент IVА підгрупи. Проста речовина існує у формі кількох алотропних модифікацій: алмаз, графіт, карбін.
Алмаз – прозора кристалічна речовина. У кристалічній гратці алмазу (рис. 19.1, а) атомні орбіталі Карбону перебувають у стані sp3-гібридизації і утворюють чотири міцні ковалентні зв’язки. Така будова зумовлює високу твердість і хімічну стійкість алмазу. Алмаз не проводить електричний стум.
При нагріванні до 800 0С в атмосфері кисню алмаз згорає до СО2. Спаливши алмаз, А. Лавуазьє (Англія) у 1772 р. довів, що алмаз складається з Карбону.
Без доступу повітря утворює іншу алотропну модифікацію Карбону – графіт.
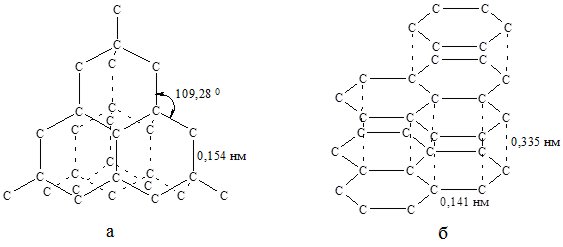
Рис. 19.1. Кристалічні гратки алмазу (а) і графіту (б).
Графіт – сіро-чорна речовина з металічним блиском. Дуже м`який, добре проводить електричний струм, тугоплавкий, хімічно інертний матеріал. У графіту шарувата кристалічна гратка (рис. 19.1, б). Зв’язки між атомами Карбону в межах одного шару міцні, між шарами – слабкі. Гібридизація атомів карбону у молекулі графіту sp2.
Карбін – чорна дрібнокристалічна речовина, в природі не існує, її штучно одержують при дегідратації ацетилену НC≡CH при 1000 0С у присутності Cu2+. Атоми Карбону перебувають у стані sp-гібридизації. Це – напівпровідник.
Існують α-карбін або поліїн зі структурою –C≡C–C≡C– та β‑карбін (полікумулен), його структура =С=С=С=С=.
Нещодавно відкрита ще одна модифікація Карбону – фулерен – сферичні поверхні, що містять від 60 до 84 атомів Карбону.
Поширення у природі.
У природі у вільному стані Карбон зустрічається у формі алмазу та графіту. Вугілля, сажа, кокс – форми існування графіту.
У мінералах Карбон міститься у складі кальциту СаСО3, доломіту CaCO3×MgCO3 і магнезиті MgCO3.
Карбон входить до складу живої матерії, як основний структурний елемент усіх органічних речовин.
Фізичні властивості.
У будь-якій алотропній формі вуглець не має смаку і запаху, тугоплавкий і нерозчинний у воді та органічних розчинниках (крім фулеренів).
Графіт у формі вугілля завдяки пористій будові має високу адсорбційну здатність.
Адсорбція – концентрування різних речовин на поверхні поділу фаз (тверда-рідка, тверда-газова, рідка-газова, рідка-рідка).
Речовина, яка утримує на своїй поверхні частинки називається адсорбентом, речовина, яка утримується – адсорбатом.
Найвищу адсорбційну здатність має активоване вугілля, в якому спеціально очищають пори. Активоване вугілля використовують для очистки повітря в протигазах, видалення отруйних речовин з організму людини, очищення води тощо.
Хімічні властивості Карбону розглянемо на прикладі графіту.
За звичайної температури графіт хімічно інертний. При нагріванні реагує з неметалами (H2, F2, O2, N, S), металами, оксидами, кислотами.
І. З простими речовинами:
1. Безпосередньо реагує лише з фтором (з іншими галогенами не реагує):
C + 2F2 = CF4.
2. У реакції з киснем можливе утворення двох оксидів.
При нестачі кисню утворюється карбон (IІ) оксид:
який згоряє у надлишку кисню:
2CO + O2 = 2CO.
3. З сіркою реакція відбувається при 1000 0С:
C + 2S = CS2.
Сірковуглець CS2 розчиняє багатьох речовин.
4. При дії електричного розряду на суміш графіту та азоту утворюється диціан (CN)2 або C2N2:
Диціан називають псевдогалогеном. При взаємодії з воднем утворюється ціановодень (водні розчини – синильна кислота):
(CN)2 + Н2О = НCN.
Синильна кислота та її солі – ціаніди – сильні отрути.
5. За високої температури або наявності каталізатора (Ni/Pt) реагує з воднем з утворенням вуглеводнів:
C + 2H2 = CH4 (600 –
Ці сполуки розглянуто в розд. Органічна хімія.
6. З кремнієм при нагріванні утворюється карбід силіцію:
C + Si = SiC.
7. З металами при нагріванні утворює карбіди:
Карбіди бувають солеподібні (типу метану (Al4C3, Be2C) і типу ацетилену (CaC2)), ковалентні (SiC, B4C3) і металоподібні (Fe3C тощо).
При дії води або кислот на карбіди типу метану виділяється метан:
Al4C3 + 12H2O = 4Al(OH)3 + 3CH4, Al4C3 + 12HCl = 4AlCl3 + 3CH4.
Карбіди типу ацетилену утворюють ацетилен:
CaC2 + 2H2O = Ca(OH)2 + C2H2, CaC2 + 2HCl = CaCl2 + C2H2.
Ковалентні карбіди – хімічно інертні, дуже тверді речовини.
Металоподібні карбіди – тверді жаростійкі речовини, під дією кислот утворюють метан і водень:
Fe3C + 6HCl = 3FeCl2 + CH4 + H2.
ІІ. Зі складними речовинами.
1. Окиснюється концентрованою сульфатною або нітратною кислотами при 100 0С до СО2:
C + 2H2SO4к. = CO2 + 2SO2 + 2H2O,
C + 4HNO3к. = CO2 + 4NO2 + 2H2O.
2. Відновлює оксиди металів і неметалів:
FeO + C = Fe + CO, SiO2 +
Іноді при цьому утворюються карбіди:
2Al2O3 +
Метод відновлення оксидів вугіллям у металургії називають карботермією (див. Добування металів).
3. Розпечений до червоного кольору вуглець реагує з парою води:
C + H2O = CO + H2.
Утворюється водяний газ.
Застосування.
Алмаз застосовують у виготовленні шліфувальних матеріалів, прикрас, для різання скла, виготовлення прикрас – діамантів. Графіт застосовують для виготовлення графітових стержнів олівців, змазок і мастил завдяки легкості його розшарування. Графіт, будучи електропровідним, є хорошим матеріалом для виготовлення електродів.
Кам’яне вугілля використовують як паливо, адсорбент, відновник при виробництві фосфору з фосфориту, чорного пороху, у металургії (карботермія).
19.2. Оксиди Карбону
Карбон утворює два оксиди: карбон (II) та (IV) оксиди.
Карбон (II) оксид (карбон монооксид, чадний газ) СО – отруйний безбарвний газ без запаху, легший за повітря, не розчиняється у воді і не реагує з нею.
У промисловості утворюється при спалюванні вуглецю або його органічних сполук за нестачі кисню:
відновленням СО2 розпеченим вугіллям:
CO2 + C = 2CO,
або при конверсії метану чи вугілля з водяною парою:
CH4 + H2O = CO + 3H2, C + H2O = CO + H2.
У лабораторії СО одержують дією сульфатної кислоти на НСООН при 100 0С:
HCOOH = CO + H2O.
За будовою молекули СО нагадує азот, оскільки у ній існує потрійний зв’язок:
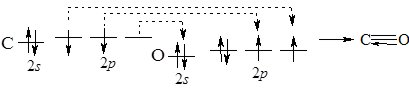
Завдяки йому СО хімічно малоактивний.
Хімічні властивості.
1. За н.у. СО – індиферентний оксид. При 200 0С і тиску 15 мПа реагує з NaOH з утворенням натрій форміату HCOONa:
NaOH + CO = HCOONa.
Це показує, що СО формально є ангідридом мурашиної кислоти НСООН.
2. На повітрі СО горить блакитним полум’ям:
2CO + O2 = 2CO2.
3. На світлі реагує з хлором з утворенням фосгену COCl2 (гр. народжений світлом):
CO + Cl2 COCl2.
Це – дихлорангідрид вугільної кислоти H2CO3:
COCl2 + 2H2O = H2CO3 + 2HCl.
Фосген колись використовували як отруйний газ, зараз застосовують у синтезі органічних сполук.
4. При нагріванні відновлює оксиди металів:
4CO + Fe3O4 = 4CO2 + 3Fe.
5. З деякими d-металами (Fe, Co, Ni) утворює карбоніли:
4CO + Ni = [Ni(CO)4].
нікель тетракарбоніл
Карбоніли – комплексні сполуки з нейтральною внутрішньою сферою.
Карбон (IV) оксид (вуглекислий газ, карбонатний ангідрид) СО2 – безбарвний газ, без смаку і запаху, важчий за повітря. Малорозчинний у воді. Твердий СО2 називають “сухий лід”.
Утворюється в природі при окисненні органічних речовин (гнитті, горінні), виділяється при виверженні вулканів. Карбон (IV) оксид під назвою “лісовий газ” (gas silvestre) вперше описав Ван Гельмонт (Бельгія) у VІ ст., добувши його спалюванням дерева.
У лабораторії СО2 добувають дією кислот на СаСО3 в апараті Кіппа:
CaCO3 + 2HCl = CO2 + CaCl2 + H2O.
У промисловості СО2 добувають термічним розкладом СаСО3:
CaCO3 = CaO + CO2.
Молекула СО2 лінійна неполярна, тому вуглекислий газ погано розчинний у воді і полярних розчинниках.
Хімічні властивості.
1.Розчиняється у воді з утворенням слабкої вугільної кислоти:
H2O + CO2 D H2CO3.
2. Реагує з основними оксидами з утворенням карбонатів:
CaO + CO2 = CaCO3.
3. З лугами утворює карбонати і/або гідрогенкарбонати:
2NaOH + CO2 = Na2CO3 + H2O, NaOH + CO2 = NaHCO3.
Остання реакція відбувається при надлишку СО2:
Na2CO3 + H2O + CO2 = 2NaHCO3.
4. Не підтримує горіння. На цьому ґрунтується його якісне виявлення. Лише активні речовини віднімають Оксиген від вуглекислого газу:
2Mg + CO2 = 2MgO + C.
5. Бере участь у фотосинтезі:
6CO2 + 6H2O ![]() C6H12O6 + 6O2.
C6H12O6 + 6O2.
19.3. Карбонатна кислота. Карбонати
Карбонатна кислота існує лише у водних розчинах. Це – слабка кислота, дисоціює ступінчато:
І ступінь: Н2СО3 ↔ НСО3– + Н+,
І ступінь: НСО3– ↔ СО32– + Н+.
Дисоціація за другим ступенем відбувається дуже незначною мірою.
Як двоосновна кислота утворює два типи солей: середні – карбонати (Na2CO3, CaCO3) і кислі – гідрогенкарбонати (KHCO3, Ba(HCO3)2).
Одержують карбонати дією СО2 на водні розчини лугів:
CO2 + Ba(OH)2 = BaCO3↓ + H2O.
Цю реакцію використовують для виявлення вуглекислого газу за помутнінням розчину лугу.
Усі гідрогенкабронати та карбонати лужних металів і амоніаку розчинні у воді.
Хімічні властивості.
1.Розчини карбонатів і гідрогенкабонатів, внаслідок гідролізу створюють лужне середовище (pH > 7):
Na2CO3 + Н2О ↔ NaHCO3 + NaOН.
Карбонати алюмінію, хрому (ІІІ), феруму (ІІІ) і купруму (ІІ) не існують, оскільки гідролізують необоротно:
CuCO3 + Н2О = Cu(OН)2↓ + СО2.
Якщо ж реакційну масу нагріти для видалення слідів води, то відбувається розкладання карбонату на оксид металу і вуглекислий газ:
2Сr(CO3)3 = Сr2O3 + 6CO2.
2. Дією кислот солі карбонатної кислоти розкладаються на вуглекислий газ і воду:
NaHCO3 + CH3COOH = CH3COONa + CO2 + H2O,
CaCO3 + 2HCl = CaCl2 + CO2 + H2O.
При цьому спостерігається виділення СО2 і спінення розчину, що використовують для того, щоб відрізнити карбонати від інших речовин.
3. При нагріванні усі солі карбонатної кислоти (крім солей лужних металів) розкладаються на оксид металу і СО2:
ВaCO3 = ВaО + CO2, 2Са(HCO3)2 = СаСО3 + CO2 + H2O.
Гідрогенкарбонати лужних металів утворюють середні солі, які не розкладаються при нагріванні:
2NаHCO3 = Nа2СО3 + CO2 + H2O.
Застосування оксигеновмісних сполук Карбону.
Карбон (ІІ) оксид СО використовують у металургії як відновник оксидів металів. Він є складовою газоподібного палива (СО + Н2 – водяний газ), вихідна речовина при синтезі НСООН через HCOONa.
Вуглекислий газ СО2 використовують у вогнегасниках і для виготовлення газованої води. Ще у XVIII ст. Дж. Прістлі (Англія) збираючи СО2 над водою помітив, що частина його розчиняється у ній, надаючи приємного терпкого смаку. Додавши до такої води тільки цукор та ароматизатор одержують сучасні газовані напої. Твердий СО2 – «сухий лід».
Натрій карбонат Na2CO3 (кальцинована сода) у вигляді кристалогідрату Na2CO3×10Н2О (кристалічна сода) використовують у виробництві миючих засобів, скла, натрієвих солей, натрій гідрогенкарбонат NаHCO3 (питна сода) – у хлібопекарстві, як розпушувач тіста, калій гідрогенкарбонат КHCO3 (поташ) – при виготовленні скла, у фотографії, доломіт CaCO3×MgCO3 і магнезит MgCO3 – у виробництві цементу та будівельних матеріалів.
19.4. Силіцій. Кремній
Силіцій (лат. silex – кремінь) Si – типовий неметал і найближчий електронний аналог Карбону; знаходиться у IVА підгрупі ІІІ періоду Періодичної системи. Електронна структура зовнішнього енергетичного рівня атома Силіцію 3s23p23d0:
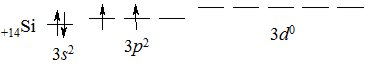
У сполуках з Оксигеном і неметалами виявляє ступінь окиснення +4 (рідше +2), у сполуках з Гідрогеном –2. Найстійкіший ступінь окиснення +4. У зв’язку зі зростанням атомного радіуса, порівняно з Карбоном, у Силіцію зменшується міцність міжатомних зв’язків, особливо в гомоатомних ланцюгах. На відміну від Карбону, Силіцій практично не утворює кратних зв’язків.
Відомі аморфний і кристалічний кремній, які відрізняються зовнішнім виглядом і властивостями, проте не є алотропними модифікаціями.
Вперше силіцій добув Й. Берцеліус (Швеція) у 1824 р.
Поширення у природі.
Силіцій – другий за поширенням елемент після Оксигену (27,6 % за масою) у Земній корі.
В природі Силіцій перебуває лише у зв’язаному стані: у вигляді силіцій діоксиду SiO2 (силікатний ангідрид, кремнезем) і у вигляді солей силікатних кислот – силікатів. Чистий SiO2 – гірський кришталь, кварц, забарвлений домішками оксидів металів – агат, аметист, яшма.
Найпоширеніші алюмосилікати: біла глина Al2O3×2SiO2×2H2O, польовий шпат K2O×Al2O3×6SiO2, слюда K2O×Al2O3×6SiO2×H2O.
Багато силікатів у чистому вигляді є дорогоцінними каменями – аквамарин, топаз, ізумруд.
Як Карбон, входячи до складу усіх живих речовин, є найважливішим елементом живої природи, так Силіцій – основний елемент неживої природи. Більшість гірських порід містять сполуки Силіцію: граніт, глини, пісок.
У живій природі Силіцій міститься у діатомових водоростях, хвощах, кремнієвих губках, іноді входить до складу пір’я, шерсті.
Одержання.
Кремній одержують прожарюванням білого піску SiO2 з магнієм:
SiO2 + 2Mg = Si + 2MgO.
При цьому утворюється аморфний кремній у вигляді білого порошку. Кристалізацією аморфного кремнію добувають кристалічний кремній з металічним блиском.
У промисловості кристалічний кремній одержують відновленням SiO2 в електропечах:
SiO2 + C = Si + CO2.
Найчистіший кремній добувають за реакціями:
SiCl4 + 2Zn = Si + 2ZnCl2, SiH4 = Si + 2H2.
Фізичні властивості.
Аморфний кремній – бурий порошок з т. пл. 1420 0С, неелектропровідний.
Кристалічний кремній – тверда речовина сірого кольору з металічним блиском, тепло- і електропровідний. Напівпровідникові властивості обумовлені будовою кристалу, яка аналогічна алмазу. Проте зв’язки в кристалі значно слабкіші, ніж в алмазу і за н.у. частина з них розірвані, а тому в кристалі є вільні електрони, наявність яких і зумовлює незначну тепло- і електропровідність. При нагріванні розривається більше зв’язків, тому тепло- і електропровідність зростає.
Хімічні властивості.
За н.у. кремній – інертний елемент, за кімнатної температури реагує лише з фтором:
Si + 2F2 = SiF2.
При високих температурах реагує практично з усіма неметалами (C, O2, S, N2, Cl2, Br2) з утворенням відповідних бінарних сполук:
Si + C = SiC, 3Si + 2N2 = Si3N4, Si + O2 = SiO2,
Si + 2S = SiS2, Si + 2Cl2 = SiCl4.
Галогеніди кремнію гідролізують у водних розчинах лугів:
6SiF4 + 12NaOH = 4Na2SiF6 + 2Na2SiO3 + 6H2O.
Кремній не реагує з кислотами і водою, розчиняється лише у суміші HF і HNO3:
3Si + 12HF + 4HNO3 = 3SiF4 + 4NO + 8H2O,
та у розчинах лугів:
Si + 2KOH + H2O = K2SiO3 + 2H2.
У цих реакціях Силіцій – відновник.
При сплавленні з металами кремній утворює силіциди, виступаючи при цьому окисником:
2Mg + Si = Mg2Si.
При дії хлоридної кислоти на Mg2Si утворюється силан:
Mg2Si + 4HCl = 2MgCl2 + SiH4.
Силан SiH4 – безбарвний отруйний газ, самозаймається на повітрі:
SiH4 + 2О2 = SiО2 + 2Н2О.
Застосування.
У техніці кремній використовують для виготовлення напівпровідників. Сплав заліза з кремнієм (феросиліцій) використовують у виготовленні деталей заводської жаро- та хімічностійкої апаратури.
Високотвердий сплав кремнію з графітом – карборунд – з кристалічною граткою алмазу використовують для виготовлення наждачного паперу і точильних кругів. Відкрив карборунд випадково Е. Ачесон (США) (1856 – 1931) при спробі добути алмаз шляхом нагрівання вугілля у присутності глини при високій температурі.
Натрій гексафторосилікат Na2SiF6 – отруйна речовина, використовують як інсектицид (отрута для боротьби з комахами).
Фторосилікати магнію, цинку, алюмінію використовують у будівництві для створення водонепроникного шару на поверхні будматеріалів.
19.5. Силіцій діоксид. Силікатні кислоти. Силікати
Найстійкішою сполукою силіцію є силіцій діоксид SiO2. Кристалічний SiO2 не розчинний у воді, твердий, плавиться при 1660 0С. При кристалізації розплаву утворюється аморфний SiO2, схожий на скло.
Як кислотний оксид SiO2 реагує з:
1. лугами при сплавленні або кип’ятінні:
SiO2 + 2КОН = К2SiO3,
2. основними оксидами при сплавленні:
SiO2 + СаО = СаSiO3,
3. карбонатами при сплавленні:
SiO2 + Na2CO3 = Na2SiO3 + CО2,
У реакціях 1 – 3 утворюються солі силікатної кислоти Н2SiO3 – силікати. Силікатна кислота Н2SiO3 утворюється при дії сильних кислот на силікати:
Na2SiO3 + 2HCl = H2SiO3↓ + 2NaCl.
H2SiO3 виділяється у вигляді драглистого осаду. Це – найпростіша з силікатних кислот загального складу xSiO2·yH2O. При нагріванні H2SiO3 розкладається:
H2SiO3 = H2O + SiO2.
Виявити силікат-іони SiO32– можна пропусканням СО2 через їх водні розчини:
К2SiO3 + CO2 + H2O = K2CO3 + H2SiO3↓.
Ця реакція свідчить про те, що карбонатна кислота слабкіша від силікатної.
Силікатна кислота за н.у. не реагує з металами, оксидами та солями. Солі силікатної кислоти одержують виходячи з SiO2 (див. вище).
Силікати не розчинні у воді за винятком силікатів лужних металів, водні розчини мають лужну реакцію за рахунок гідролізу:
К2SiO3 + 2H2O = 2KОН + H2SiO3↓.
Застосування.
Деякі силікати лужних металів застосовують у будівництві (граніт, глина, базальт), для укріплення ґрунту, як адсорбенти (цеоліти).
При відщепленні елементів води від силікатних кислот (їх висиханні) утворюється силікагель, який застосовують як осушувач.
19.6. Скло. Кераміка. Цемент
З розплавленого кварцу виготовляють кварцове скло, яке пропускає ультрафіолетові промені. Його використовують для виготовлення кварцових ламп та хімічного посуду.
Скло – твердий прозорий матеріал. Найпоширеніші силікатні скла, які містять SiO2.
Звичайне віконне складається з оксидів Na2O, CaO та SiO2 з добавками Al2O3 і MgO тощо. Магній оксид забезпечує хімічну і механічну стійкість, алюміній оксид – термостійкість і однорідність.
Для одержання кольорового скла вносять спеціальні добавки – оксиди металів: Mn2O3 надає фіолетового забарвлення, Cr2O3 або Fe3O4 – зеленого, CuO – блакитного, CoO – синього, CdS – жовтого. Додаванням PbO до звичайного скла одержують кришталь та штучні дорогоцінні камені.
Для добування скла сплавляють Na2CO3, CaCO3, SiO2 та добавки у спеціальних печах при 1000 0С:
Na2CO3 + CaCO3 + 6SiO2 = Na2O×CaO×6SiO2 + 2СО2.
З однорідного розплаву при 1300 0С формують скляні вироби. Із скла виготовляють труби, тару, хімічний і побутовий посуд, деталі оптичних приладів.
Якщо суміш неорганічних сполук з SiO2 не плавлять, а лише спікають при високих температурах, утворюються керамічні матеріали. Найбільше значення з них мають фарфор і фаянс.
Фарфор – білий матеріал, складається з SiO2, Al2O3 i K2O. Він газо- і водонепроникний, використовують для виготовлення ізоляторів, художніх виробів, предметів побуту.
Фаянс – фарфор, вкритий глазур’ю. З нього виготовляють облицювальну плитку, посуд, художні вироби.
Кераміку застосовують для виготовлення будматеріалів – цегли, черепиці.
Цемент – порошок, складається із прожарених досуха CaSiO3 i MgSiO3. Добувають його з вапняку і глини, випалюючи їх у спеціальних печах при 1400 0С. При змішуванні цементу з водою, маса швидко затвердає.
Із суміші цементу, води і наповнювачів (пісок, щебінь, шлак) при затвердінні утворюється бетон.