19. ЕЛЕМЕНТИ IVА ГРУПИ. ЗАГАЛЬНА ХАРАКТЕРИСТИКА
19. ЕЛЕМЕНТИ IVА ГРУПИ. ЗАГАЛЬНА ХАРАКТЕРИСТИКА
19.2. Оксиди Карбону
Карбон утворює два оксиди: карбон (II) та (IV) оксиди.
Карбон (II) оксид (карбон монооксид, чадний газ) СО – отруйний безбарвний газ без запаху, легший за повітря, не розчиняється у воді і не реагує з нею.
У промисловості утворюється при спалюванні вуглецю або його органічних сполук за нестачі кисню:
відновленням СО2 розпеченим вугіллям:
CO2 + C = 2CO,
або при конверсії метану чи вугілля з водяною парою:
CH4 + H2O = CO + 3H2, C + H2O = CO + H2.
У лабораторії СО одержують дією сульфатної кислоти на НСООН при 100 0С:
HCOOH = CO + H2O.
За будовою молекули СО нагадує азот, оскільки у ній існує потрійний зв’язок:
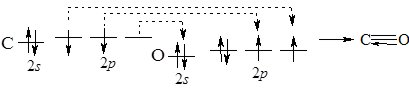
Завдяки йому СО хімічно малоактивний.
Хімічні властивості.
1. За н.у. СО – індиферентний оксид. При 200 0С і тиску 15 мПа реагує з NaOH з утворенням натрій форміату HCOONa:
NaOH + CO = HCOONa.
Це показує, що СО формально є ангідридом мурашиної кислоти НСООН.
2. На повітрі СО горить блакитним полум’ям:
2CO + O2 = 2CO2.
3. На світлі реагує з хлором з утворенням фосгену COCl2 (гр. народжений світлом):
CO + Cl2 COCl2.
Це – дихлорангідрид вугільної кислоти H2CO3:
COCl2 + 2H2O = H2CO3 + 2HCl.
Фосген колись використовували як отруйний газ, зараз застосовують у синтезі органічних сполук.
4. При нагріванні відновлює оксиди металів:
4CO + Fe3O4 = 4CO2 + 3Fe.
5. З деякими d-металами (Fe, Co, Ni) утворює карбоніли:
4CO + Ni = [Ni(CO)4].
нікель тетракарбоніл
Карбоніли – комплексні сполуки з нейтральною внутрішньою сферою.
Карбон (IV) оксид (вуглекислий газ, карбонатний ангідрид) СО2 – безбарвний газ, без смаку і запаху, важчий за повітря. Малорозчинний у воді. Твердий СО2 називають “сухий лід”.
Утворюється в природі при окисненні органічних речовин (гнитті, горінні), виділяється при виверженні вулканів. Карбон (IV) оксид під назвою “лісовий газ” (gas silvestre) вперше описав Ван Гельмонт (Бельгія) у VІ ст., добувши його спалюванням дерева.
У лабораторії СО2 добувають дією кислот на СаСО3 в апараті Кіппа:
CaCO3 + 2HCl = CO2 + CaCl2 + H2O.
У промисловості СО2 добувають термічним розкладом СаСО3:
CaCO3 = CaO + CO2.
Молекула СО2 лінійна неполярна, тому вуглекислий газ погано розчинний у воді і полярних розчинниках.
Хімічні властивості.
1.Розчиняється у воді з утворенням слабкої вугільної кислоти:
H2O + CO2 D H2CO3.
2. Реагує з основними оксидами з утворенням карбонатів:
CaO + CO2 = CaCO3.
3. З лугами утворює карбонати і/або гідрогенкарбонати:
2NaOH + CO2 = Na2CO3 + H2O, NaOH + CO2 = NaHCO3.
Остання реакція відбувається при надлишку СО2:
Na2CO3 + H2O + CO2 = 2NaHCO3.
4. Не підтримує горіння. На цьому ґрунтується його якісне виявлення. Лише активні речовини віднімають Оксиген від вуглекислого газу:
2Mg + CO2 = 2MgO + C.
5. Бере участь у фотосинтезі:
6CO2 + 6H2O ![]() C6H12O6 + 6O2.
C6H12O6 + 6O2.