20. МЕТАЛИ
20. МЕТАЛИ
| Сайт: | Підготовка до ЗНО - Освітній портал "Академія" |
| Курс: | Підготовка до ЗНО з хімії |
| Книга: | 20. МЕТАЛИ |
| Надруковано: | Гість |
| Дата: | Sunday 25 May 2025 5:43 AM |
20. МЕТАЛИ
Мета́ли ( від грец. μέταλλον — «шахта», «кар'єр», «добування з надр землі») — клас хімічних елементів і речовин з такими хімічними та фізичними властивостями:
- добре проводять електричний струм і тепло,
- непрозорі, але здатні відбивати світло (мають металічний блиск),
- ковкі, що дозволяє надавати виробам з них потрібної форми та розвальцьовувати їх,
- пластичні, що дає можливість витягати їх у тонкий дріт.
20.1. Загальна характеристика металів
Класифікація металів.
Існують різноманітні способи класифікації металів. Наведемо загальну класифікацію з урахуванням фізичних властивостей металів.
Усі метали поділяють на дві велику групи: чорні та кольорові.
Чорні метали – темно-сірого кольору, з високою густиною (крім лужноземельних), мають високі температури плавлення та кипіння, високу твердість. Серед них виділяють:
1. метали родини заліза – Fe, Co, Ni, а також Mn. Їх застосовують для одержання сплавів заліза;
2. тугоплавкі метали – температура плавлення яких перевищує температуру плавлення заліза (1536 0С) – Мо, W. Застосовуються як легуючі добавки до сталей;
3. уранові метали – актиноїди – метали ІІІВ підгрупи V періоду;
4. рідкісноземельні метали – лантаноїди – метали ІІІВ підгрупи VII періоду;
5. лужні та лужноземельні метали – елементи ІА та ІІА підгруп.
Кольорові метали – забарвлені (жовті, червоні, білі), м’які, пластичні, мають низькі температури плавлення та кипіння. Їх поділяють на:
1. легкі метали – лужні метали, Be, Mg, Al (густина не більша 5 г/см3);
2. благородні метали – Ag, Au, метали родини платини (VIIIB підгрупа, 5 і 6 період). Усі вони хімічно малоактивні.
3. легкоплавкі метали – температура плавлення яких нижча від температури плавлення заліза.
Фізичні властивості металів.
Основний вплив на фізичні властивості має електронна структура атома і будова кристалічної гратки металу (рис. 20.1.). Найчастіше у металів зустрічаються об’ємно-центровані кубічні (Li, Na, K, Cr, Fe) (рис. 20.1, а), гранецентровні кубічні (Al, Ca, Cu, Ag, Au) (рис. 20.1, б), гексагональні (Be, Mg, Co, Zn) кристалічні гратки (рис. 20.1, в).
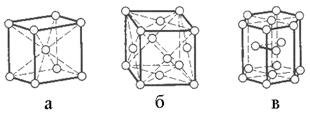
Рис. 20.1. Типи кристалічних ґраток металів (пояснення у тексті).
Кристалічна гратка металів складається із позитивно заряджених катіонів і нейтральних атомів металу, між якими рухаються валентні електрони, які зв’язують усі атоми в кристалі у єдине ціле (“усуспільнені” електрони). Такий тип зв’язку називають металічним.
Температури плавлення і кипіння. За звичайних умов метали – тверді речовини (за винятком Hg). Температури плавлення змінюються у широких межах – від –39 0С у Hg до 3420 0С у W. Температури кипіння металі вдуже високі (у Pt 4350 0С, у Cu 2877 0С). У періодичній системі зі зростанням порядкового номера елемента металу в періоді зростають температури плавлення та кипіння.
Електропровідність металів зумовлена наявністю в кристалічних гратках рухливих електронів, які навіть при невеликій різниці потенціалів рухаються від негативного полюса до позитивного. За звичайних умов найкраще електричний струм проводять срібло і мідь, найгірше – свинець і ртуть.
З підвищенням температури зростає сила коливання атомів у вузлах кристалічних граток, що утруднює рух електронів, тому електропровідність знижується. При зниженні температури, коливання зменшуються і електропровідність зростає.
Теплопровідність визначається тими ж факторами, що й електропровідність. Найкраще тепло проводить срібло, найгірше – бісмут і ртуть.
Металічний блиск характерний для всіх металів. Як правило метали – сірого або білого кольору, однак є і забарвлені метали: мідь – червона, золото – жовте. Часто на повітрі метали вкриваються оксидною плівкою і втрачають блиск.
Густина металів зменшується зі зменшенням атомної маси елемента і збільшенням атомного радіуса. Найлегший метал – літій (густина 0,53 г/см3), найважчий – осмій (густина 22,5 г/см3). Літій, натрій та калій – єдині метали, легші за воду.
За магнітним властивостями виділяють метали:
1. парамагнітні – втягуються в магнітне поле за рахунок неспарених електронів – d-елементи: ванадій, ніобій, тантал;
2. діамагнітні – виштовхуються з магнітного поля – цинк, ртуть, мідь;
3. феромагнітні – зберігають намагнічений стан протягом певного часу – залізо, кобальт, нікель.
Основними механічними властивостями металів є твердість, пластичність, міцність.
Твердість – опір проникненню в метал іншого твердого тіла. Найтвердіші метали – вольфрам, хром (ріжуть скло), найм’якіші – лужні (ріжуться ножем).
Пластичність – здатність змінювати форму без руйнування і зберігати її після припинення дії деформуючої сили. Найпластичніші – золото (з 1 г золота можна витягнути нитку довжиною 2000 м), срібло і мідь.
Міцність – здатність не руйнуватись під дією навантаження.
Загальні хімічні властивості металів.
Характерні хімічні властивості металів обумовлені будовою зовнішнього електронного рівня. Як уже зазначалось (табл. 13.4), у зв’язку з малою кількістю електронів на зовнішньому електронному рівні, атоми металів у хімічних реакціях їх легко віддають, перетворюючись у позитивно заряджені катіони. Проте здатність віддавати електрони у різних металів різна, і чим вона вища, тим активніше метал реагує як відновник.
Зі зростанням кількості електронів на зовнішньому електронному рівні, зростає енергія іонізації і активність металів зменшується. Окрім того, легкість віддачі електронів залежить від того, наскільки далеко вони розташовані від ядра. Зі зменшенням атомного радіуса електрони сильніше притягаються до ядра і тим важче їх відірвати.
Зі сказаного можна зробити висновок: оскільки кількість електронів в атомах в межах періоду зростає зліва направо, а радіус атома зростає в межах групи зверху вниз, то активність металів буде зростати в періоді справа наліво, а у межах групи – зверху вниз. Зі сказаного випливає, що найактивнішими будуть лужні метали, оскільки легше віддати один електрон, ніж прийняти сім, для утворення октету – завершеного стійкого електронного рівня (типу благородного газу), а малоактивними будуть платинові метали, яким до октету не вистачає від 1 до 3 електронів.
Розглянемо реакції металів з типовими окисниками.
І. Дія деяких неметалів на метали (активність неметалів-окисників зменшується зверху вниз).
1. Галогени утворюють галогеніди – солі відповідних безоксигенових кислот:
2Me + xHal = 2MeHalx, 2Fe + 3Cl2 = FeCl3.
2. Оксиген утворює оксиди (з золотом і платиною не реагує), з лужними металами – пероксиди:
4Me + xO2 = 2Me2Ox, 4Al + 3O2 = Al2O3,
2Me + O2 = Me2O2, 2Na + O2 = Na2O2.
3. Сульфур утворює сульфіди – солі сульфідної кислоти (з деякими металами не реагує навіть при нагріванні):
2Me + xS = Me2Sx, Fe + S = FeS.
4. Гідроген з лужними і лужноземельними металами утворює гідриди:
2Me + хН2 = 2MeНx, Са + Н2 = СаН2.
Деякі платинові метали добре поглинають водень (1 об’єм паладію поглинає до 900 об’ємів водню), що зумовлює їх використання як каталізаторів в реакціях гідрування органічних сполук.
5. Нітроген утворює нітриди з лужними і лужноземельними металами:
6Ме + хN2 = 2Me3Nx, 3Mg + N2 = Mg3N2.
Деякі метали (алюміній, берилій, титан) на повітрі вкриваються оксидною плівкою (пасивуються), що запобігає подальшому окисненою металу. Пасивація спостерігається і при дії на метали інших окисників (галогенів, кислот) і супроводжується утворенням захисних плівок відповідного типу (галогенідів, солей).
ІІ. Дія води на метали.
З водою за звичайних умов реагують лише лужні і лужноземельні метали з утворенням відповідних гідроксидів і виділенням водню:
2Ме + 2хН2О = 2Ме(ОН)х + Н2, 2Na + 2Н2О = 2NaОН + Н2.
При високих температурах з водою реагують більшість металів:
2Fe + 6Н2О = 2Fe(ОН)3 + 3Н2.
ІІІ. Дія кислот на метали.
З кислотами-неокисниками (галогеноводні, сульфідна, розбавлена сульфатна) реагують активні метали, розташовані у ряду стандартних електродних потенціалів до водню з утворенням відповідних солей і водню:
Fe + 2НCl = FeCl2 + Н2.
У такі реакції не вступають метали, вкриті захисною плівкою (берилій, алюміній, ніобій, тантал).
Концентровані нітратна і сульфатна кислоти реагують з більшістю металів. Продукти їх взаємодії з металами розглянуті при вивченні хімічних властивостей відповідних кислот.
IV. Дія лугів на метали.
За звичайних умов з лугами реагують лише амфотерні метали – берилій, алюміній, цинк, олово, свинець:
2Al + 6NaOH + 6H2O = 2Na3[Al(OH)6] + 3H2.
У результаті таких реакції виділяється водень і утворюються комплексні сполуки.
IV. Дію розчинів солей на метали вперше вивчав М.М. Бекетов (Росія). На основі експериментальних даних він склав витискувальний ряд металів (сучасна назва – ряд стандартних електродних потенціалів) (див. Основи електрохімії).
20.2. Метали у природі. Основні способи одержання металів
Деякі метали трапляються у природі у вільному стані (самородні), але найчастіше – у зв’язаному. У самородному стані можуть існувати малоактивні метали, які стоять у ряду стандартних електродних потенціалів після Гідрогену (Cu, Au, Ag, Hg, Pt). Решта металів зустрічаються лише у формі природних сполук – мінералів. Так, Ферум міститься у мінералах: гематиті Fe2O3, магнетиті Fe3O4, лимоніті 2Fe2O3∙3H2O, Купрум – халькопіриті CuFeS, мідному блиску Cu2S, Алюміній – бокситі Al2O3∙4H2O, корунді Al2O3 тощо.
Природні сполуки металів, з яких технологічно можливо та економічно доцільно добувати метал називають рудами, до їх складу, крім корисного мінералу входить пуста порода.
Залежно від складу основного мінералу, розрізняють руди:
- оксидні – Cu2O (куприт), Fe2O3 (гематит), Al2O3 (корунд);
- сульфідні – FeS2 (пірит), мідний блиск (Cu2S), кіновар (HgS);
- хлоридні – сильвініт (KCl∙NaCl), карналіт (KCl∙MgCl2∙6H2O);
- карбонатні – кальцит (CaCO3), малахіт ([CuOH]2CO3), магнезит (MgCO3).
Руди, що містять сполуки кількох металів, називають поліметалічними – (Fe(CrO2)2 – хроміт, CuFeS – халькопірит.
Руди – основна сировина металургії – галузі, що виробляє метали. Вироблення металів включає два етапи: 1) збагачення руд і 2) виділення металу(ів) із збагачених руд.
Збагачення руд – відділення пустої породи для підвищення вмісту в руді корисного мінералу.
Найпоширеніші методи збагачення руд – магнітна сепарація та флотація.
Флотація – метод, що базується на різній змочуваності водою часток пустої породи та мінералу. Руду обробляють флотаційними реагентами, що адсорбуються лише на частках корисного мінералу, який після цього не змочується водою. Потім додають воду і продувають повітря, яке підіймає на поверхню частки корисного мінералу, а пуста порода осідає на дно.
Магнітна сепарація – очистка руд з магнітними властивостями. Метод використовують, зокрема, для збагачення магнетиту Fe3O4 – часточки мінералу затримуються магнітом і відділяються від пустої породи.
Найчастіше поєднують кілька способів збагачення руд. Збагачені руди використовують для виділення чистих металів.
Сульфідні, карбонатні та інші руди, окрім збагачення, переводять в оксиди шляхом випалювання:
4FeS2 + 11O2 = 2Fe2O3 + 8SO2, CaCO3 = CaO + CO2
Одержаний оксидний концентрат безпосередньо використовують для одержання металів.
Для виділення металу збагачену оксидну руду відновлюють.
Залежно від природи відновника та умов процесу виділяють піро- та гідрометалургію.
Пірометалургія – одержання металів з руд дією відновників при високих температурах. Чим активніший метал добувають, тим сильніший відновник слід використовувати (див. Окисно-відновні реакції).
Залежно від типу відновника виділяють основні види пірометалургії:
1) карботермія – відновлення оксидів металів вугіллям (коксом) або карбон (ІІ) оксидом СО. Цим способом одержують більшість d-елементів (Tі, V, Cu, Zn, Mn, W), Pb і Sn:
MeO + C = Me + CO; MeO + CO = Me + CO2
2) відновлення воднем Н2 використовують для одержання Mo, W, Fe, Re:
MoO3 + 3H2 = Mo + 3H2O
3) металотермія – відновлення активними металами (Al, Mg, Ca, Na). Цим методом одержують Cr, Mn, Fe, V. Відновлення алюмінієм – алюмотермія, магнієм – магнійтермія тощо:
3Fe3O4 + 8Al = 9Fe + 4Al2O3.
Гідрометалургія – дія хімічних реагентів на руди з метою переведення їх у розчин для виділення металів з водних розчинів. Як розчинники використовують воду, кислоти. З розчину метал можна витіснити іншим металом – метод цементації. Так, в основі одержання металічної міді лежать процеси:
Розчинення руди:
CuO + H2SO4 = CuSO4 + H2O
CuСO3 + H2SO4 = CuSO4 + H2O
Цементація:
CuSO4 + Fe = Cu + FeSO4
Електрометалургія – катодне відновлення металів електролізом розчинів або розплавів їх солей. Активні метали ІА та ІІА підгруп одержують електролізом розплавів солей або гідроксидів (лугів), малоактивні метали – електролізом водних розчинів солей (див. Електроліз).
20.3. Метали і сплави у техніці
У розплавлених металах можуть розчинятись інші метали, складні речовини та неметали. Після охолодження таких систем утворюються сплави. Властивості сплавів кардинально відрізняються від властивостей їх компонентів. Сплави зберігають високу тепло- та електропровідність, температура плавлення їх нижча, ніж температура плавлення вихідних речовин. Так, сплав Вуда (50 % Bi, 25 % Pb, 13 % Sn, 13 % Cd) плавиться при 75 0С, тоді коли температура плавлення найлегкоплавкішого компоненту – олова – 232 0С. Сплави твердіші ніж вихідні речовини, мають вищій електричний опір.
Сплави одержують сплавленням компонентів, електролізом розчинів і розплавів, випаровуванням порошків металів тощо.
Сплави класифікують:
а) за кількістю компонентів:
– подвійні (бронзи Cu – Me, де Me – Be, Al, Mn; латунь Cu – Zn),
– потрійні (мельхіор Cu – Ni – Fe; нейзільбер Cu – Zn – Ni);
б) за структурою:
– гомогенні (однофазні),
– гетерогенні (суміші);
в) за типом основного компонента:
– чорні (на основі заліза – сталь, чавун),
– кольорові (на основі міді, нікелю, алюмінію);
г) за властивостями:
– тугоплавкі,
– легкоплавкі,
– жаростійкі,
– тверді,
– корозійно-стійкі тощо.
Залежно від якісного складу та співвідношення компонентів у сплавах, досягають бажаних властивостей. Сплави на основі алюмінію (дюралюміни, алюмінієві бронзи, силумін) – легкі, стійкі до окиснення, однак м’якші за сталь; на основі вольфраму – жароміцні, але крихкі;. на основі міді (бронзи, латунь, мельхіор) – корозійностійкі, електропровідні, пластичні, міцні.
На сьогодні у світі в техніці застосовують 75 металів та понад 1500 сплавів з найрізноманітнішими властивостями. Наведемо кілька найпоширеніших сплавів.
Бронзи (~ 90 % міді, решта – алюміній, олово або берилій, марганець тощо) використовують для виготовлення пружин, деталей машин. Латунь (60 % міді і 40 % цинку) – предмети побуту. Мельхіор (80 % міді і 20 % нікелю) – білі монети, посуд. Нейзільбер (65 % міді, 20 % цинку, 15 % нікелю) – художні вироби, спецінструменти. Константан (60 % міді, 40 % нікелю), манганін (мідь, нікель, марганець) – сплави з високим опором, використовують для виготовлення електричних нагрівників. “Победит” (карбід вольфраму WC і кобальт) – твердість на рівні алмазу, виготовлення ріжучих інструментів (склорізи). Силумін (алюміній і кремній) – легкий сплав, легко виливається, використовують для виготовлення складних деталей.
Для досягнення необхідних властивостей сплави легують – вносять певні кількості перехідних металів (ванадію, хрому, марганцю) – легуючі компоненти. Вперше леговану марганцем сталь одержав у 1882 р. Р. Хедфілд (Англія). Нержавіючу сталь вперше одержав Е. Хелвуд (США) у 1919 р., ввівши добавки хрому і нікелю.
Великий внесок у вивчення сплавів зробив у 1893 – 1902 р. академік М.С. Курнаков (Росія), заклавши основи фізико-хімічного аналізу багатокомпонентних систем.
20.4. Корозія металів і способи її запобігання
Як зазначалось вище, для переважної більшості металів вільний стан нестабільний і з часом вони переходять у стійку окиснену форму. На практиці з цим часто стикаються при експлуатації виробів з металів і сплавів. Під впливом зовнішнього середовища вони поступово руйнуються втрачаючи при цьому початкові фізичні та хімічні властивості.
Руйнування металів і сплавів під дією зовнішнього середовища (води, повітря) називається корозією.
Корозія може охоплювати всю поверхню виробу (тотальна), або лише його окремі ділянки (локальна) корозія.
Залежно від механізму, виділяють хімічну та електрохімічну корозію.
Хімічна корозія відбувається при безпосередньому контакті металу з розчинами неелектролітів, сухими газами тощо. У цьому випадку проходить окиснення металу окисниками – компонентами оточуючого середовища.
Хімічну корозію зумовлюють кисень повітря, пари води, вуглекислий газ CO2, сульфур (IV) оксид SO2, хлор Cl2, гідроген хлорид HCl тощо. Зокрема, корозія заліза в атмосфері кисню (на повітрі) зумовлена проходженням процесу:
4Fe + 3O2 = 2Fe2O3.
Деякі метали (алюміній, цинк, хром нікель) під дією кисню утворюють оксидні плівки які захищають метал від подальшого руйнування:
4Al + 3O2 = 2Al2O3.
При механічному або хімічному руйнуванні плівки корозія проходить далі. У заліза оксидна плівка пориста і тому не захищає метал від подальшої корозії.
Хімічній корозії піддаються деталі двигунів внутрішнього згорання, газових турбін, хімічна апаратура.
Інтенсивність корозії зростає при підвищенні температури, зростання сили окисника і активності металу.
Провідне місце займає електрохімічна корозія – руйнування металів і сплавів при контакті з іншими металами та розчинами електролітів. Електролітами можуть бути пори води в повітрі, ґрунтові води, морська вода тощо. У цьому випадку відбувається перенос електронів, що зумовлює проходження окисно-відновних процесів – виникає гальванічний елемент (рис. 20.1).
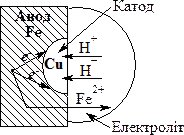
Рис. 20.1. Схема електрохімічної корозії.
Коли активніший метал (наприклад, залізо) забруднений менш активним металом (домішка міді), на його поверхні при стиканні з електролітом відбувається окиснення активного металу (заліза) і його перехід у розчин у формі катіонів:
Fe0 – 2e– = Fe2+
Таким чином, залізо є анодом.
Електрони переміщуються на менш активний метал (мідь), виникає їх надлишок, мідь стає катодом, на якому можливе проходження процесів відновлення. Найчастіше відновлюються іони Н+ (при рН < 7), або молекули О2, розчинені у воді. У першому випадку відбувається процес: 2Н+ + 2е– = Н2 (воднева деполяризація); у другому: О2 + 2Н2О + 4е– = 4ОН– (киснева деполяризація).
Виникають гальванічні елементи, схеми яких відповідно записують:
(–) Fe ½ Fe2+ (H2O) H+ ½ H2 (Cu) (+),
(–) Fe ½ Fe2+ (H2O) OH– ½ O2 (Cu) (+).
Електрохімічна корозія інтенсифікується при зростанні різниці стандартних електродний потенціалів металів, що утворюють гальванічний елемент, агресивності середовища, концентрації окисника, підвищенні температури.
Корозія металів і сплавів відбувається безперервно і завдає значної економічної шкоди. У результаті корозійних процесів виходить з ладу обладнання, машини, механізми, руйнуються металеві конструкції. Особливо інтенсивно кородує апаратура хімічних і металургійних виробництв. Тому розробка ефективних способів захисту від корозії – важливе завдання сучасної хімічної науки.
Знаючи фактори, що спричиняють корозію, розробляються спеціальні наукові підходи до питання захисту металів від окиснення і руйнування. Розглянемо деякі з них.
Нанесення захисних покриттів (металічних, неметалічних, полімерних, лакофарбових) – пасивує метал шляхом утворення оксидів, карбідів, нітридів тощо або перешкоджає фізичному доступу агресивних реагентів.
Для захисту виробів із заліза і сплавів на його основі, їх покривають цинком, який є активнішим, ніж залізо, але за рахунок наявності оксидної плівки ZnO захищає залізо від руйнування. При механічному пошкодженні захисного шару за наявності води виникає гальванічний елемент:
Zn ½ O2, H2O ½ Fe.
Цинк, як активніший метал є анодом і розчиняється згідно схеми:
2Zn0 + 4OH– = 2Zn(OH)2.
Коли розчиниться весь цинк, починає руйнуватись залізо (рис. 20.2).
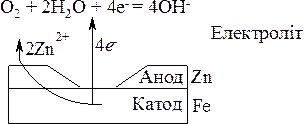
Рис. 20.2. Схема корозії залізного виробу, покритого шаром цинку.
Крім цинкових, застосовують й інші покриття залізних виробів (хромування, нікелювання), які окрім того, надають привабливого вигляду.
Для підвищення корозійної стійкості метали легують – вводять невеликі кількості легуючих добавок (найчастіше хром, нікель, марганець, берилій).
Лакофарбові покриття відзначаються вологостійкістю і забезпечують механічний захист від корозії.
Для захисту металевих конструкцій від морської води і ґрунтової корозії використовують електрохімічні методи (протекторний та електрохімічний захист).
При приєднанні до деталі протектора (лат. protector – захисник), виготовленого з активного металу виникає гальванічний елемент – метал основної конструкції захищений за рахунок корозії протектора (протекторний захист). Вироби із заліза і його сплавів захищають протекторами з цинку або магнію В міру руйнування протекторів, їх заміняють новими.
За схожим принципом діє електрохімічний захист. Металеву конструкцію приєднують до негативного полюса джерела струму за рахунок чого вона стає катодом. Позитивний полюс приєднують до допоміжного металу – аноду, який поміщають у ті ж умови, що й основний метал (грунт, воду). На поверхні основного металу відновлюються окисники зовнішнього середовища, а допоміжний метал розчиняється. Такий метод використовують для захисту трубопроводів, корпусів суден.
Радіус дії електрохімічного захисту становить до 2 км, протекторного – 50 м, тому зараз в основному використовують електрохімічний захист.
Ефективні методи хімічного захисту від корозії шляхом застосування інгібіторів корозії. Речовини, що сповільнюють корозію (інгібітори), вводять в середовище експлуатації виробу або наносять на його поверхню. Як інгібітори використовують різноманітні неорганічні (нітрити, хромати, силікати, фосфати) та органічні (уротропін) речовини.