23. ЕЛЕМЕНТИ ІIІА ГРУПИ. ЗАГАЛЬНА ХАРАКТЕРИСТИКА
23. ЕЛЕМЕНТИ ІIІА ГРУПИ. ЗАГАЛЬНА ХАРАКТЕРИСТИКА
| Сайт: | Підготовка до ЗНО - Освітній портал "Академія" |
| Курс: | Підготовка до ЗНО з хімії |
| Книга: | 23. ЕЛЕМЕНТИ ІIІА ГРУПИ. ЗАГАЛЬНА ХАРАКТЕРИСТИКА |
| Надруковано: | Гість |
| Дата: | Sunday 25 May 2025 5:22 AM |
23. ЕЛЕМЕНТИ ІIІА ГРУПИ. ЗАГАЛЬНА ХАРАКТЕРИСТИКА
До ІIІА групи належать Бор B, Алюміній Al, Галій Ga, Індій In, Талій Tl.
На зовнішньому електронному рівні вони містять два s-електрони та один р-електрон – ns2np1, де n – номер періода. Це – р-елементи – повні електронні аналоги. Електронна конфігурація атома Алюмінію:
+13Al 1s22s22р63s23р1
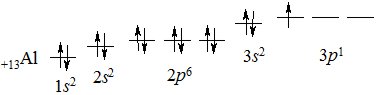
Елементи ІІІА підгрупи виявляють відновні властивості, легко віддають електрони зовнішнього електронного рівня (окиснюються) набуваючи електронної конфігурації благородного газу – Неону. У сполуках характерна валентність 3, ступінь окиснення +3 (у Бору можливий ступінь окиснення –3, у Талію +1).
У групі зверху вниз зростає атомний радіус, зменшуються енергії іонізації, зростають металічні властивості. Бор – типовий неметал, Алюміній, Галій, Індій – виявляють амфотерні властивості, Талій – нагадує лужний метал.
Серед елементів ІІІА підгрупи найбільше практичне значення має Алюміній.
23.1. Алюміній
Назва “Алюміній” походить від лат. “alumen” – галун. Галуни – перші сполуки алюмінію, які використовували ще у древньому Римі як протраву при фарбуванні тканин і обробці дерева для надання йому вогнетривких властивостей.
Поширення в природі. Алюміній – найпоширеніший метал у земній корі (біля 8%)і займає третє місце після Оксигену та Силіцію. У вільному стані Алюміній не зустрічається. Входить до складу глин, польових шпатів, слюд та інших мінералів (усього понад 250 найменувань) (табл. 23.1).
Таблиця 23.1
Деякі природні сполуки Алюмінію
|
Назва мінералу |
Формула |
|
Боксит |
K2SO4∙2Al2(SO4)3∙2Al2O3∙6H2O |
|
Корунд |
Al2O3∙nH2O |
|
Слюда* |
K2O∙2H2O∙3Al2O3∙6SiO2 |
|
Польовий шпат* |
K2O∙Al2O3∙6SiO2 |
|
Каолін (біла глина)* |
Al2O3∙2SiO2∙2H2O |
|
Нефелін* |
(Na,K)2O∙Al2O3∙2SiO2 |
|
Кріоліт |
Na3[AlF6] |
*алюмосилікати.
Одержання. Металічний алюміній вперше одержав датський фізик Г.Х Ерстед у 1820 р. при електролізі розплаву глинозему (Al2O3). У 1825 р. алюміній коштував у 1500 разів дорожче, ніж залізо (зараз лише втричі). З алюмінію були виготовлені іграшка сина Наполеона ІІІ і головний убір статуї Вашингтона. Тоді його називали “срібло із глини”. Наступні 36 років не з’явилось промислових способів одержання алюмінію. У 1855 р. А.Е. Сент-Клер Девіль (Франція) розробив промисловий спосіб одержання алюмінію відновленням алюміній хлориду металічним натрієм:
AlCl3 + 3Na = Al + 3NaCl.
Цим способом до 1890 р. одержали майже 200 т алюмінію.
На сьогодні основним промисловим способом одержання алюмінію є електроліз розплаву бокситу Al2O3∙nH2O. Температура плавлення бокситу – 2050 0С і він не розчинний у воді. Для проведення електролізу необхідно проводити процес хоча б при 1000 0С, в іншому випадку вартість добутого алюмінію надто висока для широкого використання. Ч.М. Холл (США) П. Еру (Франція) у 1886 р. з’ясували, що боксит добре розчиняється у кріоліті Na3[AlF6], температура плавлення утвореного розчину 950 0С. Його зараз використовують при виробництві алюмінію.
Електроліз проводять у залізних ємностях, вимощених зсередини вогнетривкою цеглою з вугільними блоками (катоди). На них виділяється розплавлений алюміній, а на опущених зверху вугільних анодах – кисень. Анод реагує з киснем (згорає), тому його періодично нарощують. Схеми окисно-відновних реакцій при виробництві алюмінію:
Al2O3 = 2Al3+ + 3O2–
К (–) Al3+ + 3e– = Al¯
A (+) 2O2– – 4 e– = O2
C + O2 = CO2.
Процес триває безперервно при напрузі 4 – 5 В і силі струму 150 000 А. На виробництво 1 т алюмінію витрачається 20 000 кВт∙год електроенергії. Таким способом одержують алюміній 98% чистоти, який очищають методом зонної плавки.
Фізичні властивості. Алюміній – легкий сріблясто-білий метал, з хорошою тепло- та електропровідністю, пластичний, ковкий (табл. 23.2).
Таблиця 23.2
Деякі властивості алюмінію
|
Характеристика |
Алюміній |
|
Порядковий номер |
13 |
|
Атомна маса |
26 |
|
Конфігурація зовнішнього електронного рівня |
3s23р1 |
|
Атомний радіус, пм |
143 |
|
Густина, г/см3 |
2,72 |
|
Температура плавлення, 0С |
660 |
|
Температура кипіння, 0С |
2400 |
Хімічні властивості. У вільному стані алюміній – типовий активний метал. Однак, за нормальних умов на повітрі не змінюється, що зумовлено утворенням не поверхні оксидної плівки (товщиною 10–6 см). Через це алюміній не розчиняється і у воді. Знищення плівки веде до руйнування металу. Як типовий метал, алюміній виявляє тільки відновні властивості.
І. Взаємодія з простими речовинами.
Алюміній за звичайних умов реагує лише з галогенами (з йодом за наявності слідів води). При нагріванні реагує з вуглецем, киснем, сіркою, азотом, утворюючи відповідні бінарні сполуки. При їх гідролізі утворюються відповідні сполуки неметалів з Гідрогеном та алюміній гідроксид. З воднем алюміній безпосередньо не реагує.
ІІ. Взаємодія зі складними речовинами.
1. Алюміній після руйнування захисної плівки (дією солей Hg2+, лугів або механічному пошкодженні) розчиняється у воді з утворенням алюміній гідроксиду Al(ОН)3 і виділенням водню Н2:
2Al + 6Н2О = 2Al(ОН)3 + 3Н2.
Утворений Al(ОН)3 розчиняється у надлишку лугу з утворенням гідроксоалюмінату.
2. Взаємодія з кислотами-неокисниками (HСl або розведена сульфатна) відбувається при нагріванні і веде до утворення відповідних солей і виділення водню:
2Al + 6НСl = 2AlСl3 + 3Н2; 2Al + 3Н2SO4 = 2Al2(SO4)3 + 3Н2.
У фосфатній кислоті алюміній не розчиняється через утворення нерозчинного в H3PO4 алюміній фосфату AlPO4.
При взаємодії з розведеною нітратною кислотою водень не виділяється, а утворюються продукти відновлення нітратної кислоти:
8Al + 30HNO3 = 8Al(NO3)3 + 3N2O + 15H2O.
У концентрованих сульфатній та нітратній кислотах алюміній не розчиняється, тому ці кислоти перевозять в алюмінієвій тарі.
3. Взаємодія з лугами веде до утворення комплексних сполук алюмінію – гідроксоалюмінатів:
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2,
2Al + 6NaOH + 6H2O = 2Na3[Al(OH)6] + 3H2.
Остання реакція відбувається у надлишку лугу.
Ці реакції використовують у лабораторії для одержання чистого водню.
Алюміній розчиняється і у розчинах солей, які при гідролізі створюють лужне або кисле середовище (зокрема, Na2CO3).
5. Взаємодія з оксидами металів лежить в основі методу алюмотермії:
8Al + 3Fe3O4 = 9Fe + 4Al2O3.
В ході реакції температура сягає 3500 0С, що дозволяє використовувати горіння суміші порошків алюмінію та Fe3O4 (термітну суміш) для зварювання металевих деталей (рейки, балки тощо).
23.2. Сполуки алюмінію
Найважливіше практичне значення мають оксид, гідроксид алюмінію та деякі його солі.
Алюміній оксид Al2О3 одержують взаємодією металічного алюмінію з киснем. У природі він утворює мінерал корунд.
Al2О3 – типовий амфотерний оксид, виявляє усі характерні властивості, розчиняється у кислотах і лугах (див. Оксиди):
Al2О3 + 6HCl = 2AlCl3 + 3H2O; Al2О3 + 2NaOH + 3H2O = 2Na[Al(OH)4].
При сплавленні алюмінію оксиду з твердими лугами утворюються алюмінати та ортоалюмінати:
Al2О3 + 2NaOH = 2NaAlO2 + H2O; Al2О3 + 6KOH = 2K3AlO3 + 3H2O.
Гідроліз алюмінатів та ортоалюмінатів веде до утворення гідроксоалюмінатів:
NaAlO2 + 2H2O = Na[Al(OH)4]; К3AlO3 + 6H2O = К3[Al(OH)6].
Алюміній гідроксид Al(ОН)3 одержують за реакцією:
Al2(SO4)3 + 6NH4OH = 2Al(OH)3↓ + 3(NH4)2SO4.
Через високу розчинність Al(OH)3 в лугах, їх у цій реакції не застосовують. Утворений Al(OH)3 – малорозчинний у воді драглистий осад, утворює колоїдні розчини.
Al(OH)3 – типовий амфотерний гідроксид, реагує з кислотами і з лугами:
Al(ОН)3 + 3HCl = AlCl3 + 3H2O; Al(ОН)3 + КOH = К[Al(OH)4].
Солі алюмінію та слабких кислот у розчинах повністю гідролізують:
Al2S3 + 6H2O = Al(OH)3↓ + 3H2S.
Тому у водних розчинах неможливо одержати реакціями обміну карбонат, сульфід, сульфіт та ацетат алюмінію:
Al2(SO4)3 + 6Nа2СO3 + 3Н2О= 2Al(OH)3↓ + 6Nа2SO4 + 3СО2.
Алюміній карбонат – не існує взагалі, оскільки за наявності навіть слідів води він гідролізує, а спроби позбутись води нагріванням ведуть до його термічного розкладу.
23.3. Застосування алюмінію та його сполук
Металічний алюміній використовують як відновник при добуванні деяких металів методом алюмотермії, який запропонував у 1865 р. М.М. Бекетов (Росія). Зараз цей метод використовують для одержання хрому, ванадію, марганцю. З металічного алюмінію виготовляють фольгу (пакувальний матеріал), електричні дроти, посуд, “срібну” фарбу.
У сплавах з іншими металами алюміній застосовують у машинобудуванні. Сплави алюмінію – легкі і стійкі до дії води та кисню повітря. Найпоширеніші сплави алюмінію – дюралюміній (від назви м. Дерен (Німеччина), де вперше було розпочате його промислове виробництво) – Al–Cu–Mg; силумін – Al–Si. Їх використовують у літакобудуванні.
Алюміній оксид (корунд), який за твердістю поступається алмазу, карборунду (SiC) та ельбору (BN) використовують для виготовлення абразивних матеріалів (шліфувальні круги, наждачний папір). Корунд з домішками іонів металів утворює дорогоцінні камені: сапфір (домішки іонів заліза і титану), рубін (хрому). Зараз налагоджене штучне добування рубінів та сапфірів, які широко використовують у різних галузях техніки (годинники “на 15 каменях”).
Алюміній гідроксид входить до складу препарату Алмагель (у суміші з магній гідроксидом).
Сульфат та гідроксид алюмінію використовують для очистки води. Алюмокалієвий галун KAl(SO4)2∙12H2O використовують при дубленні шкір, фарбуванні тканин.