24. ФЕРУМ. ЗАЛІЗО
24. ФЕРУМ. ЗАЛІЗО
| Сайт: | Підготовка до ЗНО - Освітній портал "Академія" |
| Курс: | Підготовка до ЗНО з хімії |
| Книга: | 24. ФЕРУМ. ЗАЛІЗО |
| Надруковано: | Гість |
| Дата: | Saturday 26 April 2025 12:56 PM |
24.1. ФЕРУМ. ЗАЛІЗО. ВЛАСТИВОСТІ
Ферум – представник перехідних елементів, знаходиться у VIIIB підгрупі Періодичної системи хімічних елементів.
Електронна будова атома Феруму 1s22s22р63s23р63d64s2:
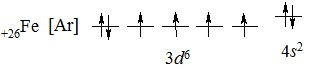
На зовнішньому електронному рівні атом Феруму містить два s-електрони, заповнюється 3d-підрівень, тому Ферум – d-елемент. У хімічних реакціях він віддає 2 електрони з 4s-підрівня з утворенням іона Fe2+, який при відщепленні одного електрона з 3d-підрівня утворює іон Fe3+. Менш характерним є ступінь окиснення +6. За рахунок вільних d-орбіталей Ферум утворює комплексні сполуки з координаційними числами 4, 6 і 8.
Назва “Ферум” походить від лат. “firmus” – міцний. Залізо – один з металів, відомий людству ще з ІХ – VII ст. Першим джерелом заліза були метеорити, згодом люди навчились виплавляти його з руд. У ті часи вартість міді, срібла, золота і заліза відносились як 1:160:1280:6400. Це було зумовлено, з одного боку, рідкістю метеоритного заліза і поширеністю самородних міді, срібла і золота, а з іншого – практичним застосуванням заліза для виготовлення зброї, сільськогосподарських інструментів тощо. В “Одисеї” Гомер згадує, як переможця спортивних ігор Ахіллеса нагородили шматком заліза і шматком золота.
Поширення в природі. Ферум – другий (після Алюмінію) за поширенням метал та четвертий (після Оксигену, Силіцію та Алюмінію) у земній корі (5,2%) елемент. Зустрічається у вільному стані (метеоритне залізо) та у вигляді сполук (табл. 24.1), які використовують для промислового одержання заліза.
Велика кількість самородного заліза (30%) метеоритного походження знаходиться на поверхні Місяця. Через відсутність там атмосфери з окисниками (кисень, вода) усі елементи перебувають у нижчих ступенях окиснення. При виверженні вулканів на Місяці утворюється самородне залізо шляхом відновлення мінералів за високої температури та глибокого вакууму.
Таблиця 24.1
Деякі природні сполуки Феруму
|
Назва мінералу |
Формула |
|
Бурий залізняк (лимоніт) |
2Fe2O3∙3H2O |
|
Залізний колчедан (пірит) |
FeS2 |
|
Магнітний залізняк (магнетит) |
Fe3O4 (або FeO∙Fe2O3; Fe(FeO2)2) |
|
Червоний залізняк (гематит) |
Fe2O3 |
|
Залізний шпат (сидерит) |
FeСO3 |
Пірит рідко використовують для добування заліза, він є основною сировиною для одержання сульфатної кислоти.
Одержання. Сучасні промислові способи переробки залізних руд описані в п. Чавун і сталь.
Залізо високої чистоти одержують прямим відновленням Fe2O3:
Fe2O3 + 3H2 = Fe + 3H2O,
або термічним розкладом (150 – 200 0С, 10МПа) ферум пентакарбонілу:
[Fe(CO)5] = Fe + 5CO.
Фізичні властивості. Чисте залізо – сріблясто-білий метал, з хорошою тепло- та електропровідністю, пластичний, ковкий (табл. 24.2).
Таблиця 24.2
Деякі властивості Феруму і заліза
|
Характеристика |
Ферум і залізо |
|
Порядковий номер |
26 |
|
Атомна маса |
56 |
|
Конфігурація зовнішнього електронного рівня |
3d64s2 |
|
Атомний радіус, пм |
126 |
|
Густина, г/см3 |
7,87 |
|
Температура плавлення, 0С |
1539 |
|
Температура кипіння, 0С |
2870 |
На вологому повітрі залізо тьмяніє, утворюючи пухку плівку гідроксиду, яка не перешкоджає подальшому окисненню металу. Залізо виявляє феромагнітні властивості (речовини, що притягуються магнітом – феромагнетики). Механічні властивості заліза визначаються наявністю домішок, зі зростанням їх кількості якість металу погіршується.
Залізо утворює кілька кристалічних модифікацій, стійких за певної температури (після 768 0С залізо втрачає феромагнітні властивості):
![]()
При зниженні температури відбувається зворотній процес.
Хімічні властивості визначаються наявністю домішок. Чисте залізо – метал середньої активності. Біля м. Делі (Індія) стоїть залізна колона висотою 7 м і масою 6,5 т без жодних слідів корозії, хоча її вік – понад 2800 р. Колона виготовлена із заліза чистотою 99,72%, стійкого до корозії.
Для Феруму характерне утворення сполук Fe+2 i Fe+3, що відповідають оксидам FeO і Fe2O3. Відомі солі фератної кислоти H2FeO4, у яких ступінь окиснення Феруму +6.
І. Взаємодія з простими речовинами.
Залізо при нагріванні реагує з киснем, сіркою, галогенами, вуглецем та азотом з утворенням відповідних бінарних сполук:
3Fe + 2O2 = Fe3O4 (або FeO + Fe2O3); 2Fe + 3Cl2 = 2FeCl3;
Fe + S = FeS; 3Fe + C = Fe3C; 2Fe + N2 = 2FeN
З воднем залізо безпосередньо не реагує.
ІІ. Взаємодія зі складними речовинами.
1. Залізо за нормальних умов реагує з водою і киснем:
4Fe + 3O2 + 6H2O = 4Fe(OH)3
Цей процес – корозія заліза детально розглянуто у п. Корозія металів.
2. Взаємодія з кислотами-неокисниками (HСl або розведена сульфатна) відбувається за нормальних умов і веде до утворення відповідних солей та виділення водню:
Fe + 2НСl = FeCl2 + Н2; Fe + Н2SO4 = FeSO4 + Н2.
3. Взаємодія з кислотами-окисниками (концентрована сульфатна, розбавлена та концентрована нітратна кислоти) веде до утворення солей Fe3+:
Fe + 4HNO3р. = Fe(NO3)3 + NO + H2O;
2Fe + 6H2SO4 = Fe2(SO4)3 + 3SO2 + 6H2O.
Кислоти високих концентрацій пасивують метал, взаємодія не відбувається і тому концентровані HNO3 і H2SO4 перевозять у залізних цистернах.
4. Розпечене до червона залізо реагує з водяною парою:
3Fe + 4H2O = Fe3O4 + 4H2.
5. Залізо витісняє метали, які розташовані після нього у ряду стандартних електродних потенціалів з водних розчинів їх солей:
Fe + CuSO4 = FeSO4 + Cu.
24.2. Сполуки феруму (ІІ)
Найважливіше практичне значення серед сполук феруму (ІІ) мають оксид FeO, гідроксид Fe(OH)2 та солі Fe2+.
Ферум (ІІ) оксид FeО – чорний порошок, легко окиснюється, виявляє основні властивості. Одержують відновленням Fe2O3:
Fe2O3 + H2 = 2FeO + H2O; Fe2O3 + CO = 2FeO + CO2.
Одержати FeO безпосередньою взаємодією елементів неможливо.
При розчиненні FeO у кислотах-неокисниках утворюються солі Fe2+:
FeO + 2HCl = FeCl2 + H2O.
Ферум (ІІ) гідроксид Fe(ОН)2 – утворюється у вигляді білого осаду або пластівців при дії лугів на солі Fe2+:
FeSO4 + 2NaOH = Fe(OH)2↓ + Na2SO4.
Fe(OH)2 неможливо безпосередньо одержати взаємодією металічного заліза або FeO з водою.
При стоянні на повітрі Fe(OH)2 окиснюється і його колір змінюється із білого до зеленуватого, а потім до бурого Fe(OH)3:
4Fe(OH)2 + О2 + 2Н2О = 4Fe(OH)3.
Fe(OH)2 виявляє основні властивості, реагує з розбавленими кислотами з утворенням солей Fe2+:
Fe(OH)2 + H2SO4 = FeSO4 + 2H2O.
Солі Fe2+ значно гідролізують, рН < 7 (у водних розчинах):
FeCl2 + H2O ↔ FeOHCl + HCl
Термічне розкладання Fe(OH)2 і деяких солей Fe2+ (FeSO4, FeCO3, FeC2O4) веде до утворення виключно Fe2O3:
2FeSO4 = Fe2O3 + SO2 + SO3; 2FeC2O4 = Fe2O3 + CO2 + 3CO.
Солі феруму (ІІ) одержують взаємодією FeO або Fe(OH)2 з відповідними кислотами. Вони виявляють відновні властивості, переходячи у солі Fe3+:
10FeSO4 + 2KMnO4 + 8H2SO4 = 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O;
2FeCl2 + Cl2 = 2FeCl3.
Аналогічний процес відбувається про розчиненні Fe(OН)2 у концентрованій HNO3 або H2SO4:
3Fe(OН)2 + 10HNO3 = 3Fe(NO3)3 + NO + 8H2O.
Взаємодія Fe3O4 з розбавленими кислотами дає суміш солей Fe2+ та Fe3+:
Fe3O4 (або FeO∙Fe2O3) + 8HCl = FeCl2 + 2FeCl3 + 4H2O.
Кислоти-окисники у цій реакції утворюють лише солі Fe3+:
3Fe3O4 + 28HNO3 = 9Fe(NO3)3 + NO + 14H2O.
24.3. Сполуки феруму (ІІІ)
Розглянемо оксид Fe2O3 та гідроксид Fe(OH)3.
Ферум (ІІІ) оксид Fe2О3 – порошок темно-червоного кольору. Одержують прожарюванням Fe(OН)3:
2Fe(OН)3 = Fe2O3 + 3Н2О.
При розчиненні Fe2O3 у кислотах утворюються розчини солей Fe3+ жовто-коричневого кольору:
Fe2O3 + 6HCl = 2FeCl3 + 3H2O.
Ферум (ІІІ) гідроксид Fe(ОН)3 – червоно-жовтий порошок, одержують дією лугів на солі Fe3+:
FeCl3 + 3NaOH = Fe(OH)3↓ + 3NaCl.
Fe(OH)3 реагує з кислотами з утворенням солей Fe3+:
2Fe(OH)3 + 3H2SO4 = Fe2(SO4)3 + 6H2O.
Солі Fe3+ значно гідролізують, рН < 7 (у водних розчинах).
Нагрівання Fe(OH)3 і деяких солей Fe3+ веде до утворення Fe2O3:
Fe2(SO4)3= Fe2O3 + 3SO3.
Окисні властивості солей Fe3+ виявляються у реакції з йодид-іонами І–:
Fe3+ + 2I– = Fe2+ + I2.
Розчин набуває бурого кольору за рахунок виділення елементного йоду. Через це неможливо добути FeI3 реакціями обміну.
24.4. Сполуки феруму (VI)
Солі фератної кислоти H2FeO4 (ферати) утворюються при окисненні сполук Fe3+:
Fe2O3 + 3KNO3 + 4KOH = 2K2FeO4 + 3KNO2 + 2H2O;
Fe(OH)3 + 3Cl2 + 10KOH = 2K2FeO4 + 6KCl + 8H2O.
Фератну кислоту у вільному стані не добуто. Ферати – сильніші окисники, ніж перманганат-іон, здатні окиснити амоніак до вільного азоту, хром (ІІІ) – у дихромат-іони.
24.5. Якісні реакції на іони Fe2+ і Fe3+
Характерною реакцією на іон Fe3+, що відрізняє його від іона Fe2+ є взаємодія з розчином калій роднаніду KSCN або амоніаку NH4SCN з утворенням криваво-червоного малорозчинного осаду ферум (ІІІ) роданіду Fe(SCN)3, який при надлишку роданід-іонів утворює комплексний аніон – гексароданоферат (ІІІ) [Fe(SCN)6]3–:
Fe3+ + 3SCN– = Fe(SCN)3↓, Fe(SCN)3 + 3SCN– = [Fe(SCN)6]3–.
Іони Fe2+ у цих умовах утворюють безбарвні розчини ферум (ІІ) роданіду Fe(SCN)2.
При дії на солі Fe2+ надлишку розчину калій ціаніду KCN утворюється калій гексаціаноферат (ІІ) K4[Fe(CN)6] (жовта кров’яна сіль):
FeCl2 + 6KCN = K4[Fe+2(CN)6] + 2KCl.
Розчин K4[Fe(CN)6] не дає кольорових реакцій з іонами Fe2+, і є реагентом для виявлення катіонів Fe3+:
K4[Fe(CN)6] + FeCl3 = KFe+3[Fe+2(CN)6] + 3KCl.
Утворюється нерозчинний у воді калій ферум (ІІІ) гексаціаноферат (ІІ) KFe[Fe(CN)6], характерного синього кольору (берлінська лазур).
При окисненні жовтої кров’яної солі утворюється червона кров’яна сіль – калій гексаціаноферат (ІІІ) у вигляді червоних кристалів:
2K4[Fe+2(CN)6] + Cl2 = 2K3[Fe+3(CN)6] + 2KCl.
При дії червоної кров’яної солі на катіони Fe2+ утворюється синій осад турнбулевої сині – калій ферум (ІІ) гексаціаноферату (ІІІ) KFe+2[Fe+3(CN)6]:
K3[Fe+3(CN)6] + FeCl2 = KFe+2[Fe+3(CN)6] + 2KCl.
У берлінській лазурі та турнбулевій сині іони Fe2+ та Fe3+ входять до різних сфер комплексних сполук.
При взаємодії K3[Fe(CN)6] з іонами Fe3+ утворюється зелено-бурий розчин.
24.6. Застосування заліза та його сполук
Основну масу заліза використовують для виготовлення сплавів (див. Чавун і сталь).
Велике біологічне значення заліза. Його вміст в організмі людини 1∙10‑5% (4 – 5 г), з яких 60 – 73% входить до складу гемоглобіну і дихальних ферментів – цитохромів. Залізо у складу гемоглобіну бере участь у перенесенні кисню від органів дихання до тканин і вуглекислого газу – у зворотному напрямку. Залізо у складі гемоглобіну перебуває у ступені окиснення +2, який на всьому шляху транспорту не змінюється.
Добова потреба заліза для людини – 15 – 20 мг. Нестача заліза веде до залізодефіцитної анемії (малокрів’я) – зменшення кількості еритроцитів та гемоглобіну в крові. Граф А.П. Бестужев-Рюмін (1693 – 1766) – канцлер імператриці Єлизавети і генерал-фельдмаршал Катерини ІІ запропонував як тонізуючу добавку і джерело поповнення заліза в організмі “бестужевські краплі” – розчин FeCl3 в суміші етанолу С2Н5ОН і діетилового етеру (С2Н5)2О.
24.7. Чавун і сталь
Сучасний розвиток техніки важко уявити без використання найважливіших сплавів заліза – чавуну і сталі. За рік виробництво заліза та його сплавів перевищує виробництво усіх інших металів разом узятих.
У техніці залізо та його сплави (чавуни і сталі) називають чорними металами, а їх виробництво – чорною металургією.
Виробництво чавуну.
Чавун виробляють у доменних печах, викладених зсередини вогнетривкою цеглою. Їх висота сягає 30 м, внутрішній діаметр – 12 м (рис.24.1). Доменна піч складається з шахти (І) – верхня частина печі, обмежена зверху отвором – колошником (ІІ). Найширша частина печі – розпар (ІІІ), нижня частина – горн (IV). Отвори для подачі повітря або кисню – фурми (V).
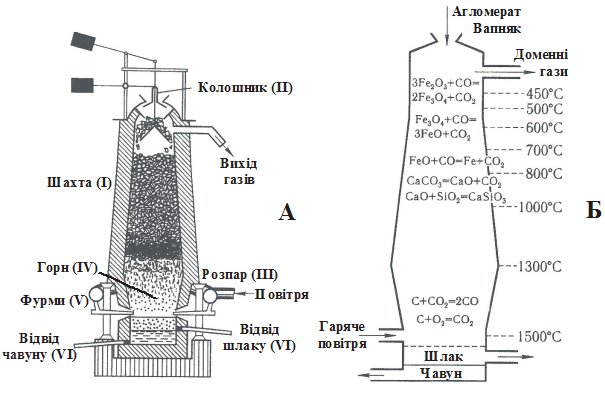
Рис. 24.1. Схема доменної печі (А) і хімічні реакції, що відбуваються у різних її частинах (Б).
Піч через колошник пошарово завантажують коксом, агломератом (залізна руда, сплавлена з флюсом*) і знову коксом. Температуру в печі підтримують вдуванням у горн через фурми підігрітого повітря або кисню. Кокс згорає в горні, утворюючи карбон (IV) оксид СО2, який у свою чергу реагуючи з коксом дає карбон (ІІ) оксид СО. Карбон (ІІ) оксид відновлює залізну руду, перетворюючись в СО2. Сумарний (постадійно див. рис. 20.1) процес відновлення руди в доменній печі описується схемою:
Fe2O3 + 3CO = 2Fe + 3CO2.
Одержання чавуну відбувається у 1,5 рази швидше при вдуванні замість повітря кисню. При цьому витрати коксу зменшуються на 25%.
Відновлене залізо у розплавленому стані опускається донизу (в розпар), де розчиняє вуглець коксу (утворюється Fe3C – цементит). Чавун стікає в горн, над ним збирається шлак (СaSiO3), запобігаючи окисненню чавуну. Чавун і шлак у міру накопичення випускають через отвори (VI).
Доменна піч працює безперервно протягом кількох років. Її за потребою довантажують коксом і агломератом. У печі об’ємом 2000 м3 за добу використовують 7000 т агломерату і 2000 т коксу, при цьому одержують 4000 т чавуну (2,5 т/хв).
Виробництво сталі.
Існує кілька способів переробки чавуну у сталь. Усі вони полягають у зменшенні в чавуні вмісту вуглецю і домішок.
Першою промисловою установкою для виробництва сталі у XVIIІ ст. стала пудлінгова піч, винайдена в Англії. Такі печі були малопотужні і на зміну їм у 1856 р. заступили конвертери, винайдені Г. Бесемером (Англія). Їх робота базувалась на продуванні повітря через шар розплавленого чавуну, при цьому вигорали деякі домішки. Проте, залишались домішки фосфору і сірки, які збільшували крихкість сталі. Позбавитись їх дала можливість пропозиція С.Д. Томаса (Англія) використовувати для зв’язування домішок вапняк СаСО3. Утворений шлак, що містив кальцій сульфат та фосфат (томасшлак), використовували як мінеральне добриво.
У 1865 р. батько і син П. та Е. Мартени створили піч (мартенівську) з подачею підігрітого повітря, що дозволило одержати рідку (а не тістоподібну) сталь, яка легко виливалась у форми. За прізвищем авторів, таку піч назвали мартенівською, а спосіб – мартенівським.
Сучасний киснево-конверторний спосіб одержання сталі вперше використали у 1954 р. в Австрії. Кисень подавали над розплавом, домішки вигорали і підтримували дуже високу температуру розплаву. Для її зниження у розплав вводили скрап (англ. scrap – металобрухт). На сьогодні цей процес одержання сталі є найперспективнішим.
На початку ХХ ст. запропоновано електрохімічний спосіб одержання сталі. Через суміш чавуну і шлаку пропускають електричну дугу, при цьому температура сягає 4000 0С і вигорають усі домішки.
В останні роки набув поширення спосіб прямого відновлення залізних руд, минаючи стадію одержання чавуну. Для цього використовують суміш природного газу з повітрям або киснем. Основний компонент газу – метан СН4, при неповному окисненні утворює СО:
CH2 + O2 = 2CO + 2H2.
Продукти реакції відновлюють руду, утворюючи губчате залізо. Його переплавляють в електропечах і одержують сталь.
Чавун.
Чавун – сплав заліза з вуглецем (понад 2,14%). Чавуни класифікують за складом та механічними властивостями (схема 24.1).
Схема 24.1
Класифікація сплавів заліза з вуглецем
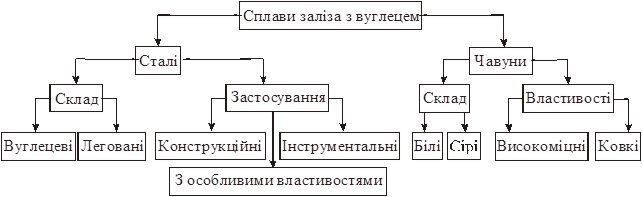
За складом розрізняють чавуни:
Білі – містять увесь вуглець у формі цементиту Fe3C – твердий крихкий матеріал, використовують для добування сталі.
Сірі – увесь вуглець (до 3,8%) перебуває у формі графіту, використовують для виготовлення прокатних виробів.
За механічними властивостями розрізняють чавуни:
Високоміцні – одержують додаванням до сірого чавуну магнію (до 0,08%), використовують для виготовлення зносостійких елементів (колінвали, вентилі, насоси).
Ковкі – одержують із білого чавуну, використовують для виробництва ударостійких елементів (задні мости автомобілів, сільськогосподарського обладнання).
Сталь.
Сталь – сплав заліза з вуглецем (не більше 2,14%). Сталі класифікують за складам і за використанням (схема).
За складом розрізняють сталі:
Вуглецеві – містять крім заліза і вуглецю фосфор і сірку, використовують для виготовлення прокатних деталей.
Леговані – містять легуючі елементи – добавки (хром, нікель, марганець, ванадій, молібден та ін.), які вводять у певних кількостях до складу сталей для зміни їх хімічних та механічних властивостей. Вони утворюють сполуки із залізом та вуглецем.
За механічними властивостями розрізняють сталі:
Конструкційні – використовують для виготовлення деталей машин, конструкцій і споруд. Можуть бути вуглецеві і леговані (найчастіше хром, нікель, марганець – 1 – 1,5%).
Інструментальні – використовують для виробництва ріжучих та вимірювальних інструментів. Це – леговані (хром, ванадій, вольфрам) сталі.
Сталі з особливими властивостями – нержавіючі, жаростійкі, жароміцні, магнітні та ін.
Нержавіючі– стійкі до корозії за нормальних умов (вода, кислоти).
Жаростійки – стійкі до корозії за високих температур.
Жароміцні – зберігають механічні властивості при високих температурах.
Магнітні – виявляють феромагнітні властивості (леговані хромом і вольфрамом).
* Флюс – вапняк CaCO3, який додають до залізної руди для видалення домішок кремнезему SiO2 у вигляді шлаку: CaCO3 + SiO2 = CaSiO3 + CO2.