25 - 27. Природа органічних сполук
Природа органічних сполук
| Сайт: | Підготовка до ЗНО - Освітній портал "Академія" |
| Курс: | Підготовка до ЗНО з хімії |
| Книга: | 25 - 27. Природа органічних сполук |
| Надруковано: | Гість |
| Дата: | Tuesday 1 July 2025 9:07 AM |
Предмет органічної хімії
Поняття «органічна речовина» та «органічна хімія» ввів у 1827 р. шведський хімік Є.Я. Берцеліус (1779–1848). Він визначив органічну хімію як хімію речовин рослинного або тваринного походження. Ці речовини (вино, цукор, оцет, ефірні масла, барвники) були відомі людству з давніх часів. У XVIII ст. хіміки визначили, що вони складаються з небагатьох елементів: вуглецю, водню, кисню, азоту, сірки та фосфору (останні чотири елементи трапляються не в усіх органічних речовинах).
Однак на той час вчені могли лише виділяти органічні речовини із продуктів життєдіяльності організмів і аналізувати їх, але не знали їх будови, не вміли добувати штучно (синтезувати).
У 1828 р. німецький вчений Ф. Велер (1800–1882), нагріваючи водний розчин ціанату амонію NH4NCO, який вважався мінеральною речовиною, одержав сечовину (NH2)2CO – продукт життєдіяльності тваринних організмів. Російський вчений М. Зінін (1812–1880) у 1832 р. синтезував анілін C6H5NH2, який раніше був виділений з природного барвника індиго. У 1848 р. німецький хімік Г. Кольбе (1818–1887) і англійський хімік Е. Франкланд (1818–1889) синтезували оцтову кислоту.
Французький хімік М. Бертло (1827–1907) у 1854 р. штучним шляхом добув жири. У 1861 р. російський хімік О. Бутлеров синтезував цукристу речовину. Так поступово вчені дійшли висновку, що органічні речовини утворюються за тими ж законами, що і неорганічні.
Зараз органічними речовинами вважають сполуки вуглецю з іншими елементами, а органічну хімію визначають як хімію сполук вуглецю. Чіткого розмежування між органічними й неорганічними речовинами не існує. Так, для деяких сполук вуглецю (оксиди, карбіди, солі вугільної кислоти) характерні типові властивості неорганічних речовин, тому вони вивчаються в курсі неорганічної хімії.
Однак органічну хімію виділяють як окрему науку, бо органічні речовини відрізняються від неорганічних.
Кількість органічних речовин надзвичайно велика – близько 7 мли, а неорганічних набагато менша – їх налічується кілька сотень тисяч.
Органічні речовини є основним матеріалом (крім води), з якого побудовані організми рослин і тварин. Вони не такі стійкі, як неорганічні речовини, легко змінюються під час нагрівання, більшість з них горючі.
Хімічні реакції між органічними речовинами відбуваються повільніше, ніж між неорганічними.
Для органічних речовин характерне явище ізомерії. Ізомерами називають речовини, які мають однакові якісний, кількісний склад і молекулярну масу, але різну будову, і тому – різні фізичні та хімічні властивості. Прикладом таких речовин є диметиловий ефір і етиловий спирт. Вони мають однакову брутто-формулу С2Н6О і температури кипіння – 23,6 °С і 78,4 °С. Спирт реагує з лужними металами, а ефір не реагує.
На сьогодні синтезовано багато органічних речовин, які утворюються в рослинних і тваринних організмах (вітаміни, гормони, барвники), а також сполуки, що в природі не трапляються (штучні та синтетичні волокна, синтетичний каучук, пластичні маси, отрутохімікати, антибіотики, ліки тощо).
Теорія хімічної будови органічних сполук O. Бутлерова
Теорія хімічної будови органічних сполук O. Бутлерова
Науковою основою органічної хімії є теорія хімічної будови, яку створив російський вчений О. Бутлеров. У 1858–1861 рр. він сформулював основні положення цієї теорії.
1. Атоми розташовані в молекулах не безладно, а сполучені один з одним хімічними зв’язками у певній послідовності, відповідно до їх валентності.
2. Властивості речовин залежать не тільки від їх якісного та кількісного складу, але й від хімічної будови молекул.
3. Атоми або групи атомів у молекулах взаємно впливають один на одного, безпосередньо або через інші атоми.
Розглянемо докладніше положення теорії хімічної будови O. Бутлерова.
Перше положення. До О. Бутлерова вчені вважали, що склад однієї сполуки можна виражати різними формулами, а будову речовин неможливо пізнати. Так, А. Кекуле користувався 20 формулами оцтової кислоти. Більшість вчених взагалі не вірила в існування атомів і молекул.
О. Бутлеров вважав, що атоми та молекули реально існують. Він узагальнив відомі на той час наукові факти та поняття: відкриття валентності елементів (Е. Франкланд, 1858), встановлення чотиривалентності вуглецю (А. Кекуле, 1857), відкриття здатності атомів вуглецю сполучатися один з одним (А. Купер, А. Кекуле, 1857), пропозицію позначати хімічні сили зчеплення атомів валентним штрихом (А. Купер, 1858), уточнення понять «атом», «молекула» (Перший міжнародний конгрес хіміків, 1860).
О. Бутлеров ввів поняття «хімічна будова речовин». Хімічною будовою він назвав послідовність зв’язків атомів у молекулі
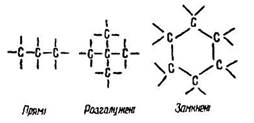
Вуглець у органічних сполуках є чотиривалентним. Атоми вуглецю можуть сполучатися у ланцюги різних конфігурацій:
О. Бутлеров стверджував, що кожна органічна речовина має певну хімічну будову, що виражається лише однією структурною формулою, яку можна записати у розгорнутому або скороченому вигляді. Наприклад, порядок сполучення атомів у молекулах етану С2Н6, етилену С2Н4 і ацетилену С2Н2 зображують так:
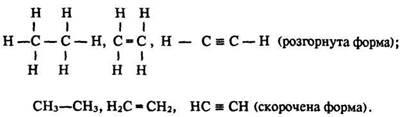
Структурні формули відображають тільки послідовність сполучення атомів, а не їх розміщення в просторі. Тому формули бутану:
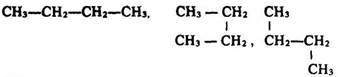
є однією структурною формулою, оскільки порядок сполучення атомів вуглецю в них однаковий.
За структурною формулою речовини можна встановити її властивості. Хімічну будову сполуки визначають шляхом вивчення її хімічних властивостей та реакцій утворення.
Друге положення. Довгий час вчені не могли пояснити явище ізомерії. О. Бутлеров встановив, що ізомери виявляють різні властивості (фізичні та хімічні), тому що мають різну будову. Дійсно, такі ізомери, як диметиловий ефір і етиловий спирт, мають однаковий склад, але різні властивості внаслідок різної хімічної будови. Хімічна будова цих речовин виражається різними структурними формулами.
O. Бутлеров передбачав існування двох ізомерів бутану С4Н10, трьох – пентану С5Н12, а також ізомерів різних спиртів. У 1864 р. він синтезував третинний бутанол:
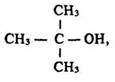
а в 1866 р. – ізобутан:
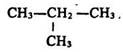
Теорія хімічної будови пояснила причину різноманітності сполук вуглецю. Цією причиною є існування ізомерії, а також здатність чотиривалентного вуглецю утворювати ланцюги, які можуть замикатися в кільця.
Третє положення. З неорганічної хімії відомо, що водень у воді Н2O, хлороводневій кислоті НСl та аміаку NН3 має різні властивості. З хлороводневої кислоти його легко можуть витіснити різні метали, з води – лише лужні та лужноземельні, а з аміаку водень витіснити дуже важко. Це явище обумовлене різним впливом на водень атомів кисню, хлору, азоту.
О. Бутлеров вважав, що під час утворення молекул атоми взаємодіють, надаючи один одному частину своєї хімічної
спорідненості. У молекулах створюється певний порядок розміщення хімічної спорідненості. Тому властивості одного й того ж елемента в різних сполуках різні і відмінні від властивостей ізольованого атома. Положення про взаємний вплив атомів є найважливішим у теорії хімічної будови.
Таким чином, під поняттям «хімічна будова» О. Бутлеров розумів не лише певний порядок сполучення атомів у молекулі, але й порядок їх взаємного впливу. Вчений ще не знав, як відбувається взаємний вплив атомів у молекулі, але розумів, що молекула не є простою сумою атомів, хоча і з’єднаних у певному порядку.
Теорія хімічної будови мала велике значення для наукового розуміння природи, розвитку хімічної науки та промисловості. Її положення стосуються будови органічних і неорганічних речовин.
Сучасна електронна теорія будови речовини підтвердила правильність теорії О. Бутлерова, пояснила природу хімічного зв’язку в органічних сполуках і природу взаємного впливу атомів у молекулах. Атоми в молекулах органічних сполук з’єднані переважно ковалентними простими сигма-зв’язками або кратними сигма та пі-зв’язками (п. 6.1). Чотиривалентність вуглецю визначається електронною будовою його атомів.
Властивості речовин залежать не тільки від їх складу, але й від природи хімічного зв’язку. Під час утворення хімічних зв’язків змінюється електронна будова атомів. Природа їх взаємного впливу обумовлена поляризацією ковалентних зв’язків внаслідок різних електронегативностей атомів (п. 6.2).
Класифікація органічних сполук
Класифікація органічних сполук
Залежно від складу та будови вуглецевого ланцюга органічні сполуки поділяють на ациклічні та циклічні.
Ациклічними є сполуки, молекули яких складаються з відкритих (незамкнених) вуглецевих ланцюгів – прямих або розгалужених:
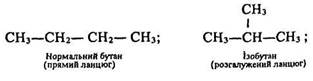

Ациклічні сполуки називають аліфатичними або сполуками жирного ряду. їх поділяють на насичені та ненасичені.
Сполуки з простими сигма-зв’язками (С–С) є насиченими, а з кратними сигма-пі-зв’язками (С=С) – ненасиченими.
Етан, бутан та ізобутан – ненасичені сполуки, етилен, ацетилен, дивініл, ізопрен – ненасичені.
Циклічними називають сполуки, молекули яких складаються із замкнених у кільця вуглецевих ланцюгів:
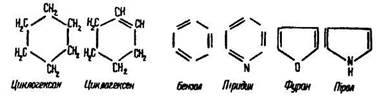
Циклічні сполуки поділяються на карбо- та гетероциклічні. Карбоциклічними (ізоциклічними) називають сполуки, замкнені ланцюги яких містять лише атоми вуглецю (наприклад, циклогексан, циклогексен, бензол). Розрізняють такі карбо- циклічні сполуки: аліциклічні (насичені та ненасичені) та ароматичні. Так, циклогексан – насичена аліциклічна сполука, циклогексен – ненасичена аліциклічна, бензол – ароматична сполука.
Гетероциклічними є сполуки, замкнені ланцюги яких містять, крім атомів вуглецю, атоми інших елементів – кисню, азоту, сірки тощо. До них належать фуран, піридин, пірол.
Хімічні властивості органічних сполук залежать, перш за все, від характеру зв’язків і наявності в їх молекулах різних функціональних груп.
Функціональними називають групи атомів, що надають речовинам певних хімічних властивостей: –ОН (гідроксигрупа),
–NН2 (аміногрупа), –NO2 (нітрогрупа), >С=O (карбонільна група), –СHO (альдегідна група), –СOOH (карбоксильна група) та ін. За наявністю в молекулі функціональної групи всі органічні Речовини поділяють на класи (табл. 50).
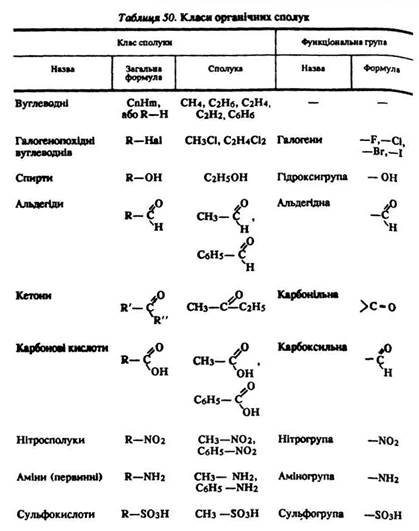
Номенклатура
В органічній хімії вживають тривіальні назви речовин і назви, складені на основі різних номенклатур: раціональної, женевської (систематичної), міжнародної (IUPAC) та ін. Тривіальні назви виникли в давні часи (мурашина, оцтова, винна, яблучна кислоти).
В основу раціональної номенклатури покладено назви найпростіших сполук. Інші речовини розглядаються як їх похідні, в яких атоми водню заміщені радикалами. Так, за цією номенклатурою всі насичені вуглеводні є похідними метану СН4, насичені спирти – похідними карбінолу (метилового спирту), наприклад СН3–СН2–СН3 – диметилметан, СН3–ОН – карбінол, СН3–СН2–ОН – метил карбінол. Однак раціональна номенклатура не може охопити назв усіх ізомерів.
У 1957 р. на конференції IUPAC у Парижі було розроблено нову міжнародну номенклатуру «Правила IUPAC». Ця номенклатура постійно вдосконалюється. В її основу покладено назви насичених вуглеводнів. Клас сполук позначається функціональним закінченням. Наприклад, назви ациклічних насичених вуглеводнів мають закінчення –ан (СН4 метан, С3Н8 пропан), ациклічних ненасичених вуглеводнів –єн або –ін (С3Н6 пропен, С3Н4 пропін), спиртів –ол (С2Н5ОН етанол), альдегідів –аль (С2Н5–СОН пропаналь) тощо.
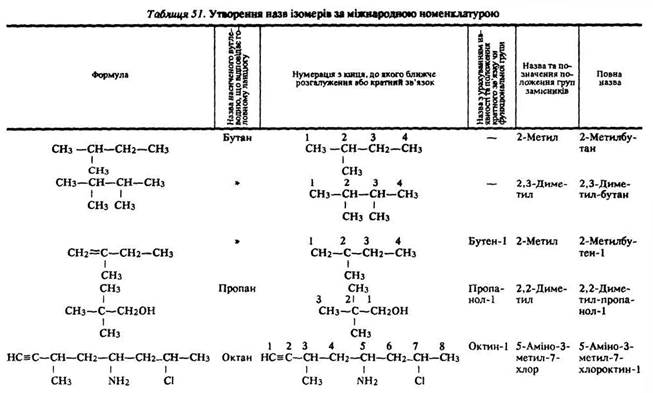
Назви ізомерних сполук утворюються таким чином:
а) вибирають найдовший нерозгалужений вуглецевий ланцюг (головний), що містить найбільше число функціональних груп або кратний зв’язок, характерний для даного гомологічного ряду;
б) вуглеводневі радикали і функціональні групи, які знаходяться в бічному ланцюзі, розглядаються як замісники атомів водню головного ланцюга;
в) ланцюг нумерують, починаючи з того кінця, до якого ближче функціональна група або кратний зв’язок головного ланцюга, замісник у бічному ланцюзі;
г) називають насичений вуглеводень, що відповідає головному ланцюгу, і змінюють або додають закінчення залежно від наявності кратного зв’язку або функціональної групи в головному ланцюзі; положення кратного зв’язку і функціональної групи головного ланцюга позначають цифрою після кореня слова – назви;
д) положення замісників у бічному ланцюзі позначають номером вуглецевого атома, біля якого знаходиться замісник.
Номер з назвою замісника ставлять на початку назви речовини. Якщо замісників кілька, цифрами позначають кожний з них і розташовують їх назви у алфавітному порядку (табл. 51).
В органічній хімії зараз вживаються назви речовин, утворені за всіма номенклатурами, однак бажано дотримуватися міжнародної номенклатури.