28. Насичені вуглеводні
Насичені вуглеводні
| Сайт: | Підготовка до ЗНО - Освітній портал "Академія" |
| Курс: | Підготовка до ЗНО з хімії |
| Книга: | 28. Насичені вуглеводні |
| Надруковано: | Гість |
| Дата: | Sunday 25 May 2025 5:26 AM |
Вуглеводні
Вуглеводні – найпростіші органічні сполуки. Вони складаються з двох хімічних елементів – вуглецю та водню. Залежно від характеру зв’язків між атомами у вуглеводневому ланцюзі їх поділяють на насичені, ненасичені та ароматичні.
Визначення. Вуглеводні, в молекулах яких атоми вуглецю зв’язані між собою простим зв’язком, а інші їх валентності, насинені атомами водню, називають насиченими.
Класифікація. Насичені вуглеводні можуть бути ациклічними (аліфатичними) та аліциклічними.
Насичені ациклічні вуглеводні
Визначення. Алкани – це насичені вуглеводні з відкритим ланцюгом. Вони утворюють гомологічний ряд із загальною формулою СnН2n+2.
Гомологічним рядом називається послідовність подібних за своєю будовою та хімічними властивостями речовин, що відрізняються одна від одної за складом молекул на одну або кілька гомологічних різниць. Гомологічна різниця СН2 відповідає одному атому вуглецю та двом атомам водню, які не завжди входять до складу однієї СН2-групи. Приклад гомологічного ряду: СН4, С2Н6, С3Н8, С4Н10.
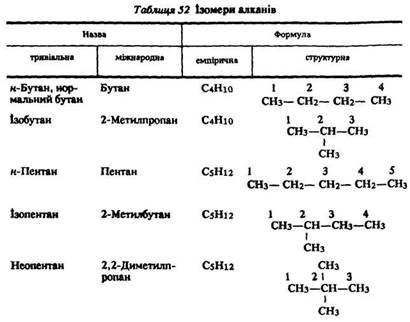
Номенклатура. Вживають такі загальні назви насичених ациклічних вуглеводнів: алкани, парафіни, насичені аліфатичні вуглеводні. Наведемо назви окремих сполук:

Ізомерія. В гомологічному ряду алканів спостерігається структурна ізомерія – ізомерія вуглецевого ланцюга, зумовлена різним порядком сполучення атомів вуглецю. Метан, етан і пропан ізомерів не мають. Бутан існує у вигляді двох ізомерів, пентан – трьох (табл. 52). Зі збільшенням числа атомів вуглецю в молекулі число можливих ізомерів зростає. Гексан існує у вигляді п’яти ізомерів, декан – сімдесяти п’яти.
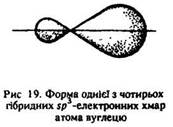
Електронна будова. В молекулах алканів усі атоми зв’язані сигма-зв’язками, в утворенні яких беруть участь гібридні sp3-орбіталі (рис. 19).
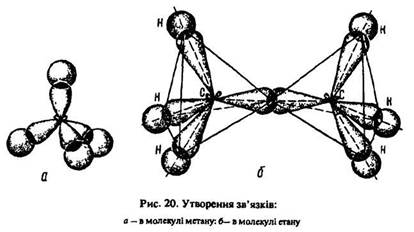
Витягнута грушоподібна форма цих орбіталей забезпечує більше перекривання їх з орбіталями атомів, що приєднуються до вуглецю і цим стабілізують молекулу. Гібридні sp3-орбіталі, перекриваючись з s-орбіталями атомів водню або sp3-орбіталями сусідніх атомів вуглецю, утворюють міцну тетраедричну структуру з чотирма сигма-зв’язками, напрямленими під кутом 109°28’ один до одного (рис. 20).
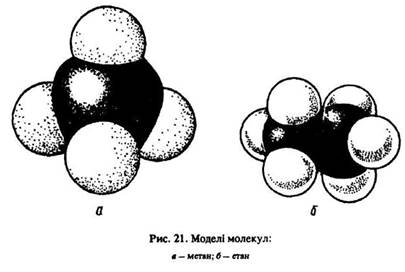
Молекула метану має форму тетраедра (рис. 21, а). Молекула етану С2Н6 містить сім сигма-зв’язків: один зв’язок sp3–sp3 (С–С) і шість sp3–s (С–Н). Вона утворена двома вуглецевими тетраедрами (рис. 21, б).
В інших алканів вуглецевий ланцюг має зигзагоподібну просторову конфігурацію (рис. 22, 23). Молекули алканів неполярні.
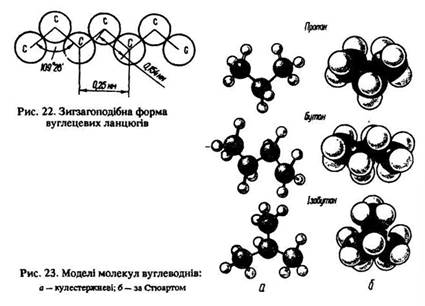
Поширення в природі. Алкани є досить поширеними природними сполуками. Вони містяться в нафті, природних і супутних газах.
Фізичні властивості. Температури плавлення та кипіння вуглеводнів підвищуються зі збільшенням числа атомів вуглецю в молекулі (табл. 53). Це явище можна пояснити так. Сили міжмолекулярного притягання неполярних молекул вуглеводнів слабкі. З подовженням вуглецевого ланцюга вони збільшуються. Поряд з цим, ізомери з більш розгалуженим ланцюгом мають менші температури плавлення та кипіння.
Усі алкани легші за воду і як неполярні сполуки не розчиняються в ній.
Хімічні властивості. Алкани хімічно інертні, оскільки всі валентності в їх молекулах насичені. Докладно їх хімічні властивості буде розглянуто на прикладі метану СН4.
Метан
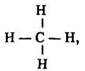
Молекулярна формула метану СH4, структурна:
електронна:
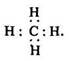
Класифікація. Метан – найпростіший представник алканів. Він не має ізомерів. Будова його молекули наведена раніше (п. 22.2).
Поширення в природі. Метан є головною складовою частиною природного газу (90–98 %). Багато його міститься в газах, які виділяються під час добування та переробки нафти, сухої перегонки деревини, торфу та кам’яного вугілля.
Метан часто називають болотним, або рудниковим газом, оскільки він утворюється в болотах під час гниття рослинних решток без доступу повітря, а також у процесі повільного розкладу кам’яного вугілля під землею.
Фізичні властивості. Метан – це газ без запаху та кольору, легший за повітря, малорозчинний у воді.
Хімічні властивості. Метан, як і всі алкани, хімічно малоактивний – він не вступає в реакції приєднання, не взаємодіє з розчинами перманганату калію та лугів, бромною водою та холодною концентрованою сірчаною кислотою. Реакції окислення метану відбуваються лише за високої температури.
Горіння. Метан горить блідим синюватим полум’ям:
СН4г + 2O2г = СO2г + 2Н2Ог + 880 кДж.
У результаті реакції виділяється велика кількість тепла, тому метан застосовують як горючий газ. Суміші метану з киснем у об’ємному співвідношенні 1: 2 або з повітрям у об’ємному співвідношенні 1: 10 є вибухонебезпечними.
Розклад. Під час сильного нагрівання (1000 °С) метан розкладається на вуглець і водень:
СН4 = С + 2Н2.
Реакції заміщення. Метан вступає в реакції заміщення з галогенами, розведеною азотною та концентрованою сірчаною кислотами під час нагрівання. Галогенування відбувається поступово на світлі. Під дією кванта світла у молекулі галогену, наприклад хлору, розривається ковалентний зв’язок. Внаслідок цього утворюються вільні радикали хлору Сl•, які мають непарний електрон і підвищену кінетичну енергію: Сl2 -> 2С1•. У результаті їх взаємодії з вуглеводнем виникають вільні вуглеводневі радикали:
СН4 + Сl• -> СН3• +НСl.
Ці радикали, в свою чергу, вступають у реакцію з молекулами хлору» утворюючи вільні радикали хлору СН3• + Сl2 -> СН3Сl + +Сl• і т.д. Хімічні реакції, в яких активна частка (вільний радикал, атом або збуджена молекула) спричинює велику кількість (ланцюг) перетворень вихідних молекул внаслідок виникнення активної частки в кожному елементарному акті реакції, називають ланцюговими. За відкриття механізму ланцюгових реакцій російський вчений М. Семенов (1901–1969) був удостоєний у 1958 р. Нобелівської премії. Ці реакції закінчуються утворенням суміші галогенопохідних:
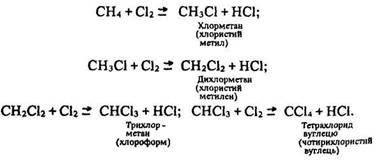
Під дією ультрафіолетового опромінення суміші метану з хлором відбувається вибух за схемою:
СН4 + 2Сl2 -> С + 4НСl.
Способи розриву хімічних зв’язків. Розрізняють два способи розриву хімічних зв’язків: гoмолітичний та гетеролітичний. Гoмолітичний супроводжується розривом спільної електронної пари та виникненням радикалів – атомів чи груп атомів з неспареним електроном:
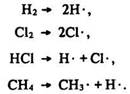
Під час гетеролітичного розриву зв’язку електронна пара переходить до будь-якого атома і утворюються іони протилежного знаку:
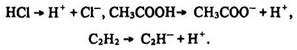
Індукційний ефект. Електронна будова галогенопохідних ряду метану характеризується певними особливостями. Молекули СН3Сl, СН2Сl2, СНСl3 (на відміну від СН4) полярні внаслідок зміщення електронної густини в бік більш електронегативних атомів хлору:
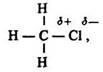
де дельта плюс, і дельта мінус – часткові заряди атомів.
Зміщення електронної пари впливає не лише на атоми, які вона з’єднує (С і Сl), але й на ті, які знаходяться далі в ланцюзі (Н):
Н –> СН2 –> Сl.
Тому в СН3Сl атоми водню заміщуються на атоми хлору легше, ніж у СН4. Здатність атома або групи атомів спричинювати в ланцюзі зміщення електронної густини сигма-зв’язку називають індукційним ефектом.
Індукційний ефект вважається негативним, якщо атом або радикал притягує електрони сусіднього атома, позитивним – якщо відштовхує їх від себе.
Негативний індукційний ефект виявляють групи
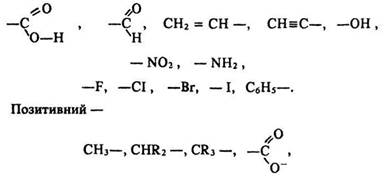
а також атоми металів.
Одержання. Метан у промисловості добувають такими способами:
в результаті реакції водню та графіту за температури 500 °С та наявності каталізатора (нікелю):
С + 2Н2 –> СН4;
внаслідок взаємодії водню та оксиду вуглецю (II), які входять до складу водяного газу:
![]()
Останнім способом можна добути також інші алкани.
У лабораторних умовах метан добувають таким чином: взаємодією карбіду алюмінію з водою:
Аl4С3 + 12Н2O = 4А1(ОН)3 + 3СН4;
нагріванням суміші ацетату натрію з гідроксидом натрію:
СН3СООNa + NаОН = Nа2СО3 + CН4.
Інші алкани можна одержати в результаті взаємодії металічного натрію та галогенопохідних вуглеводнів (реакція Вюрца):
![]()
Використання метану та інших алканів. Метан є сировиною для виробництва хімічних продуктів. Так, неповним окисленням метану при 500 °С добувають ацетилен:
4СН4 + 2O2 = С2Н2 + Н2O + СO2 + СО +6Н2.
З метану одержують також метиловий спирт і формальдегід:
![]()
Метан, ацетилен, формальдегід, метиловий спирт є сировиною для багатьох хімічних виробництв. Окисленням вищих алканів, які містять 20–25 атомів вуглецю, одержують синтетичні жирні кислоти з різною довжиною ланцюга вуглецевих атомів. Ці кислоти використовують для виробництва мила, різких миючих засобів, лаків, емалей, мастила. Алкани застосовують як паливо.