30. Алкени
Алкени
| Сайт: | Підготовка до ЗНО - Освітній портал "Академія" |
| Курс: | Підготовка до ЗНО з хімії |
| Книга: | 30. Алкени |
| Надруковано: | Гість |
| Дата: | Wednesday 2 July 2025 4:02 PM |
Алкени
Вуглеводні, в молекулах яких атоми вуглецю зв’язані між собою кратними (подвійними або потрійними) зв’язками, називають ненасиченими.
Найважливішими ненасиченими вуглеводнями є етиленові (містять один подвійний зв’язок), дієнові (два подвійних зв’язки); ацетиленові (один потрійний зв’язок).
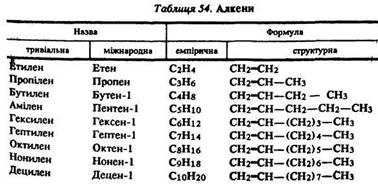
Визначення. Етиленові вуглеводні – це ненасичені аліфатичні вуглеводні з одним подвійним зв'язком. Вони утворюють гомологічний ряд із загальною формулою СnН2n.
Номенклатура. Вживаються такі загальні назви етиленових вуглеводнів: алкени, олефіни. Назви окремих алкенів утворюють з назви відповідного алкану заміною суфікса -ан на -єн.
Нумерацію атомів вуглецю слід починати з кінця, до якого ближче подвійний зв’язок (табл, 54).
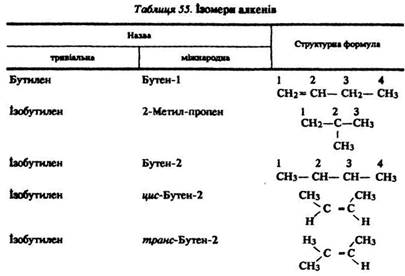
Ізомерія. У алканів спостерігається структурна, міжгрупова та просторова (стерео) ізомерія. Структурна ізомерія обумовлена розгалуженням вуглецевого скелета (бутен-1 і 2-метил-пропен) і різним положенням подвійного зв’язку (бутен-1, бутен-2). Міжгрупова ізомерія спостерігається з циклопарафіками (циклогексан і гексен). Просторова – геометрична цис- і транс-ізомерія спричинена неоднаковим просторовим положенням різних замісників щодо подвійного зв’язку (цис- і транс-бутен-2). Бутен- 1 і 2-метил-пропен-1 стереоізомерів не мають (табл. 55).
Будова молекул. Під час сильного нагрівання від насичених вуглеводнів (алканів) відщеплюються атоми водню і утворюються ненасичені вуглеводні (алкени):
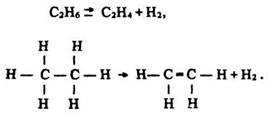
Ці перетворення супроводжуються зменшенням відстані між атомами вуглецю від 0,154 нм (в етані) до 0,133 нм (в етені). Таке явище пояснюється меншою силою відштовхування ядер атомів вуглецю в етені порівняно з етаном, оскільки в утворенні подвійного зв’язку беруть участь чотири електрони, а одинарного – два. Тому густина електронного заряду між ядрами атомів вуглецю в етилені більша, ніж в етані. Кути між зв’язками теж змінюються від 109° 28’ – в етані до 120° – в етені (рис. 24).
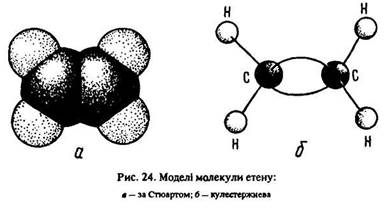
Сучасна теорія будови речовини пояснює ці явища таким чином. Між атомами вуглецю в етилені утворюється пі-зв’язок за рахунок р-електронів двох вуглецевих атомів, від яких відщепилися атоми водню (п. 6.2). Таким чином, атоми вуглецю в молекулі етилену зв’язані подвійним зв’язком, який складається з одного сигма-зв’язку і одного пі-зв’язку.
Зазначена зміна кутів між зв’язками відбувається внаслідок sp2-гібридизації. На відміну від етану в етені гібридизуються s-орбіталь і дві р-орбіталі (рx і рy) кожного атома вуглецю. Третя pz-орбіталь утворює пі-зв’язок, має в площині сигма-зв’язків мінімальну електронну густину і в гібридизації участі не бере. В результаті sp2-гібридизації в етені кожен атом вуглецю утворює по три гібридні sp2- орбіталі, які знаходяться в одній площині під кутом 120° (рис. 25).
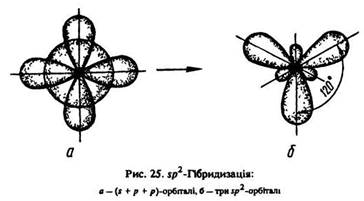
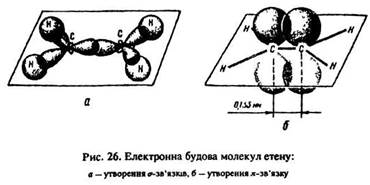
Ці гібридні sp2-орбіталі кожного атома вуглецю беруть участь в утворенні одного сигма-зв’язку між атомами вуглецю та двох сигма-зв’язків з s-орбіталями атомів водню. Тому всі шість атомів молекули етену з їх сигма-зв’язками розташовані в одній площині, а пі-зв’язок – у площині, перпендикулярній до неї. Пі-зв’язок стабілізує молекулу етилену.
Вільне обертання атомів вуглецю, зв’язаних між собою подвійним зв’язком, неможливе, оскільки має супроводжуватися розривом пі-зв’язку, тобто витратою енергії. Тому в молекулах з подвійним зв’язком, наприклад у бутені, спостерігається стереоізомерія.
Таким чином, молекула етилену містить усього шість зв’язків: п’ять сигма-зв’язків (один sр2–sр2 між атомами вуглецю, чотири sр2– s між атомами вуглецю та водню) і один пі-зв’язок р–р між атомами вуглецю (рис. 26).
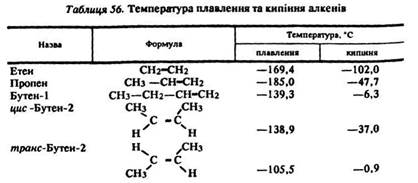
Физичні властивості. Нижчі алкени – гази, алкени від С5 до С14 – рідини, вищі алкени – тверді речовини (табл. 56). Усі алкени практично нерозчинні у воді, частково розчинні у спиртах.
Хімічні властивості. Алкени хімічно активніші за алкани. Це пояснюється меншою міцністю пі-зв’язку внаслідок перекривання електронних пар поза площиною молекули. У хімічну реакцію в першу чергу вступають атоми вуглецю, які зв’язані подвійним зв’язком. Тому для алкенів характерні реакції приєднання, що відбуваються за іонним механізмом.
Реакції приєднання. Галогенування:
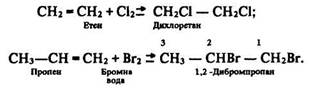
У результаті реакції бромна вода знебарвлюється. Цю реакцію використовують для якісного визначення алкенів. Гідрування (гідрогенізація):
![]()
Реакція відбувається за наявності каталізаторів – платини, паладію, нікелю та інших металів.
Приєднання галогеноводнів:
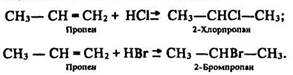
Згідно з правилом Марковникова, під час приєднання до алкенів речовин, які містять рухливий водень, він сполучається з найбільш гідрогенізованим атомом вуглецю, а залишок молекули – з найменш гідрогенізованим. Сучасна теорія будови речовини пояснює це явище таким чином: радикал СН3– виявляє позитивний індукційний ефект (відштовхує від себе електронну пару), а радикал –СН=СН2, який називається вініл, – негативний індукційний ефект (притягує електронну пару). У результаті подвійний несиметричний зв’язок у пропені частково поляризується:
![]()
Тому катіон Н+ приєднується до атома вуглецю з підвищеною електронною густиною, тобто з частково негативним зарядом, а аніон (Сl–, Вr–) – до сусіднього атома вуглецю.
Гідратація:
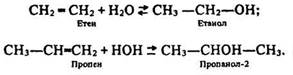
Ця реакція відбувається згідно з правилом Марковникова. Вона є оборотною. За високих тиску і температури та наявності каталізатора (фосфорної кислоти) добувають спирт. Під час нагрівання спирту з концентрованою сірчаною кислотою одержують алкен.
Окислення. Алкени легко окислюються. Водний розчин перманганату калію КМnО4 окислює етилен до етиленгліколю:
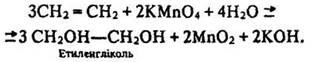
Цю реакцію, як і реакцію з бромною водою, використовують для якісного визначення алкенів.
У кисні та на повітрі алкени горять світлим полум’ям:
С2Н4 + 3О2 = 2СО2 + 2Н2О.
Полімеризація. Алкени, як і інші ненасичені сполуки, вступають у реакцію полімеризації. Полімеризацією називається реакція послідовного сполучення однакових молекул у більші за розміром. У результаті полімеризації утворюються молекули полімера (високомолекулярні сполуки). Так, за підвищеної температури та тиску (близько 151987 кПа) етилен полімеризується в поліетилен. Молекули етилену з’єднуються в місці розриву подвійного зв’язку:
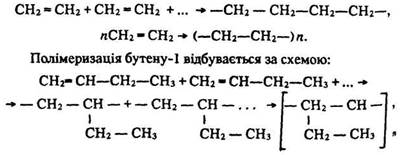
де n – ступінь полімеризації. Ступінь полімеризації – змінна величина. Тому молекулярна маса полімеру – це середня величина молекулярних мас різних його молекул.
Полімерами називаються речовини, молекули яких (макромолекули) складаються з великої кількості груп атомів (структурних ланок), з’єднаних між собою хімічними зв’язками. До полімерів належать поліетилен і полібутилен. Низькомолекулярні сполуки, молекули яких взаємодіють між собою або з молекулами інших сполук з утворенням полімерів, є мономерами. Так, етилен і бутилен – мономери.
Полімеризація відбувається за різних умов – за звичайної чи підвищеної температури, великого тиску, під дією ультрафіолетового або радіоактивного опромінення, за наявності каталізаторів.
Полімери легкі, стійкі до впливу води, кислот, лугів, механічних пошкоджень, не проводять електричний струм (діелектрики), водо- та газотривкі, термопластичні. Термопластичність – властивість тіл змінювати форму в нагрітому стані під дією зовнішніх сил і зберігати їх форму у разі охолодження. Ці властивості пояснюються їх будовою та сильною міжмолекулярною взаємодією.
За своєю геометричною формою полімери бувають лінійні, розгалужені та просторові (рис. 27).
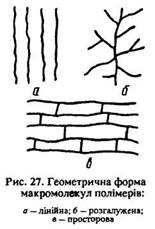
Полімери широко використовуються в науці та техніці. З поліетилену та поліпропілену виготовляють ізоляційні оболонки електричних дротів, кабелів, пакувальний матеріал, тару (пляшки, мішки), пробки, посуд, деталі машин, труби, лабораторний посуд, іграшки. З поліпропіленового волокна роблять тканини (подібні до вовни, шовку, льону, бавовни), сітки, канати тощо.
Одержання алкенів. Кратний зв’язок утворюється під час відщеплення будь-яких атомів від насичених вуглеводнів. На цьому принципі ґрунтуються такі способи добування алкенів.
1. Відщеплення галогенів від дигалогенопохідних, в яких атоми галогену розміщені біля сусідніх атомів вуглецю:
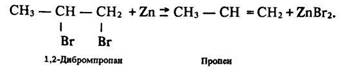
2. Відщеплення галогеноводнів від галогенопохідного:
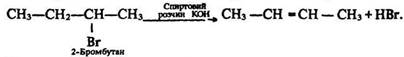
Як видно з рівняння, атом водню відщеплюється від менш гідрогенізованого атома вуглецю. Це правило сформулював російський хімік О. Зайцев (1841–1910) у 1875 р.
3. Відщеплення води від спиртів (дегідратація):
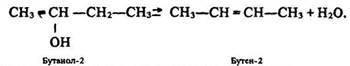
Реакція відбувається за правилом Зайцева за температури 350–500 °С і наявності каталізаторів (Аl2О3) або зневоднювальних засобів (концентрована Н2SO4, P2O5).
4. Відщеплення водню від алканів (дегідрування, дегідрогенізація):
![]()
Реакція відбувається згідно з правилом Зайцева за температури 450–650 °С і наявності каталізатора (Сr2O3, Аl2О3 + КОН).
Крекінг і піроліз нафтопродуктів. Крекінг – високотемпературна переробка нафти, підчас якої в результаті розщеплення речовини з більшою молекулярною масою утворюються речовини з меншою молекулярною масою.
Піроліз – високотемпературна переробка органічних сполук, яка включає кілька процесів – крекінг, дегідрогенізацію, полімеризацію та ін.
Під час високотемпературного крекінгу (700 °С) утворюються гази, які містять 43 % ненасичених вуглеводнів:
![]()
Одержання етилену. В промисловості застосовують два способи добування цієї речовини:
1) дегідрування етану:
![]()
2) часткова гідрогенізація ацетилену:
![]()
У лабораторії етилен добувають дегідратацією етанолу за наявності концентрованої сірчаної кислоти:
![]()
Використання. Етилен – є важливою сировиною для сучасної органічної технології. Майже половина його використовується у виробництві поліетилену, решта – для синтезу етанолу, хлоретану, вінілхлориду, стиролу та ін. Етен прискорює дозрівання фруктів.