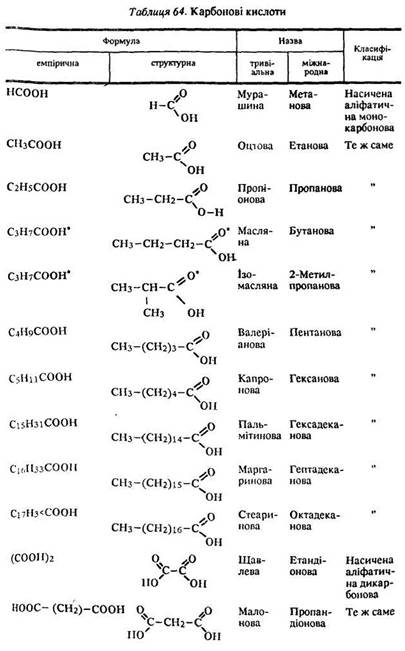
38. Карбонові кислоти
36. Карбонові кислоти
| Сайт: | Підготовка до ЗНО - Освітній портал "Академія" |
| Курс: | Підготовка до ЗНО з хімії |
| Книга: | 38. Карбонові кислоти |
| Надруковано: | Гість |
| Дата: | Sunday 25 May 2025 5:15 AM |
Карбонові кислоти
Визначення. Карбоновими кислотами називаються органічні сполуки, в молекулах яких містяться одна або кілька карбоксильн их груп –СООН, сполучених з вуглеводневим радикалом. У мурашиній кислоті –СООН група з’єднана з атомом водню. Карбоксильна група складається з карбонільної >СO і
гідроксильної –ОН.
Загальна формула карбонових кислот
![]()
де R – вуглеводневий радикал.
Класифікація. За числом карбоксильних груп у молекулі розрізняють одноосновні – монокарбонові кислоти, двоосновні – дикарбонові і т. д. Залежно від природи вуглеводневого радикалу існують різні гомологічні ряди кислот: аліфатичні насичені (алканові) з загальною формулою СnН2n+1СООН, ненасичені алкенові СnН2n-1СООН та алкінові СnН2n-3СООН і ароматичні – аренові R–С6Н4–СООН.
Номенклатура. За міжнародною номенклатурою назва кислоти утворюється з назви відповідного вуглеводню і закінчення -ова з урахуванням атома вуглецю карбоксильної групи (табл. 64). Для позначення положення замісників у вуглеводневому ланцюгу крім цифр вживають також літери грецбкого алфавіту:
![]()
Часто користуються тривіальними назвами кислот (мурашина, оцтова, масляна, щавлева, молочна, винна, лимонна та ін.).
Ізомерія. У гомологічному ряду насичених аліфатичних монокарбонових кислот існують ізомери вуглеводневого ланцюга (див. табл. 64). У ненасичених аліфатичних монокарбонових кислот трапляється ізомерія вуглеводневого ланцюга, положення подвійного чи потрійного зв’язку, цис-транс-ізомерія (олеїнова кислота – цис-ізомер, елаїдинова – транс-ізомер) і міжкласова з складними ефірами.
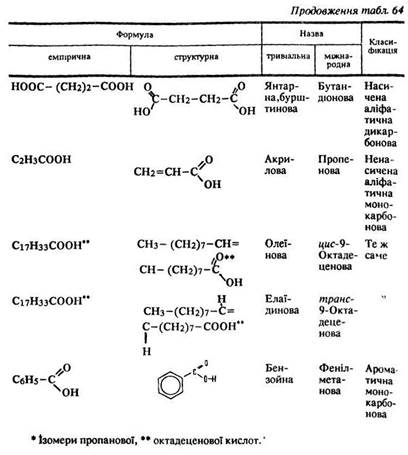
Будова молекули. Електронна будова карбонових кислот зображується формулою:
просторова – моделлю Стюарта (рис. 37).
У карбоксильній групі карбонільна група >С=О і гідроксильна –ОН впливають одна на одну. В результаті властивості групи –ОН в кислотах і спиртах, а також властивості карбонільної групи в кислотах і альдегідах різні. Розглянемо механізм такого взаємного впливу. Як відомо, карбонільна група >С=O сильно поляризована – електрони зміщені до атома кисню, атом вуглецю має деякий позитивний заряд. Тому він притягує до себе електрони від атома кисню гідроксигрупи, що викликає зміщення електронної хмари зв’язку О–Н до атома кисню:
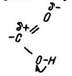
Внаслідок цього зв’язок між атомами водню та кисню дуже послаблюється. Кислоти виявляють більш сильні кислотні властивості, ніж спирти. У свою чергу, гідроксильна група впливає на карбонільну – зміщення електронної пари від атома кисню гідроксигрупи до атома вуглецю частково нейтралізує позитивний заряд вуглецю. В результаті у карбонільній групі пі-зв’язок стає міцнішим, зменшується її здатність вступати в реакції приєднання. На відміну від альдегідів водень приєднується до карбонільної групи кислоти лише за особливих умов.
На зв’язок між атомами водню та кисню в гідроксигрупі впливає також вуглеводневий радикал – зі збільшенням негативного індукційного ефекту радикалу сильніше відтягуються електрони від атома кисню гідроксигрупи – сила кислот зростає. Так, хлороцтова кислота є сильнішою за оцтову, ароматична – сильнішою за аліфатичну з таким же числом атомів вуглецю, багатоосновні сильніші за одноосновні. Аліфатичні радикали виявляють позитивний індукційний ефект, тому мурашина кислота сильніша, ніж її гомологи.
Між молекулами кислот виникають водневі зв’язки. Рідкі кислоти складаються з димерів – циклічних або лінійних:
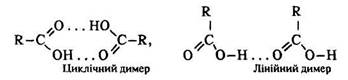
У циклічних димерах між двома молекулами кислот утворюються два водневі зв’язки. Мурашина кислота навіть у газоподібному стані існує у вигляді димерів.
Поширення у природі. Карбонові кислоти містяться в рослинних та тваринних організмах у вільному (лимонна, щавлева, яблучна, мурашина) і зв’язаному (у вигляді складних ефірів, ефірних масел та жирів – оцтова, масляна, стеаринова, олеїнова тощо) станах.
Фізичні властивості. На відміну від альдегідів серед алканових кислот немає газоподібних речовин. Нижчі члени ряду (до пальмітинової кислоти) – рідини з гострим запахом, добре розчинні у воді. Збільшення молекулярної маси обумовлює зниження розчинності у воді. Вищі кислоти (починаючи з пальмітинової) – тверді речовини без запаху, нерозчинні у воді.
Температури кипіння карбонових кислот вищі, ніж відповідних спиртів. Відсутність газоподібних речовин серед кислот, їх добра розчинність і високі температури кипіння пояснюються утворенням більшого числа водневих зв’язків між молекулами кислот порівняно зі спиртами.
Хімічні властивості. Кислотні властивості. Розчини карбонових кислот у воді мають кислий смак, забарвлюють лакмус і метиловий оранжевий у червоний колір, проводять електричний струм, взаємодіють з металами з виділенням водню. Це свідчить, що органічні кислоти вступають у реакції, характерні для кислот (п. 10.4).
Дисоціацію карбонових кислот у загальному вигляді можна описати рівнянням:
R–СООH <=> RСОO– + Н+.
За ступенем дисоціації мурашина кислота є електролітом середньої сили, інші карбонові кислоти належать до слабких електролітів внаслідок впливу вуглеводневого радикалу.
Метали, розташовані в ряду стандартних електродних потенціалів ліворуч від водню, витісняють його з карбонових кислот.
Звичайно, реакція відбувається повільніше, ніж із сильними кислотами, з утворенням солей – іонних сполук:
![]()
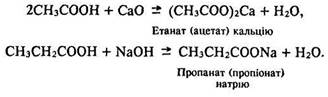
Внаслідок взаємодії кислот з основними оксидами та основами утворюються солі:
Під час реакцій з солями карбонові кислоти витісняють слабші та леткі кислоти з їх солей:
![]()
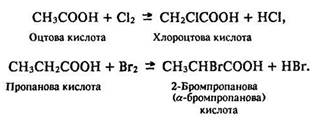
Реакції за участю вуглеводневого радикалу. У карбонових кислот під впливом карбоксильної групи збільшується рухливість атомів водню, які стоять біля атома вуглецю, сусіднього з карбоксильною групою. Тому вони легко замішуються атомами хлору або брому:
Характерною властивістю карбонових кислот є їх взаємодія з спиртами з утворенням сетерів (реакція етерифікації):
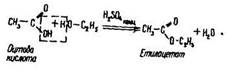
Хлороцтова та альфа-бромпропанова кислоти сильніші за карбонові, з яких вони утворилися, внаслідок індукційних ефектів замісників:
Одержання та використання карбонових кислот буде розглянуто на прикладі їх окремих представників.
Представники насичених аліфатичних монокарбонових кислот
Мурашина (метанова) кислота. Гомологічний ряд насичених (алканових) монокарбонових кислот починається мурашиною кислотою НСООН. Це – безбарвна речовина з різким запахом, кипить за температури 100,7 °С, змішується з водою в будь-яких співвідношеннях. Вона міститься у хвої, кропиві, виділеннях мурашок та бджіл.
Карбоксильна група в мурашиній кислоті з’єднана з атомом водню. Тому в її формулі є карбоксильна та альдегідна групи:

Мурашина кислота найсильніша в її гомологічному ряді (К = 2x10–4). Крім кислотних властивостей вона виявляє відновні, характерні для альдегідів, наприклад, вступає в реакцію «срібного дзеркала»:
![]()
За температури 160 °С мурашина кислота розкладається:
![]()
Під дією концентрованої сірчаної кислоти вона зневоднюється:
![]()
У промисловості мурашину кислоту добувають у дві стадії. Спочатку нагріванням твердого гідроксиду натрію з оксидом вуглецю (II) добувають метанат (форміат) натрію НСОONа:
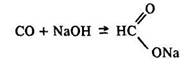
Потім у результаті взаємодії цій солі з холодною сірчаною кислотою одержують мурашину кислоту:
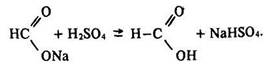
Мурашина кислота широко застосовується в хімічній (як відновник), харчовій (як дезінфікуючий та консервуючий засіб) і текстильній промисловості (для протрави та фарбування тканин) , а також у виробництві природного каучуку (як коагулюючий засіб) і медицині.
Оцтова (етанова) кислота. Ця кислота СН3СООН за звичайної температури – безбарвна рідина з різким характерним запахом, за температури нижче –16,6 °С – кристалічна, льодоподібна маса. Тому безводну оцтову кислоту називають «льодяною». Її температура кипіння становить 118,5 °С, за кімнатної температури вона змішується з водою в будь-яких співвідношеннях. Розчин цієї кислоти з масовою часткою СН3СООН 3–5 % відомий під назвою столового оцту, 70–80 % – оцтової есенції.
Оцтова кислота виявляє всі хімічні властивості, характерні для карбонових кислот. Вона – слабкий електроліт:
СН3СООН <=> СН3СОО– + Н+.
Ступінь її дисоціації становить 1,3 %, константа дисоціації К = 2x10–5.
Оцтова кислота змінює колір лакмусу та метилового оранжевого на червоний, взаємодіє з металами, які стоять в ряду стандартних електродних потенціалів перед воднем, з основами, амфотерними гідроксидами, солями.
Солі оцтової кислоти називаються етанатами або ацетатами. Як іонні сполуки вони добре розчиняються у воді, як солі слабкої кислоти – гідролізуються у водних розчинах.
На відміну від мурашиної оцтова кислота не виявляє властивостей альдегіду.
Оцтову кислоту добувають окисленням етилового спирту під дією бактерій:
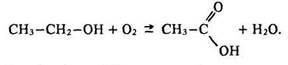
Це найдавніший спосіб її одержання (скисання виноградного вина).
Основний промисловий синтетичний спосіб добування оцтової кислоти складається з трьох стадій:
1) крекінгу метану на ацетилен і водень:
2СН4 = 2СНºСН + Н2;
2) добування оцтового альдегіду за реакцією Кучерова:
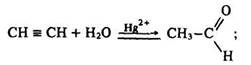
3) окислення оцтового альдегіду киснем повітря за наявності каталізатора:
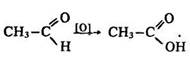
Перспективним є новий (економічно більш вигідний) спосіб добування оцтової кислоти з бутану:
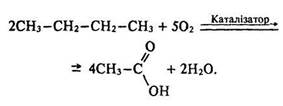
З усіх карбонових кислот оцтова має найбільше практичне значення. Її застосовують у синтезі барвників, для одержання пластмас, ліків (наприклад, аспірину, фенацетину), штучних волокон, негорючої кіноплівки тощо. Солі та інші похідні цієї кислоти використовують для фарбування тканин, у медицині, сільському господарстві (боротьба з бур’янами). Складні ефіри оцтової кислоти, як і ефіри мурашиної, застосовують як розчинники і запашні речовини.
Пальмітинова та стеаринова кислоти. З вищих насичених аліфатичних монокарбонових кислот найважливішими є пальмітинова
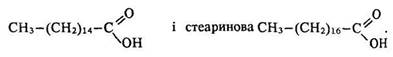
У вигляді складних ефірів гліцерину вони входять до складу рослинних і тваринних жирів.
Ці кислоти – тверді речовини білого кольору, нерозчинні у воді. Вуглеводневі радикали їх молекул містять нерозгалужені ланцюги з 15 і 17 вуглецевих атомів, сполучених сигма-зв’язками. Для цих кислот характерні ті ж реакції, що і для інших карбонових кислот. Так, внаслідок взаємодії з розчинами лугів або карбонату натрію вони утворюють солі:
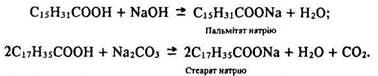
Натрієві солі цих кислот розчинні у воді. Вони складають основну частину звичайного твердого мила, оскільки мають миючі властивості. Калієві солі утворюють рідке мило, яке застосовують у медицині.
Миюча дія мила обумовлена будовою його уявної молекули, яка має полярний кінець –СОО–Na+ і неполярний радикал, що містить 12–18 атомів вуглецю. Полярний кінець розчинний у воді, неполярний – у маслі, бруді. Внаслідок цього частки бруду оточуються іонною оболонкою, що розчиняється у воді. Утворюється емульсія жиру у воді, яка далі видаляється разом з милом.
Кальцієві та магнієві солі карбонових кислот не розчиняються у воді, тому мило втрачає миючі властивості в твердій воді.
Із солей карбонових кислот можна знову добути кислоти, діючи на їх водні розчини сильною кислотою:
![]()
Вищі карбонові кислоти добувають із жирів (див. гідроліз жирів) і застосовують для виробництва мила.
З метою економії цінної харчової сировини – рослинних і тваринних жирів – зараз розробляються способи виготовлення мила та інших миючих засобів з нехарчових речовин. Карбонові кислоти, необхідні для виробництва мила, добувають способом, який базується на окисленні парафінів:
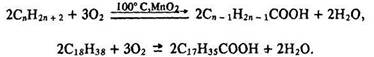
Зараз синтезовано нові миючі засоби – солі кислих естерів вищих спиртів і сірчаної кислоти (алкілсульфати з загальною формулою R–СН2–О–SO2–ОNа). їх кальцієві та магнієві солі добре розчиняються у воді (на відміну від мила), і можуть використовуватися для прання в твердій воді. Алкілсульфати входять до складу багатьох пральних порошків.
Синтетичні миючі засоби не руйнуються в процесі їх використання, потрапляють у водойми і забруднюють навколишнє середовище. Тому вчені прагнуть створити такі миючі засоби, які в природі могли б знищуватися мікроорганізмами в процесі їх життєдіяльності.
Представники ненасичених аліфатичних монокарбонових кислот
Молекули ненасичених кислот містять один або кілька кратних зв’язків між атомами вуглецю.
Акрилова кислота. Гомологічний ряд ненасичених аліфатичних монокарбонових кислот з одним подвійним зв’язком починається акриловою (пропеновою) кислотою СН2=СН–СООН, яку можна розглядати як похідну пропілену.
Це – рідина з температурою кипіння 140,9 °С, яка змішується з водою, спиртом, диметиловим етером. Оскільки молекула акрилової кислоти містить карбоксильну групу та подвійний зв’язок, вона вступає в реакції, характерні для кислот і ненасичених вуглеводнів. Так, вона утворює солі та ефіри – акрилати і може полімеризуватися з утворенням поліакрилової кислоти:
![]()
Акрилову кислоту використовують для одержані поліакрилової кислоти, іонообмінних смол, каучуків, ефірі Полімери ефірів акрилової кислоти застосовують у виробництві плівок, зубних протезів, лаків, клеїв, просочувальній речовин для паперу, шкіри, деревини та тканин.
Олеїнова кислота. Це – представник вищих ненасичених аліфатичних монокарбонових кислот, її формула:
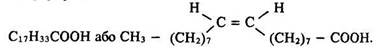
Разом з пальмітиновою та стеариновою кислотами вона у вигляді складного ефіру гліцерину входить до складу жирів.
У молекулі олеїнової кислоти в середині ланцюга є подвійний зв’язок, який обумовлює цис- і транс-ізомерію. Олеїнова кислота – цис-ізомер. Завдяки такій формі молекул її міжмолекулярні зв’язки не дуже сильні, тому вона є рідиною. Форма молекул транс-ізомера – елаїдинової кислоти – обумовлює більші сили взаємодії між ними, тому вона – тверда речовина.
Оскільки в молекулі олеїнової кислоти є подвійний зв’язок, вона може вступати в реакції приєднання з бромом і воднем.
Внаслідок взаємодії з воднем олеїнова кислота перетворюється на стеаринову:
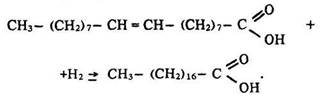
Олеїнову кислоту застосовують для виробництва каучуку, косметичних засобів, ліків, лаків і фарб.
Естери
Визначення. Естери – це похідні кисневмісних кислот, у яких гідроксигрупи кислоти заміщені залишками спирту або фенолу.
Загальна формула естерів органічних кислот:
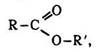
де R, R` – вуглеводневі радикали.
Класифікація. Розрізняють естери органічних та мінеральних кислот (азотної, сірчаної, фосфорної тощо). Серед естерів дво- чи багатоосновних кислот є кислі та середні.
Номенклатура. Вживається ще така загальна назва естерів – складні ефіри. Назви естерів походять від назв кислот і спиртів (або фенолів). Так, естер з формулою ![]() має назви етилметаноат, етилформіат, етиловий ефір форміатної (мурашиної, метанової) кислоти, мурашиноетиловий ефір, з формулами С2H5–О–SО3Н і С2Н5–О–SO2–О–С2H5 – етилгідрогенсульфат і диетилсульфат, з формулою
має назви етилметаноат, етилформіат, етиловий ефір форміатної (мурашиної, метанової) кислоти, мурашиноетиловий ефір, з формулами С2H5–О–SО3Н і С2Н5–О–SO2–О–С2H5 – етилгідрогенсульфат і диетилсульфат, з формулою 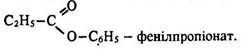
Ізомерія. Для сетерів характерна ізомерія кислотних та вуглеводневих радикалів, а також міжкласова – з карбоновими кислотами. Так, ізомером етилетанату 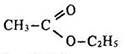 є бутанова кислота С3Н7–СООН.
є бутанова кислота С3Н7–СООН.
Будова молекули. Молекули сетерів складаються з двох структурних елементів – радикалів кислоти та спирту (чи фенолу). Атом кисню, що їх з’єднує, походить від спирту (або фенолу).
Поширення в природі. Естери дуже поширені в природі. Багато з них входить до складу ефірних масел і обумовлює приємний запах квітів, плодів і ягід. Естери триатомного спирту гліцерину та вищих жирних кислот є основою жирів, а вищих одноатомних спиртів та монокарбонових жирних кислот – воску та спермацету.
Фізичні властивості. Естери нижчих карбонових кислот і спиртів – безбарвні леткі рідини з приємним фруктовим запахом. Оцтово-ізоаміловий естер має запах груші, масляно-бутиловий – ананасу. Естери мінеральних кислот – маслянисті рідини з приємним запахом, вищих спиртів і вищих карбонових кислот – тверді речовини, що майже не мають запаху. Вони мало розчинні у воді і добре – в спирті та інших органічних розчинниках.
Температури плавлення та кипіння сетерів нижчих спиртів менші, ніж у відповідних кислот.
Хімічні властивості. Найважливішою хімічною властивістю сетерів є їх взаємодія з водою – гідроліз або омилення. Якщо естер, наприклад оцтово-етиловий, нагрівати з водою за наявності неорганічної кислоти (або лугу), утворюються оцтова кислота (чи її сіль) та етиловий спирт:
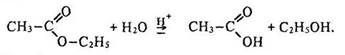
Гідроліз естерів – процес, протилежний реакції етерифікації:
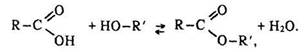
Щоб змістити рівновагу праворуч, точно в бік утворення естеру, треба за принципом Ле Шательє взяти в надлишку вихідну кислоту або спирт, відігнати естер, що утворюється, або видалити воду. Луг необоротно зміщує рівновагу в бік гідролізу, оскільки зв’язує кислоту, утворюючи сіль:
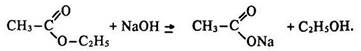
Одержання. Природні естери екстрагують з рослин органічними розчинниками. Промисловий спосіб їх добування базується на реакції етерифікації:
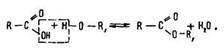
Слід пам’ятати, що в цій реакції вода утворюється з гідроксигрупи кислоти та атома водню спирту.
Використання. Естери застосовують як розчинники у харчовій промисловості (для приготування фруктових есенцій), косметиці, медицині (ізоамілнітрат, етилнітрат).
Жири
Визначення. Жири – це повні естери триатомного спирту гліцерину та вищих жирних (аліфатичних) монокарбонових кислот. їх загальна формула
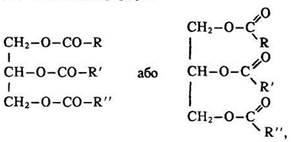
де R, R` і R" – радикали алканових і алкенових кислот з нерозгалуженим ланцюгом. Найчастіше це радикали стеаринової С17Н35СООН (СН3–(СН2)16–СООН), пальмітинової С15Н31СООН (СН3–(СН2)14–СООН) і олеїнової С17Н33СООН (СН3–(СН2)7–СН=СН–(СН2)7–СООН) кислот.
Номенклатура. Вживається ще така загальна назва жирів – тригліцериди. Назви жирів походять від назв кислот. Положення залишків кислот позначаються буквами грецького алфавіту:
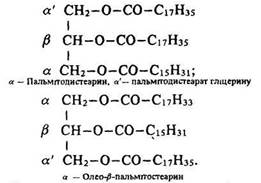
Ізомерія. У тригліцеринів спостерігається ізомерія положення кислотних залишків, що позначається буквами грецького алфавіту.
Поширення в природі. Жири входять до складу рослинних і тваринних організмів. У тварин жири містяться у підшкірній тканині та молоці, у рослин вони накопичуються в пледах, зерні.
Крім тригліцеридів до складу природних жирів входять різні домішки: вільні жирні кислоти, моно- та дигліцериди, вітаміни тощо.
Фізичні властивості. Жири бувають тверді та рідкі. Тверді утворені алкановими кислотами, рідкі – алкеновими. Жири тваринного походження є переважно твердими речовинами (овечий, яловичий), рослинного походження – рідкими (кукурудзяна, маслинова, соєва, соняшникова олії). Жири, як правило, легші за воду, не розчиняються в ній, але утворюють емульсії, добре розчиняються в органічних розчинниках (ефірі, бензолі, бензині тощо). Жири утримують і легко поглинають пахучі речовини. Ця властивість використовується для добування пахучих речовин з квітів. Температура плавлення жирів чітко не визначена, оскільки вони не мають постійного складу.
Хімічні властивості.
Гідрування. Чисті тригліцериди, особливо утворені алкановими кислотами, – хімічно досить інертні. Тригліцериди, що є похідними алкенових кислот, вступають в реакції, характерні для ненасичених сполук, наприклад, у реакцію гідрування (гідрогенізації):
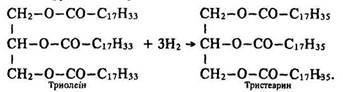
На реакції гідрогенізації базується спосіб перетворення рідких жирів на тверді, який застосовується в промисловості Для виготовлення маргарину.
Гідроліз. Жири, як і всі естери, під час нагрівання за наявності каталізаторів (оксидів магнію, кальцію, цинку, кислот) вступають в реакцію гідролізу – омилюються:
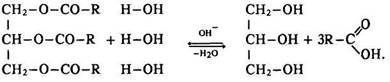
Ця реакція є оборотною. Для зміщення рівноваги праворуч – у бік утворення гліцерину та карбонової кислоти додають луг. Реакцію гідролізу жирів використовують у промисловості для добування гліцерину, карбонових кислот, мила.
Окислення. Природні жири під час зберігання на повітрі псуються, оскільки під дією активних ферментів частково розкладаються на вільні карбонові кислоти, а ненасичені жирні кислоти окислюються з утворенням альдегідів і кетонів.
Одержання. Жири виділяють з рослинних і тваринних організмів. Спосіб добування жирів на основі реакції етерифікації гліцерину та жирних кислот, винайдений французьким вченим М. Бертло в 1854 р., є економічно невигідним, і тому в промисловості не застосовується.
Використання. Жири як одна з головних складових частин раціону харчування людини та тварини необхідні для забезпечення нормальної життєдіяльності. В організмі під дією ферментів вони гідролізуються, потім з продуктів гідролізу синтезуються нові жири, характерні для даного організму.
Велика кількість жирів використовується для виробництва мила, гліцерину, карбонових кислот, плівкоутворювачів (оліф, лаків), а також у фармацевтичній та косметичній промисловості.