39. Вуглеводи
37. Вуглеводи
| Сайт: | Підготовка до ЗНО - Освітній портал "Академія" |
| Курс: | Підготовка до ЗНО з хімії |
| Книга: | 39. Вуглеводи |
| Надруковано: | Гість |
| Дата: | Sunday 25 May 2025 5:16 AM |
Вуглеводи
Визначення. Вуглеводи – це органічні речовини, що належать до класу полігідроксикарбонільних сполук. Багато вуглеводів має склад, що відповідає загальній формулі Сn(H2О)m, але відомі також вуглеводи іншого складу. Разом з тим, цією формулою можна описати склад деяких органічних сполук, які не належать до вуглеводів (оцтова кислота С2Н4О2, формальдегід СН2O).
Класифікація. Вуглеводи поділяють на три групи: моносахариди (не гідролізуються), дисахариди (утворюють під час гідролізу дві молекули моносахаридів) та полісахариди – високомолекулярні речовини (утворюють під час гідролізу п молекул моносахаридів). Серед моносахаридів є альдози, що мають альдегідну групу, та кетози, які містять кетонну групу. Залежно від числа атомів кисню в молекулі розрізняють тріози, тетрози, пентози, гексози тощо.
Класифікацію вуглеводів можна зобразити такою схемою:
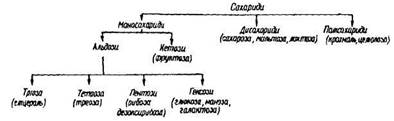
Номенклатура. Вживають ще такі загальні назви вуглеводів: сахариди, сахари та тривіальні назви їх представників: глюкоза, фруктоза, маноза, сахароза тощо.
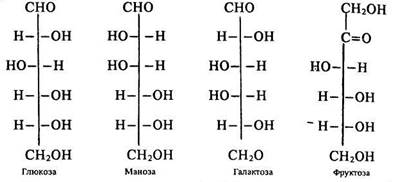
ізомерія. У моносахаридів існує міжкласова та стереоізомерія. Альдози є ізомерами кетоз з однаковими молекулярними брутто-формулами (альдо- та кетогексози). Стереоізомерія моносахаридів обумовлена просторовою асиметрією вторинних атомів вуглецю (див. будову їх молекул). Серед альдогексоз, як і серед кетогексоз, що мають чотири таких атоми, відомо багато стереоізомерів. Усі ці ізомери є оптично активними речовинами (обертають площину поляризованого світла). Якщо обертання відбувається за годинниковою стрілкою, речовина є правообертаючим оптичним ізомером, проти годинникової стрілки – лівообертаючим. Кожний стереоізомер – моносахарид існує у вигляді двох таких оптичних ізомерів.
На відміну від інших ізомерів оптичні мають однакові хімічні та фізичні властивості (температури кипіння та плавлення, густину), але різну біологічну активність. Кетогексози ще характеризуються ізомерією положення карбонільної групи в ланцюзі.
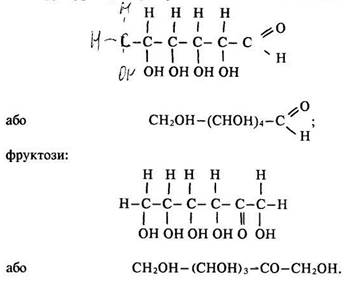
Будова молекул. Молекули гексоз мають відкриту або циклічну форму. До складу відкритої молекули входять такі функціональні групи: альдегідна (у альдогексоз) чи кетонна (кетогексоз) та спиртові – первинна –СН2ОН і вторинні =СНОН. Альдогексози мають чотири групи =СНОН, кетогексози – три, але у останніх число вторинних атомів вуглецю теж становить чотири (разом з кетонною групою). Структурна формула усіх альдогексоз мас такий вигляд:
Будову стереоізомерів зображують формулами Фішера, які запропонував німецький хімік Е. Фішер (1852-1919), лауреат Нобелівської премії 1908 р. Наведемо формули деяких стереоізомерів моносахаридів:
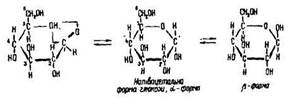
Розглянемо утворення циклічної форми гексоз на прикладі глюкози. Вуглецевий ланцюг внаслідок обертання атомів відносно альфа-зв’язку може бути не тільки витягнутим, але й загнутим. Тоді карбонільна група >С=О наближається до п’ятого атома вуглецю, відбувається внутрішньомолекулярна взаємодія і виникає зв’язок між першим та п’ятим атомами вуглецю через кисень. Так утворюється шестичленне кільце – напівацетальна форма глюкози або будь-якої гексози:
Напівацетальними (напівацеталями) називають продукти взаємодії альдегідів і кетонів із спиртами. Вони мають таку будову:
![]()
У циклічній молекулі немає альдегідної групи. Замість неї біля першого атома вуглецю утворюється гідроксигрупа, яка називається напівацетальною гідроксигрупою. Вона легше вступає в реакції, ніж спиртові гідроксигрупи, тобто є більш реакційноздатною. Ця група може займати різне положення щодо площини молекули. Циклічна форма, в якій напівацетальна гідроксигрупа знаходиться під площиною кільця молекули, називається альфа-формою, над площиною – бета-формою.
Циклічну формулу зображають по-різному. Часто атоми вуглецю в кільці не позначаються (див. формулу бензолу). Щоб було чітко видно не лише кільце, а й розміщення атомів водню та гідроксигруп щодо площини кільця, англійський вчений У. Хеуорс запропонував зображати три зв’язки між атомами вуглецю, повернені вперед до читача, жирними лініями.
Дисахариди мають циклічну будову, яка складається з двох залишків моносахаридів (сахароза – з глюкози та фруктози, мальтоза – з двох залишків глюкози, лактоза – з глюкози та галактози).
Полісахариди (крохмаль, целюлоза) утворені із залишків глюкози.
Поширення у природі. Вуглеводи утворюються в зелених рослинах у результаті фотосинтезу з оксиду вуглецю (IV) та води. їх масова частка становить близько 80 % сухої маси речовини рослин і до 2 % – тваринних організмів.
Вуглеводи відіграють важливу роль у житті людини. Як і жири, вони є джерелом енергії в організмі. їжа людини приблизно на 70 % складається з вуглеводів. Вуглеводи є сировиною для виготовлення паперу, тканин.
У природі найбільш поширені правообертаючі глюкоза, галактоза, маноза, сахароза, лівообертаюча фруктоза.
Властивості вуглеводів розглянемо на прикладі глюкози, сахарози, крохмалю та целюлози.
Глюкоза
Глюкоза має брутто-формулу С6Н12О6.
Класифікація. Глюкоза є моносахаридом, альдогексозою.
Номенклатура. Вживається ще така назва глюкози – виноградний цукор.
Ізомерія. Правообертаюча природна глюкоза має ізомер у класі кетогексоз – фруктозу та п’ятнадцять стереоізомерів у класі альдогексоз, з яких один – лівообертаюча глюкоза, одержана синтетичним шляхом.
Існують ізомери природної глюкози з молекулами відкритої (альдегідної) та циклічної форм. Залежно від просторового положення напівацетальної гідроксигрупи розрізняють альфа- і бета- циклічні форми правообертаючої глюкози.
Будова молекули. У кристалічному стані молекули глюкози мають циклічну будову. У водних розчинах у стані динамічної рівноваги існують альдегідна та циклічна форми (переважає бета-форма).
Поширення в природі. Глюкоза міститься майже в усіх органах рослин – плодах, корінні, листі, квітках. Багато її є у винограді, цукровій тростині, цукрових буряках, солодких фруктах, ягодах. Глюкоза входить до складу тваринних організмів. Її масова частка у крові людини становить близько 0,1 %.
Фізичні властивості. Глюкоза – безбарвна, кристалічна, оптично активна речовина, добре розчиняється у воді, солодка на смак. У подрібненому стані вона мас білий колір. Температура її плавлення становить 146 °С.
Хімічні властивості. Глюкоза вступає в реакції, характерні для альдегідів, спиртів і напівацеталей.
Реакції за участю альдегідної групи. Відновні властивості. Глюкоза вступає в реакцію «срібного дзеркала»:
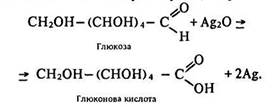
Під час кипіння вона окислюється гідроксидом міді (II) також до глюконової кислоти:
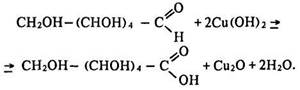
Окисні властивості. Глюкоза відновлюється воднем до шестиатомного спирту сорбіту:
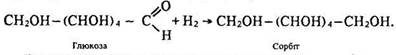
Реакції глюкози з аміачним розчином оксиду срібла (І), гідроксидом міді (ІІ) та воднем підтверджують наявність альдегідної групи в її молекулі.
Реакції за участю спиртових груп.
Взаємодія з гідроксидами металів з утворенням сахаратів:
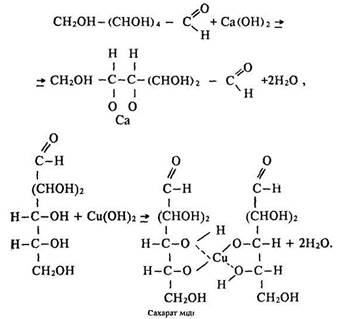
Сахарат міді – комплексна сполука синього кольору. Останню реакцію використовують для виявлення цукру в сечі.
З карбоновими кислотами глюкоза утворює естери за реакцією етерифікації. Так, одна молекула глюкози взаємодіє з п’ятьма молекулами оцтової кислоти:
![]()
Ця реакція підтверджує наявність у молекулі глюкози п’яти спиртових гідроксигруп.
Реакції за участю напівацетальної гідроксигрупи. Глюкоза взаємодіє із спиртами з утворенням речовин, подібних до естерів, – глікозидів:
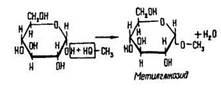
Ця реакція характерна для напівацеталей. Вона підтверджує наявність у молекулі глюкози напівацетальної гідроксигрупи.
Глікозиди містяться в рослинах. Вони застосовуються в медицині як серцеві засоби.
Бродіння. Відомо кілька видів бродіння – спиртове, молочнокисле тощо. Під дією ферментів дріжджів відбувається спиртове бродіння глюкози, внаслідок якого утворюються етанол та оксид вуглецю (IV):
С6Н12О6 = 2С2Н5ОН + 2СО2.
Під дією інших ферментів можуть утворюватися оцтова, молочна та масляна кислоти, ізопропіловий спирт, ацетон.
Окислення. В організмах людини та тварин глюкоза окислюється з виділенням енергії, необхідної для життєдіяльності.
Одержання. В промисловості глюкозу добувають гідролізом крохмалю та клітковини.
Використання. Глюкозу використовують в медицині, для виготовлення кондитерських виробів, дзеркал та іграшок (сріблення), обробки тканин і шкір.
Схароза
Сахароза має брутто-формулу С12Н22О11.
Класифікація. Сахароза є дисахаридом.
Номенклатура. Вживається ще назва сахарози – буряковий або тростинний цукор.
Ізомерія. Природна сахароза є правообертаючим ізомером. Найбільш поширені її природні ізомери – мальтоза та лактоза, молекулярна формула яких така ж, як у сахарози.
Мальтоза (солодкий цукор) утворюється з крохмалю під дією солоду. Лактоза (молочний цукор) міститься в молоці, має високу поживність.
Будова молекули. Молекула сахарози складається із залишків глюкози та фруктози (циклічна альфа-форма), сполучених між собою атомами кисню:
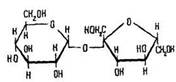
У молекулі сахарози немає альдегідної, карбонільної та напівацетальної гідроксильної груп. Тому хімічні властивості сахарози відрізняються від властивостей моносахаридів.
Поширення в природі. Сахароза міститься в цукрових буряках, стеблах цукрових тростин, соці берези, багатьох плодах і овочах.
Фізичні властивості. Сахароза – безбарвна, кристалічна оптично активна речовина, розчинна у воді, солодка на смак У подрібненому стані вона має білий колір. Температура плавлення становить 111 °С.
![]()
Хімічні властивості.
Гідроліз. Під час нагрівання за наявності іонів водню сахароза гідролізується з утворенням двох моносахаридів – глюкози та фруктози:
Тому сахарозу називають дисахаридом.
Спиртові властивості сахарози. Сахароза, як і глюкоза, легко взаємодіє з гідроксидами металів. Якщо до розчину сахарози долити розчин гідроксиду міді (11), утворюється яскраво-синій розчин комплексної сполуки – сахарату міді, яка за будовою подібна до сполуки глюкози з міддю:
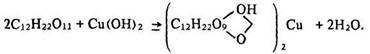
У розчині сахарози суспензія гідроксиду кальцію розчиняється з утворенням сахарату кальцію, який за будовою подібний до сполуки глюкози з кальцієм.
Сахароза не вступає в реакцію «срібного дзеркала» та не відновлюється іншими відновниками.
Одержання. Сахарозу добувають на заводах з цукрових буряків та цукрової тростини.
Використання. Сахароза застосовується в харчовій промисловості.
Крохмаль
Склад крохмалю описується формулою (С6Н10О5)n.
Класифікація. Крохмаль с полісахаридом.
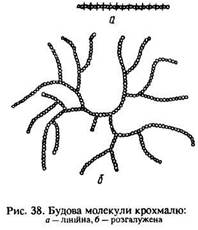
Будова молекули. Крохмаль – природний полімер. Макромолекули в крохмалю неоднакові за структурою та розмірами – молекули лінійної структури містять кілька сотень ланок С6Н12О5, їх молекулярна маса становить кілька сотень тисяч, молекули розгалуженої структури складаються з кількох тисяч ланок С6Н10O5, їх молекулярна маса – кілька мільйонів (рис. 38).
Молекули крохмалю складаються переважно із залишків молекул а-циклічної форми правообертаючої глюкози:
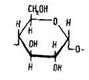
Поширення у природі. Крохмаль – найпоширеніший у рослинному світі вуглевод. Він утворюється в листі в результаті фотосинтезу і відкладається в корінні, бульбах і зернах. Масова частка крохмалю в бульбах картоплі становить близько 20 %, у зернах пшениці та кукурудзи – 70, рису – близько 80 %. Процес фотосинтезу описується загальним рівнянням:
![]()
Фізичні властивості. Крохмаль – білий порошок, нерозчинний у холодній воді, спирті, ефірі. У гарячій воді він набухає і утворює колоїдний розчин – клейстер.
Хімічні властивості. Крохмаль не мас відновних властивостей альдегідів – не відновлює гідроксид міді (II), не вступає в реакцію «срібного дзеркала».
Гідроліз. Під час нагрівання з водою за наявності кислоти або під дією ферментів крохмаль гідролізується. Спочатку утворюються проміжні продукти з меншою відносною молекулярною масою, ніж у крохмалю, – полісахариди декстрини, потім – ізомер сахарози – мальтоза. Кінцевим продуктом гідролізу є глюкоза. Сумарне рівняння гідролізу мас такий вигляд:
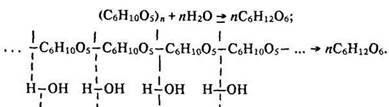
Здатність гідролізуватися – важлива хімічна властивість крохмалю. На реакції гідролізу крохмалю базується промисловий метод добування глюкози.
Взаємодія з йодом. Під дією йоду на крохмаль утворюється речовина синього кольору. Ця дуже чутлива реакція використовується для визначення крохмалю та йоду.
Одержання. Крохмаль добувають переважно з картоплі, рису, кукурудзи. Крохмаль харчових продуктів (хліба, картоплі, круп) у цілому задовольняє потребу людини у вуглеводах. В організмі людини крохмаль, як і жири, гідролізується, засвоюється кінцевий продукт гідролізу крохмалю – глюкоза.
Використання. Крохмаль застосовується у виробництві антибіотиків, вітамінів, ковбас, кондитерських виробів, у медицині, для крохмалення білизни, обробки тканин. Багато його переробляють на етиловий спирт, глюкозу, декстрини та інші речовини.
Целюлоза
Целюлоза є полісахаридом. Вона має таку ж форму, як і крохмаль – (С6Н10О5)n.
Будова молекули. Целюлоза, подібно до крохмалю, є природним полімером. Молекули деяких видів целюлози містять до 40 тисяч ланок С6Н10O5 (відносна молекулярна маса – кілька мільйонів).
Макромолекули крохмалю та целюлози різняться за структурою. Макромолекули крохмалю складаються із залишків молекул альфа-глюкози і мають лінійну та розгалужену структуру (див. рис. 38). Молекули целюлози утворені залишками молекул бета-глюкози і характеризуються лише лінійною структурою (рис. 39).
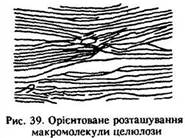
Внаслідок цього, на відміну від крохмалю, целюлоза легко утворює волокна і не входить до складу продуктів харчування людини. В молекулах целюлози немає альдегідної, карбонільної та напівацетатної гідроксигруп.
Вони містять лише спиртові гідроксигрупи, які обумовлюють її властивості багатоатомного спирту.
Поширення у природі. Целюлоза є головною складовою частиною оболонок клітин вищих рослин. її масова частка в деревині становить близько 50 %, у волокнах бавовни – до 98, у корі джута – до 75 %. Гігроскопічна вата та фільтрувальний папір – майже чиста целюлоза.
Фізичні властивості. Целюлоза (клітковина) – біла тверда волокниста речовина, без смаку та запаху, нерозчинна у воді та органічних розчинниках. Вона не мас сталої температури плавлення.
Хімічні властивості. Целюлоза, як і крохмаль, не виявляє відновних властивостей альдегіду – не окислюється гідроксидом міді (II), не вступає в реакцію «срібного дзеркала».
Гідроліз. Целюлоза, подібно до крохмалю, гідролізується під дією розведених кислот. Кінцевим продуктом гідролізу є глюкоза. Сумарне рівняння гідролізу целюлози має такий вигляд:
(С6Н10О5)n + nН2O = nС6Н12О6.
Здатність гідролізуватися – важлива хімічна властивість целюлози. Глюкозу, що утворюється внаслідок гідролізу целюлози, переробляють на етанол. Етанол, добутий з деревини, називається гідролізним. У виробництві гідролізного спирту 1 т деревини замінює 1,5 т картоплі або 0,7 т зерна.
Реакція етерифікації. Целюлоза в кожній ланці С6Н10О5 має по три спиртові гідроксигрупи, завдяки яким може утворювати етери та естери.
Під час взаємодії целюлози з концентрованою азотною кислотою за наявності концентрованої сірчаної кислоти (водо- поглинаючий засіб) утворюються естери – моно-, ди- та тринітраті целюлози:
![]()
Нітрати целюлози – надзвичайно горючі. Тринітратцелюлоза (піроксилін) – вибухова речовина, що використовується для виробництва бездимного пороху. Під час вибуху вона розкладається:
![]()
Целюлоза з оцтовою кислотою утворює оцтовокислі естери:
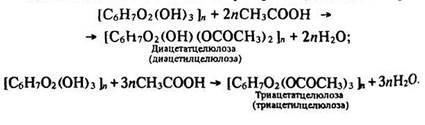
Диацетат- та триацетатцелюлози застосовуються у виробництві штучного ацетатного волокна. Людина здавна використовує природні волокнисті матеріали для виготовлення одягу та інших побутових виробів. Прикладами природних волокнистих матеріалів рослинного походження є льон, бавовна, коноплі (складаються з целюлози), тваринного – вовна, шовк (складаються з білків).
На сьогодні широко використовують хімічні волокна, які добувають хімічними методами. Хімічне волокно називається штучним, якщо його добувають переробкою природних полімерних матеріалів (наприклад, целюлози) або синтетичним, коли його одержують із синтетичних матеріалів. Штучне ацетатне волокно має цінні властивості – воно досить міцне, м’яке, майже не бгається, мало збігається від прання, має приємний блиск. Його недоліком є те, що воно менш гігроскопічне, ніж природне бавовняне, і накопичує статичні електричні заряди.
Горіння. Целюлоза добре горить:
![]()
Термічний розклад. Під час нагрівання без доступу повітря целюлоза розкладається з утворенням деревного вугілля, води та летких органічних речовин (метанолу, оцтової кислоти, ацетону тощо).
Використання. Целюлозу в складі деревини використовують як будівельний матеріал і для виготовлення різних столярних виробів, у складі волокнистих матеріалів (бавовни, льону, конопель) – для виготовлення ниток, тканин, канатів. Багато целюлози переробляють на папір, етиловий спирт, вату, прості та складні ефіри, які є сировиною для виробництва штучних волокон (віскозних, ацетатних), штучної шкіри, пластичних мас (целулоїду, целофану), лаків, електроізоляційних покриттів, негорючої кіноплівки, іонітів, медичного колодію тощо.