41. Аміни
39. Аміни
| Website: | Підготовка до ЗНО - Освітній портал "Академія" |
| Kurs: | Підготовка до ЗНО з хімії |
| Buch: | 41. Аміни |
| Gedruckt von: | Gast |
| Datum: | Sunday, 25. May 2025, 05:26 |
Аміни
Визначення. Амінами називаються продукти заміщення одного, двох або трьох атомів водню в аміаку NH3 вуглеводневими радикалами.
Класифікація. Залежно від числа атомів водню в аміаку, заміщених радикалами, розрізняють такі аміни: первинні із загальною формулою R–NН2, вторинні – R2NH та третинні
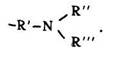
За природою вуглеводневого радикалу аміни поділяють на аліфатичні, аліциклічні, ароматичні та гетероциклічні.
Номенклатура. Назви первинних амінів складаються з назви вуглеводню із закінченням -амін. Цифрою після назви вказують положення аміногрупи. Використовуються також назви амінів як похідних вуглеводнів із замісником аміногрупою –NН2:
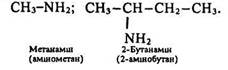
Назви вторинних і третинних амінів утворюють від назви найбільшого вуглеводневого радикалу, перед яким ставлять назви інших радикалів з буквами N:
N-Метилетанамін СН3–NН–СН2–СН3;
N,N-Діетилбензоламін (С2Н5)2N–С6H5;
Симетричні (з однаковими радикалами) вторинні та третинні аміни називають також, додаючи до назви радикалу префікси ди- або три-: (С6Н5)2NH –дифеніламін, (СН3)3N – триметиламін.
Ізомерія. Ізомерія амінів обумовлена ізомерією вуглецевого ланцюга, положенням аміногрупи в ньому та міжгруповою ізомерією. Розглянемо такі аміни:
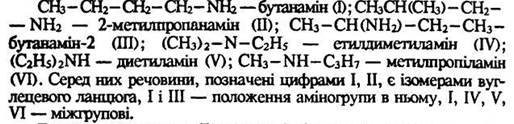
Будова молекули. Електронні формули первинного (І), вторинного (II), третинного (III) амінів та аміаку (IV)
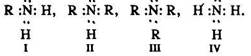
У всіх амінів, як і в аміаку, орбіталі атома азоту перебувають у стані sр3-гібридизації і мають вільну неподілену електронну пару, за рахунок якої атом азоту може приєднувати до себе протон Н+ води або кислот. Тому аміни, як і аміак, виявляють основні властивості. Аміни – органічні основи. їх амінні групи, як і молекули аміаку, – пірамідальної форми з кутами С–N–С або С–N–Н, що дорівнюють куту Н–N–Н у аміаку (107°). Радикали мають таку будову: алкільні – тетраедричну, арильні – площинну (рис. 40 і 41).
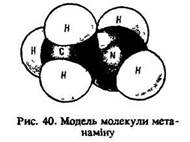

Аміни – полярні сполуки, які, за винятком третинних, утворюють міжмолекулярні водневі зв'язки. Усі аміни з водою утворюють водневі зв’язки. Радикали та аміногрупи взаємно впливають один на одного.
Аліфатичні аміни є сильнішими основами, ніж аміак, ароматичні – слабкішими внаслідок різних індукційних ефектів радикалів (п. 22.2).
В ароматичних амінів із збільшенням числа вуглеводневих радикалів основність слабшає, а в аліфатичних – посилюється.
За посиленням основних властивостей аміак, первинні, вторинні, третинні аліфатичні та ароматичні аміни можна розташувати у такій послідовності:
![]()
Аміногрупа, в свою чергу, впливає на властивості радикалу. В ароматичних амінах рухливість атомів водню бензольного ядра зростає порівняно з бензолом. Так, анілін С6Н5NH2 легше вступає в реакції заміщення, ніж бензол.
Поширення в природі. Аміни є продуктами метаболізму живих організмів.
Фізичні властивості. Температури плавлення та кипіння амінів вищі, ніж неполярних сполук з тією ж молекулярною масою, але нижчі, ніж спиртів або карбонових кислот.
Метанамін, диметиламін, триметиламін – гази, добре розчинні у воді, мають запах аміаку. Середні члени гомологічного ряду – рідини, вищі – тверді речовини з запахом риби, нерозчинні у воді.
Хімічні властивості. Аміни за хімічними властивостями подібні до аміаку. Для них характерні основні властивості.
Основні властивості Взаємодія з водою. Аміни розчиняються у воді, утворюючи іон алкіламонію
Внаслідок цього водні розчини амінів мають лужну реакцію. Вони змінюють колір індикаторів: фенолфталеїну – на малиновий, лакмусу – на синій. Іон алкіламонію має таху ж будову, як іон амонію. Це – комплексний тетраедричний іон, у якому азот є чотиривалентним зі ступенем окислення -3.
[RNH3]+, то супроводжується появою у розчині гідроксид - іонів:
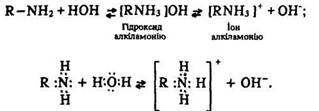
Взаємодія з кислотами. Аміни, як і аміак, реагують з мінеральними кислотами, утворюючи солі:
![]()
Ця реакція може відбуватися в газоподібному стані, в розчинах і з твердими амінами.
Алкіламонієві солі, як і солі амонію, – тверді речовини іонної будови, що не мають запаху і добре розчиняються у воді. У водних розчинах вони повністю дисоціюють:
![]()
Під дією лугів (особливо під час нагрівання) ці сполуки розкладаються з виділенням вільних амінів:
![]()
Горіння. На відміну від аміаку аміни горять на повітрі (згадайте, за яких умов горить аміак):
![]()
Одержання. Аміни добувають відновленням нітросполук (п. 24.1).
Анілін
Молекулярна формула аніліну С6Н5NH2.
Класифікація. Анілін – представник первинних ароматичних амінів.
Номенклатура. Вживаються ще такі назви аніліну – бензоламін і феніламін.
Будова молекули. Електронна та структурна формули аніліну мають такий вигляд:

Радикал феніл С6H5– – виявляє негативний індукційний ефект, притягує до себе неподілену електронну пару азоту аміногрупи, яка спряжена з шести-пі-електронною хмарою радикалу фенілу. Внаслідок цього електронна густина на атомі азоту зменшується і він слабкіше зв'язує іон водню, ніж в аміаку та алкіламінах. Тому основні властивості аніліну слабкіші, ніж алкіламінів. Згадайте, що у фенолі С6Н5ОН радикал феніл притягує до себе електрони атома кисню гідроксигрупи і посилює кислотні властивості речовини.
Фізичні властивості. Анілін – безбарвна масляниста дуже отруйна рідина з характерним запахом, малорозчинна у воді. На повітрі вона темніє внаслідок окислення.
Хімічні властивості. Основні властивості. Анілін – слабка основа. Він не взаємодіє з водою, його водні розчини не змінюють забарвлення індикаторів.
З сильними кислотами анілін утворює солі:
![]()
Хлорид феніламонію (солянокислий анілін) добре розчиняється у воді. Внаслідок дії на нього лугу виділяється анілін у вільному стані:
![]()
Реакції бензольного ядра. Атоми водню бензольного ядра аніліну легко заміщуються на галогени, нітро- та сульфогрупи. Ці реакції відбуваються значно легше, ніж у бензолу, замісники займають орто- та пара- положення щодо аміногрупи, оскільки вона впливає на бензольне ядро як замісник першого роду (згадайте аналогічний характер впливу гідроксигрупи -ОН у фенолі).
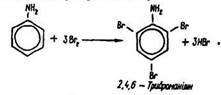
Бензол, як відомо, з бромною водою не взаємодіє.
Під дією бромної води на водний розчин аніліну виділяється білий осад триброманіліну:
Окислення. Анілін легко окислюється киснем повітря та іншими окисниками, утворюючи продукти різного кольору.
Під час взаємодії з хлорним вапном СаОСl2 виникає характерне фіолетове забарвлення. Ця реакція є найбільш чутливою якісною реакцією на анілін.
Внаслідок взаємодії аніліну з хромовою сумішшю (концентрована сірчана кислота та дихромат калію К2Сr2O7) утворюється чорний осад, який називають чорним аніліном. Він нерозчинний у воді, стійкий до дії мила та світла, використовується як стійкий барвник (для фарбування тканин та хутра).
Одержання. Метод добування аніліну відновленням нітробензолу, відкритий у 1840 р. російським вченим М. Зініним (1812–1880), мав велике значення для розвитку хімії та хімічної промисловості.
Схематично реакцію Зініна можна зобразити рівнянням:
![]()
М. Зінін застосував як відновник сульфід амонію.
Основним способом добування аніліну є відновлення нітробензолу залізом за участю хлороводневої кислоти:
![]()
Зараз застосовують каталітичне відновлення нітробензолу. Відновником є водень, одержаний електролітичним способом або з водяного газу.
Використання. Анілін – один з найважливіших продуктів хімічної промисловості. Він є вихідною речовиною для добування анілінових барвників, ліків (сульфаніламідів), вибухових речовин, високомолекулярних сполук тощо.