41. Аміни
Анілін
Молекулярна формула аніліну С6Н5NH2.
Класифікація. Анілін – представник первинних ароматичних амінів.
Номенклатура. Вживаються ще такі назви аніліну – бензоламін і феніламін.
Будова молекули. Електронна та структурна формули аніліну мають такий вигляд:

Радикал феніл С6H5– – виявляє негативний індукційний ефект, притягує до себе неподілену електронну пару азоту аміногрупи, яка спряжена з шести-пі-електронною хмарою радикалу фенілу. Внаслідок цього електронна густина на атомі азоту зменшується і він слабкіше зв'язує іон водню, ніж в аміаку та алкіламінах. Тому основні властивості аніліну слабкіші, ніж алкіламінів. Згадайте, що у фенолі С6Н5ОН радикал феніл притягує до себе електрони атома кисню гідроксигрупи і посилює кислотні властивості речовини.
Фізичні властивості. Анілін – безбарвна масляниста дуже отруйна рідина з характерним запахом, малорозчинна у воді. На повітрі вона темніє внаслідок окислення.
Хімічні властивості. Основні властивості. Анілін – слабка основа. Він не взаємодіє з водою, його водні розчини не змінюють забарвлення індикаторів.
З сильними кислотами анілін утворює солі:
![]()
Хлорид феніламонію (солянокислий анілін) добре розчиняється у воді. Внаслідок дії на нього лугу виділяється анілін у вільному стані:
![]()
Реакції бензольного ядра. Атоми водню бензольного ядра аніліну легко заміщуються на галогени, нітро- та сульфогрупи. Ці реакції відбуваються значно легше, ніж у бензолу, замісники займають орто- та пара- положення щодо аміногрупи, оскільки вона впливає на бензольне ядро як замісник першого роду (згадайте аналогічний характер впливу гідроксигрупи -ОН у фенолі).
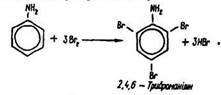
Бензол, як відомо, з бромною водою не взаємодіє.
Під дією бромної води на водний розчин аніліну виділяється білий осад триброманіліну:
Окислення. Анілін легко окислюється киснем повітря та іншими окисниками, утворюючи продукти різного кольору.
Під час взаємодії з хлорним вапном СаОСl2 виникає характерне фіолетове забарвлення. Ця реакція є найбільш чутливою якісною реакцією на анілін.
Внаслідок взаємодії аніліну з хромовою сумішшю (концентрована сірчана кислота та дихромат калію К2Сr2O7) утворюється чорний осад, який називають чорним аніліном. Він нерозчинний у воді, стійкий до дії мила та світла, використовується як стійкий барвник (для фарбування тканин та хутра).
Одержання. Метод добування аніліну відновленням нітробензолу, відкритий у 1840 р. російським вченим М. Зініним (1812–1880), мав велике значення для розвитку хімії та хімічної промисловості.
Схематично реакцію Зініна можна зобразити рівнянням:
![]()
М. Зінін застосував як відновник сульфід амонію.
Основним способом добування аніліну є відновлення нітробензолу залізом за участю хлороводневої кислоти:
![]()
Зараз застосовують каталітичне відновлення нітробензолу. Відновником є водень, одержаний електролітичним способом або з водяного газу.
Використання. Анілін – один з найважливіших продуктів хімічної промисловості. Він є вихідною речовиною для добування анілінових барвників, ліків (сульфаніламідів), вибухових речовин, високомолекулярних сполук тощо.