42. Амінокислоти. Білки
40. Амінокислоти. Білки
| Сайт: | Підготовка до ЗНО - Освітній портал "Академія" |
| Курс: | Підготовка до ЗНО з хімії |
| Книга: | 42. Амінокислоти. Білки |
| Надруковано: | Гість |
| Дата: | Sunday 25 May 2025 5:07 AM |
Амінокислоти
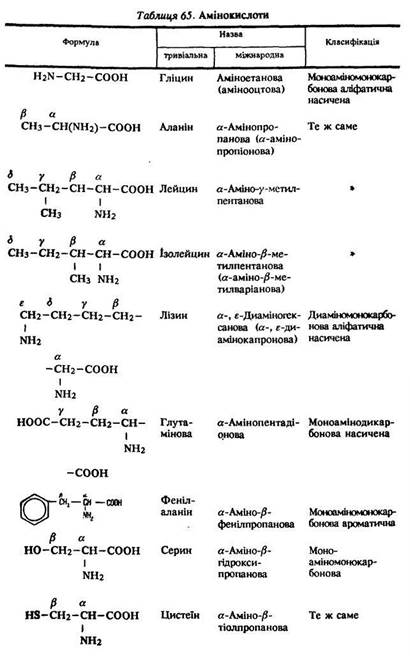
Визначення. Амінокислоти – це органічні кислоти, що містять у вуглеводневому радикалі аміногрупу –NH2. їх загальна формула ![]() . Амінокислоти є прикладом органічних речовин, які мають кілька різних функціональних груп – аміно- та карбоксильну (табл. 65).
. Амінокислоти є прикладом органічних речовин, які мають кілька різних функціональних груп – аміно- та карбоксильну (табл. 65).
Класифікація. Залежно від числа аміно- та карбоксиг- руп розрізняють такі кислоти: моноаміномонокарбонові H2N–R–СООН; диаміномонокарбонові (NН2)2–R–СООН; моноамінодикарбонові H2N–R–(СООН)2, диамінодикарбонові (NН2)2–R–(СООН)2.
За положенням аміногрупи щодо карбоксильної розрізняють альфа-, бета-, гамма-, дельта- та епсилон-амінокислоти (рис. 42).
Вживають також цифрові позначення положення замісників:
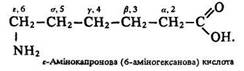
Найбільше біогенетичне значення мають альфа-амінокислоти, з яких побудовані білки, їх загальна формула має такий вигляд:
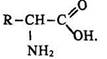
Аміногрупа цих амінокислот знаходиться біля сусіднього з карбоксильним атома вуглецю.
Залежно від природи вуглеводневого радикалу розрізняють аліфатичні, ароматичні, аліциклічні та гетероциклічні амінокислоти. До складу радикалу амінокислот можуть входити різні функціональні групи: гідрокси –ОН, тіо –S–, тіол –SН та ін.
Номенклатура. Багато кислот має тривіальні назви, наприклад гліцин, аланін. За міжнародною номенклатурою назви амінокислот утворюються від назв відповідних карбонових кислот з додаванням префікса аміно- (див. табл. 65).
Ізомерія. Для амінокислот характерна структурна та стереоізомерія. їх структурна ізомерія обумовлена ізомерією вуглецевого ланцюга та положенням аміногрупи щодо карбоксилу (ізомерія положення). Так, лейцин та ізолейцин – ізомери ланцюга, альфа-амінокапронова кислота СН3–СН2–СН2–СН2–СН(NH2)–СООН і епсилон-амінокапронова кислота H2N–СН2–СН2–СН2–СН2–СН2–СООН – ізомери положення аміногрупи.
Стереоізомерія альфа-амінокислот обумовлена просторовою асиметрією атома вуглецю, зв’язаного з чотирма різними групами атомів: R-NН2, –Н, –СООН. Стереоізомери амінокислот виявляють оптичну активність і внаслідок цього називаються оптичними. Природні альфа-амінокислоти є лівообертаючими ізомерами.
Будова молекули. Молекули амінокислот містять дві функціональні групи з протилежними хімічними властивостями – аміногрупу – з основними та карбоксильну – з кислотними. Ці дві групи, знаходячись в одній молекулі, взаємодіють між собою з утворенням внутрішньої солі
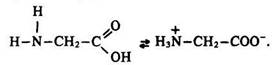
Молекула амінокислоти є біполярним іоном. Цим пояснюються фізичні та хімічні властивості амінокислот.
Поширення в природі. Амінокислоти в природі існують у вільному стані та в складі інших сполук. Подібно до того, як із молекул глюкози побудовані високомолекулярні природні вуглеводи – крохмаль та целюлоза, із молекул амінокислот утворені всі рослинні та тваринні білки. Відмінність полягає лише в тому, що у крохмалю та целюлози мономером є одна речовина – глюкоза, а до складу кожного білка входять різні амінокислоти. Білки містять 26 амінокислот, найчастіше трапляються 22 з них.
Амінокислоти відіграють важливу роль в обміні азотовмісних сполук у живих організмах. З них утворюються необхідні для життєдіяльності речовини: білки, пептиди, ферменти, гормони тощо.
Амінокислоти, які можуть синтезуватися в організмі тварин і людини з інших амінокислот або небілкових компонентів, називаються замінними (гліцин, серин, глутамінова кислота), а ті, що не синтезуються, але є необхідними для життєдіяльності – незамінними (лізин, лейцин, ізолейцин, фенілаланін). Відомо дев’ять незамінних амінокислот. Вони синтезуються лише в зелених рослинах.
Фізичні властивості. Амінокислоти – це безбарвні нелеткі кристалічні, оптично активні речовини з температурами плавлення більшими, ніж у амінів і карбонових кислот, розчинні у воді. Багато з них є солодкими на смак.
Властивості амінокислот обумовлені будовою їх молекул – утворенням біполярного іона.
Хімічні властивості.
Амфотерність. Амінокислоти виявляють подвійну хімічну функцію: основну та кислотну, тобто вони є амфотерними органічними сполуками. Від неорганічних амфотерних сполук вони відрізняються тим, що їх кислотні та основні властивості обумовлені різними групами.
Розчини амінокислот, які містять у молекулах однакове число аміно- та карбоксигруп, нейтральні і не впливають на забарвлення індикаторів. Розчин моноамінодикарбонової кислоти мас кислу реакцію (змінює колір індикаторів як кислота), а диаміномонокарбонової – лужну (змінює колір індикаторів як луг).
Кислотні властивості. За наявності лугів амінокислоти виявляють звичайні властивості кислот і утворюють солі:
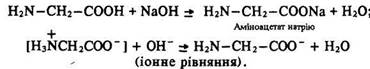
Амінокислоти взаємодіють з металами та основними оксидами з утворенням солей.
Із спиртами амінокислоти подібно до неорганічних та органічних кислот утворюють естери:
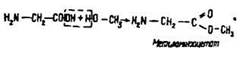
Основні властивості Амінокислоти виявляють властивості органічних основ і з сильними мінеральними кислотами утворюють солі:
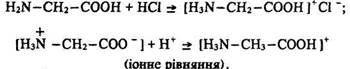
Поліконденсація. Для амінокислот характерні реакції поліконденсації з утворенням поліпептидів:
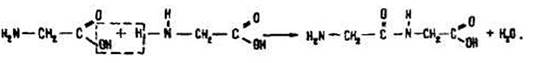
В результаті цієї реакції утворюється група атомів –СONH–, яка називається пептидною, або амідною, а зв’язок між атомами вуглецю та азоту в ній – пептидним (амідним). Речовини, які містять пептидні групи – поліпептиди.
Під час взаємодії двох молекул амінокислот утворюються дипептиди, трьох – трипептиди, чотирьох – тетрапептиди:
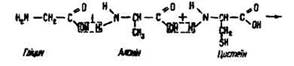
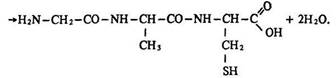
За допомогою пептидних зв’язків залишки амінокислот сполучаються і утворюють молекули білків. Так спрощено можна уявити синтез білків, що відбувається в живих організмах.
Під час конденсації епсилон-амінокапронової кислоти утворюється полімер капрон:
1) одержання галогенозаміщеної карбонової кислоти:
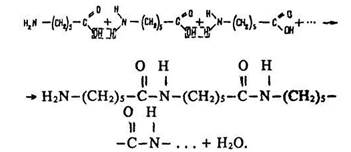
Макромолекули капрону мають лінійну структуру. їх будову можна зобразити формулою:
![]()
Молекулярна маса макромолекул становить 16–22 тис. Капрон витягують у волокно, яке не поглинає воду, не втрачає міцність, не гниє у вологому стані і не псується міллю. Воно більш стійке до стирання, ніж усі натуральні волокна. Висока міцність капрону обумовлена утворенням численних водневих зв’язків між його макромолекулами в результаті взаємодії груп –NН– та –СО–.
Але капрон має також істотні недоліки – його молекули гідролізуються під дією кислот в місцях амідних зв’язків, за температури 215 °С він плавиться.
Одержання. Амінокислоти добувають гідролізом білків (подібно до того, як глюкозу одержують гідролізом високомолекулярних вуглеводнів). Один із синтетичних способів добування амінокислот складається з двох стадій:
1. одержання галогензаміщеної карбонової кислоти
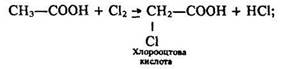
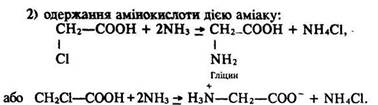
Використання. Амінокислоти застосовують у медицині, а також для годівлі тварин, як вихідні речовини для добування пластмас та штучних волокон.
З капронового волокна виготовляють одяг, штучне хутро, парашути, канати, рибальські сітки. З особливо міцного капрону виробляють кордову тканину для авто- та авіапокришок, деталі машин і приладів.
Білки
Визначення. Білки – біополімери, які складаються зі з’єднаних у певній послідовності пептидними зв'язками залишків альфа-амінокислот. Існує величезна кількість різних білків. Білкові молекули надзвичайно складні. їх молекулярні маси мають значення від 6 тис. до кількох мільйонів.
Елементний аналіз різних білків свідчить, що вони складаються з вуглецю (50–55 %), водню (близько 7), кисню (21,5–23,5), азоту (15–17) та сірки (0,3–2,5 %). Крім того, в білках може міститися невелика кількість фосфору, галогенів, металів. Так, емпірична формула гемоглобіну – білка крові ![]()
Класифікація. Через наявність різноманітних функціональних груп білки не можна віднести до якогось певного класу органічних сполук. Вони поєднують ознаки різних класів, що дає нову якість. Білок – вища форма розвитку органічних речовин. Величезна різноманітність білків, що містяться в органах і тканинах тварин, рослин, мікроорганізмів, обумовлена безмежним числом комбінацій амінокислот, які різняться поєднанням різної кількості неоднакових амінокислот, порядком їх чергування у поліпептидних ланцюгах і просторовою структурою ланцюгів.
За хімічним складом білки поділяють на дві групи – прості та складні.
До простих білків, або протеїнів, належать такі, що гідролізуються до амінокислот. їх кількість невелика.
Складні білки, або протеїди, в результаті гідролізу утворюють, крім амінокислот, речовини небілкової природи (вуглеводи, фосфорну кислоту, нуклеїнові кислоти тощо).
За фізіологічними функціями білки поділяються на два класи: фібрилярні та глобулярні. З фібрилярних побудовані волокна живих тканин. До них належать кератин (шкіра, волосся, нігті, роги, пір’я, м’язи). Глобулярні білки підтримують і регулюють життєві процеси. До них належать усі ферменти, гемоглобін – носій кисню в крові, багато гормонів, зокрема інсулін підшлункової залози.
Номенклатура. Білки мають тривіальні назви, наприклад гемоглобін, рибонуклеаза, фібриноген.
Будова молекул. Основні відомості про склад та хімічну будову білків одержані під час вивчення їх гідролізу. В результаті гідролізу будь-якого білка утворюється суміш альфа-амінокислот. В білках вони з’єднані між собою пептидними (амідними) зв’язками –NНСО– і утворюють пептидні ланцюги будь-якої довжини:
Поліпептидний ланцюг з певною послідовністю чергування амінокислотних залишків називається первинною структурою білка (рис. 43).
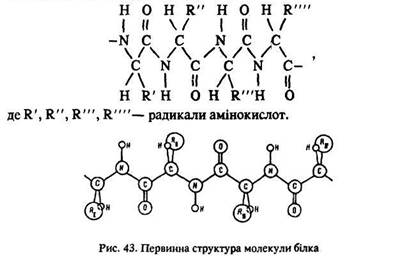
Кожний блок має свою послідовність чергування амінокислотних ланок – певну первинну структуру. Перший білок, первинну структуру якого у 1954 р. вдалося розшифрувати англійцю Ф. Сенгеру (лауреат Нобелівської премії 1958 р.), – інсулін. Це – речовина, що регулює вміст цукру в крові. Його молекула складається з двох поліпептидних ланцюгів, один з яких містить 21 залишок амінокислот, а другий – 30 (рис. 44). Зараз визначено первинні структури багатьох білків.
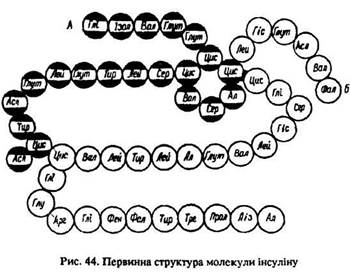
Встановлення структури білків – дуже складна проблема, тому що вони характеризуються не лише хімічним складом та порядком чергування амінокислотних ланок у поліпептидному ланцюгу, але й формою та просторовим положенням пептидних ланцюгів. Тому крім первинної структури розрізняють ще й вторинну. Пептидна група [–СО–NН–] полярна і здатна утворювати водневі зв’язки. Окремі поліпептидні ланцюги, зв’язані між собою за допомогою цих водневих зв’язків, формують складні спіралеподібні просторові конфігурації, які називаються вторинною структурою білка (рис. 45).
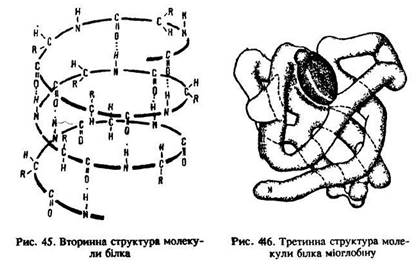
Третинна структура – це тривимірна конфігурація, утворена складанням вторинних структур (рис. 46). Поліпептидний ланцюг (первинна структура) міоглобіну закручений у спіраль (вторинна структура), яка згорнута в клубок (третинна структура).
Третинна структура утримується взаємодією між функціональними групами радикалів поліпептидного ланцюга, спрямованих назовні. Так, під час зближення карбоксильної та аміногрупи утворюється сольовий місток, карбоксильної та гідроксильної – складноефірний, атомів сірки – дисульфідний (–S–S–). Так, у молекулі інсуліну два пептидні ланцюги з’єднані між собою двома дисульфідними містками. Третинна структура обумовлює специфічну біологічну активність білкової молекули.
Біологічна активність білків залежить від хімічної будови та просторової' конфігурації молекул. Відомі випадки, кали навіть незначні заміни амінокислотного складу значно змінюють властивості білків. Заміна в молекулі гемоглобіну лише одного амінокислотного залишку із трьох викликає захворювання крові.
Фізичні властивості. Фібрилярні білки нерозчинні у воді, глобулярні – розчинні у воді та водних розчинах кислот, лугів, солей.
Деякі білки можна виділити в кристалічному стані (гемоглобін крові, білок курячого яйця).
Хімічні властивості.
Гідроліз. Під дією ферментів або внаслідок нагрівання з розчином кислоти чи лугу білки гідролізуються. Повний гідроліз одного трипептиду описується таким рівнянням:
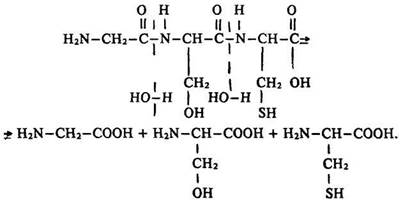
Кінцевим продуктом гідролізу білків є амінокислоти. Здатність гідролізуватися – важлива хімічна властивість білків.
Амфотерність. Наявність у радикалах амінокисотних ланок білків груп –СООН та –NH2 – обумовлює амфотерні властивості білків. Вони взаємодіють з основами та кислотами, утворюючи солі:
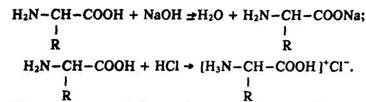
Якщо в молекулі білка міститься більше карбоксильних груп, ніж амінних, він виявляє властивості кислоти. У разі, коли переважають аміногрупи, білок має властивості основи.
Денатурація. Денатурація білків – це руйнування їх конфігурації (вторинної та третинної структури) під дією нагрівання, радіації, сильних кислот, лугів, солей важких металів, сильного струшування тощо. Причина денатурації полягає в порушенні зв’язків (водневих, сольових, ефірних, дисульфід них), які обумовлюють вторинну та третинну структури. Внаслідок цього просторова структура білка дезорієнтується і втрачає біологічну активність. Денатурацію ми спостерігаємо, коли готуємо їжу, зокрема варимо яйця.
Під час сильного нагрівання відбувається розклад білків з виділенням летких речовин, які мають характерний запах паленого пір’я. Це явище використовують для виявлення білків.
Характерні кольорові реакції на білки. Біуретова реакція. Під дією на білок лугу та кількох крапель мідного купоросу (СuSO4x5Н2О) утворюється фіолетове забарвлення.
Ксантопротеїнова реакція. Внаслідок дії на білок, що містить бензольне кільце, концентрованої азотної кислоти виникає жовте забарвлення. В результаті додавання лугу жовтий колір перетворюється на оранжевий.
Значення білків. Білки – найважливіша складова частина живих організмів. Вони входять до складу протоплазми та ядер усіх рослинних і тваринних клітин.
Тваринні організми будують свої білки з амінокислот, які вони одержують з їжею. Відсутність або нестача білків у їжі викликає захворювання. Поживна цінність білків визначається їх амінокислотним складом, вмістом незамінних амінокислот.
Після надходження білків до організму під дією ферментів у шлунку та кишечнику відбувається їх гідроліз. Амінокислоти, що утворюються, через стінки кишечника всмоктуються в кров і розносяться по тканинах і клітинах, де з них синтезуються необхідні білки. Якщо їжа тварин містить не всі незамінні амінокислоти, зупиняється ріст, зменшується маса тіла, може навіть настати смерть.
За участю білків регулюються найважливіші властивості організму – ріст, рухливість, діяльність органів чуття, спадковість, імунітет тощо.
Одержання. Молекула білка в клітині утворюється протягом 2–3 с. Це – надзвичайно складний біохімічний процес.
Вивчення білкових речовин необхідне для пізнання процесів життєдіяльності та їх свідомого регулювання.
Використання. Білки застосовуються у промисловості у вигляді природних волокон (шовк, вовна), шкіри, желатину, казеїнових пластмас.
Важливе значення має виробництво медичних білкових препаратів – гормонів, сироваток, кровозамінників.