2. ОСНОВНІ ПОНЯТТЯ ХІМІЇ
2. ОСНОВНІ ПОНЯТТЯ ХІМІЇ
2.2. Валентність атомів елементів у сполуках. Хімічні формули
Для розуміння хімічних формул та правильного їх написання, слід ознайомитись з теорією валентності.
Атоми різних хімічних елементів можуть сполучатися між собою у певних відношеннях з утворенням різних хімічних сполук.
Ці відношення визначає валентність (лат valencio – сила) – здатність атомів хімічного елемента сполучатись з певною кількістю атомів інших елементів з утворенням хімічних зв’язків. Валентність атома Гідрогену прийнято за одиницю. На основі цього можна розрахувати валентності інших елементів, знаючи хімічний склад їх сполук з Гідрогеном. Так, у молекулі HCl, яка містить атоми Хлору і Гідрогену у відношенні 1:1, Хлор одновалентний, у молекулі H2O – Оксиген двовалентний (Н:О = 2:1). Якщо елемент не утворює сполук з Гідрогеном, то його валентність можна визначити за Оксигеном, який майже завжди двовалентний, наприклад у FeO, Ферум – двовалентний, а в Al2O3 – Алюміній тривалентний.
Атоми деяких елементів виявляють змінну валентність. Так, у FeO Ферум – двовалентний, а у Fe2O3 – тривалентний (табл. 2.1).
Таблиця 2.1
Валентності атомів деяких елементів
|
Хімічний елемент |
Валентність |
Приклади формул сполук |
|
Валентність стала |
||
|
H, Li, Na, K |
І |
H2O, Na2O |
|
O, Ca, Zn |
ІІ |
CaO, ZnO |
|
Al |
ІІІ |
Al2O3 |
|
Валентність змінна |
||
|
Cu |
I i II |
Cu2O, CuO |
|
Fe, Co, Ni |
II i III |
FeO, Fe2O3 |
|
C, Sn, Pb |
II i IV |
CO, CO2 |
|
P |
III i V |
PH3, P2O5 |
|
Cr |
II, III i IV |
CrO, Cr2O3, CrO3 |
|
S |
II, IV і VI |
H2S, SO2, SO3 |
Знаючи валентності елементів можна складати хімічні формули сполук. Наприклад, відомо, що атом Сульфуру чотиривалентний, а Оксигену – двовалентний і вони утворюють сполуку SxOy. Для правильного написання формули слід над символами елементів записати їх валентності SIVxOIIy, і валентність першого атома (S) поставити нижнім індексом арабською цифрою біля атома другого (О) і навпаки (валентність атома Оксигену біля атома Сульфуру). Маємо S2O4. Даля, одержані індекси ділимо на менший з них. Якщо одержуємо ціле число (у нашому випадку 2/2 = 1 і 4/2 = 2), то записуємо значення біля символів атомів відповідних елементів, а якщо дробові – залишаємо індекси без змін. Отже, вірна формула – SO2.
Атоми можуть сполучатись не лише між собою, а і з групами атомів, які виявляють сталу валентність. Так, іони F–, Cl–, Br–, I–, NO3–,ОН– – одновалентні, SO42–, SO32–, CO32–, SiO32– – двовалентні, РО43– і ВО32– – тривалентні. Знаючи валентність цих іонів і валентність металів, можна записати формули солей (FeCl3, Al2(SO4)3 тощо).
Хімічні формули, залежно від форми запису бувають кількох видів:
- Емпіричні – вказують лише якісний і кількісний склад сполук, але не дають уявлення про їх будову (H2SO4, Н2О, С2Н4О2 тощо).
- Графічно-структурні – відображають порядок атомів у сполуках та валентність кожного елемента:
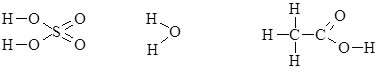
Такі формули часто застосовуються в органічній хімії.
- Електронні – вказують електронну будову атомів і молекул:
![]()
Про валентність з точки зору будови атома див. “Валентність і будова атома”.