2. ОСНОВНІ ПОНЯТТЯ ХІМІЇ
2. ОСНОВНІ ПОНЯТТЯ ХІМІЇ
2.4. Відносна атомна і молекулярна маси. Масова частка елемента
Важливою характеристикою атома, окрім заряду ядра, є його маса. Величини атомних мас надзвичайно малі (наприклад, маса атома Гідрогену становить 1,674∙10-27 кг, Карбону – 1,993∙10-26 кг) і користуватись ними при обрахунках незручно. Тому на практиці використовують значення відносних атомних мас. Для цього масу певного атома порівнюють з масою еталона, яким на сьогодні є 1/12 частка маси ізотопу Карбону 12С (1,674∙10-27 кг) – атомна одиниця маси (а.о.м.) – 1,660∙10-27 г.
Відносна атомна маса – величина, яка показує, у скільки разів маса атома даного елемента більша від атомної одиниці маси.
Відносна атомна маса позначається символом “Ar” (від англ. “Аtom” i “relative” – відносний) і є безрозмірною величиною. Виходячи зі сказаного, можна записати:
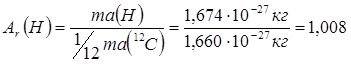
Значення відносних атомних мас кожного хімічного елемента з урахуванням його ізотопного складу наведено у Періодичній системі Д.І. Менделєєва (див. форзац). Зазвичай використовують округлені значення атомних мас, наприклад, Ar(Н) = 1, Ar(О) = 16 тощо.
Для характеристики речовин, що складаються з двох чи більше атомів однакових або різних елементів, використовують поняття “відносна молекулярна маса”. Вона показує, у скільки разів маса молекули даної речовини більша від атомної одиниці маси і позначається символом “Мr”.
Для обчислення відносної молекулярної маси речовини слід знати її якісний та кількісний склад, відомості про який записані у хімічній формулі. Так, запис Н2SO4 означає, що до складу молекули сульфатної кислоти входить два атоми Гідрогену, один атом Сульфуру і чотири атоми Оксигену. Знаючи відносні атомні маси елементів та їх кількість у молекулі, можна обчислити відносну молекулярну масу Н2SO4, яка теж є безрозмірною величиною:
![]()
Знаючи хімічну формулу та відносну молекулярну масу речовини, можна визначити відносну кількість кожного елемента у сполуці – його масову частку. Масова частка елемента може бути виражена у відсотках (%) або частках від одиниці і обчислюється за формулою:
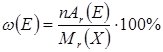 ,
,
де w(Е) – масова частка елемента Е у сполуці Х, n – кількість атомів елемента Е у сполуці Х, Ar(Е) – відносна атомна маса елемента Е, Мr(Х) – відносна молекулярна маса сполуки Х.
Розрахуємо масові частки елементів у молекулі Н2SO4:
- масова частка Гідрогену
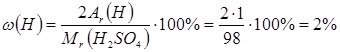 або у частках від одиниці – 0,02;
або у частках від одиниці – 0,02; - масова частка Сульфуру
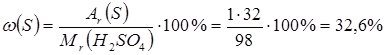 або 0,326;
або 0,326; - масова частка Оксигену
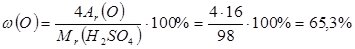 або 0,653.
або 0,653.
Сума масових часток усіх елементів, що входять до складу даної сполуки має бути рівною 100% (у випадку використання значень у відсотках) або 1 (при розрахунках у частках від одиниці).
Якщо сума незначно відрізняється від цих величин, це означає, що використовувались округлені значення масових часток елементів.
У нашому прикладі ![]() (або 0,999 в частках від одиниці), що свідчить про вищеозначене.
(або 0,999 в частках від одиниці), що свідчить про вищеозначене.
Знаючи масові частки елементів у сполуці, можна встановити її молекулярну (брутто) формулу. Нехай деяка сполука містить 40% Са, 12% С та 48% О. Поділимо масову частку кожного елемента у сполуці на його відносну молекулярну масу:
Са: 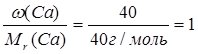 ;
;
С: 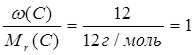 ;
;
О: 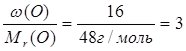 .
.
Одержані цифри вказують молярне співвідношення елементів у сполуці:
nСа : nС : nО = 1 : 1 : 3,
тобто сполука містить 1 атом Са, 1 атом С і 3 атоми О і її брутто-формула СаСО3.