4. БУДОВА АТОМА
4. БУДОВА АТОМА
4.6. Розподіл електронів у багатоелектронних атомах
Послідовність заповнення електронами атомних орбіталей в багатоелектронних атомах базується на:
- Принципі найменшої енергії.
- Правилах Клечковського.
- Принципі Паулі.
- Правилі Гунда.
- Правилі симетрії.
Розглянемо їх докладніше.
Принцип найменшої енергії.
Основною умовою стабільної електронної конфігурації атома є заповнення електронами атомних орбіталей по мірі зростання їх енергії. Тобто, кожен наступний електрон займає вільну атомну орбіталь з найменшою енергією. Послідовність заповнення орбіталей (зростання їх енергії) визначається правилами Клечковського.
Перше правило Клечковського.
Заповнення електронами енергетичних підрівнів відбувається по мірі зростання суми (n + l) – головного і побічного квантових чисел.
Якщо для двох атомних орбіталей значення (n + l) однакові, то згідно з другим правилом Клечковського, першою заповнюється електронами атомна орбіталь з меншим значенням n (головного квантового числа).
Для визначення послідовності заповнення електронами атомних орбіталей, вираховують енергію кожної орбіталі за сумою (n + l) (табл. 4.2 і рис. 4.6).
Таблиця 4.2
Послідовність заповнення електронами орбіталей в багатоелектронному атомі згідно з правилами Клечковського
|
Енергія |
Мінімальна |
Енергії 4f- і 5d-підрівнів близькі |
Енергії 5f- і 6d-підрівнів близькі |
Макси-мальна |
|||||||||||||||
|
Підрівень |
1s |
2s |
2p |
3s |
3p |
4s |
3d |
4p |
5s |
4d |
5p |
6s |
4f |
5d |
6p |
7s |
5f |
6d |
7p |
|
n |
1 |
2 |
2 |
3 |
3 |
4 |
3 |
4 |
5 |
4 |
5 |
6 |
4 |
5 |
6 |
7 |
5 |
6 |
7 |
|
l |
0 |
0 |
1 |
0 |
1 |
0 |
2 |
1 |
0 |
2 |
1 |
0 |
3 |
2 |
1 |
0 |
3 |
2 |
1 |
|
n + l |
1 |
2 |
3 |
3 |
4 |
4 |
5 |
5 |
5 |
6 |
6 |
6 |
7 |
7 |
7 |
7 |
8 |
8 |
8 |
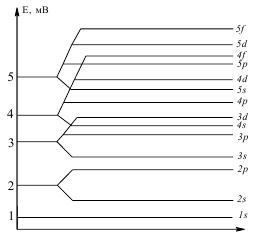
Рис. 4.6. Зміна енергії атомних орбіталей зі зростанням суми (n + l).
Як видно з рис. 4.6, близькі значення енергії мають 4s- і 3d-, 5s- і 4d- та 5p- і 4f-орбіталі (тобто однакову суму (n + l)), але згідно другого правила Клечковського заповнення відбувається в порядку зростання значення n.
Згідно принципу Паулі в атомі не може бути електронів з однаковим значенням всіх чотирьох квантових чисел. Оскільки електрон характеризується лише одним набором (n, l, m, s) квантових чисел, а одній орбіталі відповідає три (n, l, m) квантових числа, то згідно принципу Паулі для конкретної атомної орбіталі можливо стільки станів електрона, скільки значень має четверте квантове число (s – спінове, два значення). Тому на одній атомній орбіталі може одночасно перебувати не більше двох електронів. Графічно це показано на рис. 4.7. Сумарний спін спарених електронів рівний 0 (–½ + ½ = 0), а неспареного – +½.
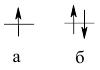
Рис. 4.7. Розміщення неспареного (а) і спарених електронів на орбіталі.
Кількість електронів (N) на даному енергетичному рівні (n), визначається залежністю N = 2n2, де n – головне квантове число.
Звідси випливає, що на першому енергетичному рівні (n = 1) може знаходитись N = 2×12 = 2 електрони на 1s-підрівні, на другому (n = 2) – N = 2×22 = 8 (2 електрони на 2s і 6 – на 2p підрівнях) і т.д. (табл. 4.3).
Таблиця 4.3
Максимальна кількість електронів на електронних рівнях і підрівнях
|
Енергетичний рівень |
Енергетичний підрівень |
Можливі значення магнітного квантового числа m |
Кількість орбіталей |
Максимальна кількість електронів |
||
|
у підрівні |
у рівні |
на підрівні |
на рівні |
|||
|
K (n = 1) |
s (l = 0) |
0 |
1 |
1 |
2 |
2 |
|
L (n = 2) |
s (l = 0) p (l = 1) |
0 –1, 0, +1 |
1 3 |
4 |
2 6 |
8 |
|
M (n = 3) |
s (l = 0) p (l = 1) d (l = 2) |
0 –1, 0, +1 –2, –1, 0, +1, +2 |
1 3 5 |
9 |
2 6 10 |
18 |
|
N (n = 4) |
s (l = 0) p (l = 1) d (l = 2) f (l = 3) |
0 –1, 0, +1 –2, –1, 0, +1, +2 –3, –2, –1, 0, +1, +2, +3 |
1 3 5 7 |
16 |
2 6 10 14 |
32 |
Згідно правила Гунда, найстійкішим станом атома є такий, у якому сумарний спін усіх його електронів максимальний.
Розглянемо це на прикладі атома Нітрогену, який містить 7 електронів. По 2 електрони розмістяться на 1s- i 2s-орбіталях, а ще 3 електрони можуть зайняти 2p-орбіталь у таких варіантах:
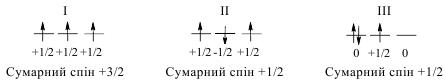
Як бачимо, лише у варіанті І, сумарний спін максимальний (+3/2). Тому така конфігурація є найстійкішою, а стан атома – основний. ІІ і ІІІ стани атома Нітрогену, коли сумарний спін не є максимальним, називають збудженими.
Правило симетрії.
На електронну будову деяких атомів впливає симетрія розподілу електронів по атомних орбіталях електронних підрівнів. Електронна конфігурація повністю і наполовину заповнених електронами підрівнів енергетично вигідніша, тому реалізація таких конфігурації ймовірніша, ніж конфігурацій з незавершеними підрівнями.
Утворення симетричних електронних конфігурацій можливе при переході електрона з одного електронного рівня на інший – явище електронного провалу.
Найчастіше “провалюються” електрони з близьких за енергіями s‑підрівнів наступного на d-підрівні попереднього електронного рівня. Це спостерігається у атомів Хрому, Купруму (з 4s- на 3d-підрівень), Молібдену, Аргентуму та Паладію (з 5s- на 4d-підрівень).
Приклади написання електронно-графічних формул атомів елементів за наведеними правилами представлені у п. “Електронні конфігурації та електронно-графічні формули елементів І – IV періодів”.