5. ПЕРІОДИЧНИЙ ЗАКОН І ПЕРІОДИЧНА СИСТЕМА ХІМІЧНИХ ЕЛЕМЕНТІВ Д.І. МЕНДЕЛЄЄВА
5. ПЕРІОДИЧНИЙ ЗАКОН І ПЕРІОДИЧНА СИСТЕМА ХІМІЧНИХ ЕЛЕМЕНТІВ Д.І. МЕНДЕЛЄЄВА
5.5. Періодичність зміни фізичних та хімічних властивостей елементів
Схожість властивостей атомів елементів зумовлена схожістю їх електронних конфігурацій і розподілом електронів по зовнішніх орбіталях. Це виявляється у періодичному повторенні елементів із схожими властивостями зі зростанням заряду їх ядра. Такі властивості називають періодичними.
Розглянемо періодичність зміни властивостей на прикладі атомів елементів третього періоду (табл. 5.3).
Таблиця 5.3
Деякі властивості атомів елементів третього періоду
|
Символ |
Na |
Mg |
Al |
Si |
P |
S |
Cl |
Ar |
|
Група |
I |
II |
III |
IV |
V |
VI |
VII |
VII |
|
Заряд ядра |
+11 |
+12 |
+13 |
+14 |
+15 |
+16 |
+17 |
+17 |
|
Електронна конфігурація [Ne]… |
3s1 |
3s2 |
3s23p1 |
3s23p2 |
3s23p3 |
3s23p4 |
3s23p5 |
3s23p6 |
|
Радіус атома, м∙10-12 |
171 |
128 |
131 |
107 |
92 |
81 |
70 |
66 |
|
Енергія іонізації, Еі1, еВ |
5,14 |
7,65 |
5,99 |
8,15 |
10,49 |
10,36 |
12,97 |
15,76 |
|
Спорідненість до електрона, Еs1, еВ, |
0,3 |
–0,2 |
0,2 |
1,8 |
0,8 |
2,1 |
3,6 |
–0,4 |
|
Відносна електронегативність |
0,9 |
1,2 |
1,6 |
1,9 |
2,2 |
2,6 |
2,8 |
– |
Атом кожного елемента цього періоду містить три енергетичні рівні. Зі зростанням заряду ядра зростає кількість електронів на зовнішньому електронному рівні, за рахунок чого вони сильніше притягаються до ядра, що веде до зменшення атомного радіуса і відірвати зовнішні електрони стає все важче. Енергія, яку необхідно затратити, щоб відірвати електрон від електронейтрального атома, перетворивши його в позитивно заряджений іон (катіон) називається енергією іонізації (позначається Еі).
З відривом кожного електрона зростає позитивний заряд катіона, і для відриву наступного електрона затрачається все більше енергії, тому значення кожної наступної енергія іонізації більше за попереднє: Еі1< Еі2< Еі3< Еіn.
Порівнявши значення Еі1 атомів елементів третього періоду, бачимо, що вони плавно зростають від Натрію до Алюмінію. Винятком є атоми Магнію зі стійкою конфігурацією 3s2, Фосфору (3р3) і Аргону (3р6). Легкість віддачі електрона є мірою металічності – чим менша Еі, тим ближче атом даного елемента до металів. З табл. 5.3 видно, що найнижчі Еі у атомів з малою кількістю електронів на зовнішньому електронному рівні (від 1 до 3).
Зі зростанням Еі1 послаблюються металічні і посилюються неметалічні властивості.
Мірою неметалічності є спорідненість до електрона. Це – кількість енергії, що виділяється або поглинається при приєднанні одного електрона до нейтрального атома з перетворенням його в негативно заряджений іон – аніон (позначається Еs). Оскільки з приєднанням кожного електрона негативний заряд іона зростає, а позитивний заряд ядра не змінюється, то приєднувати кожен наступний електрон стає все важче, тому кожне наступне значення енергії спорідненості до електрона більше за попереднє: Еs1< Еs2< Еs3< Еsn.
Значення Еs1 для атомів елементів третього періоду наведені у табл. 5.3. Чим більше значення Еs1, тим характерніші для атома даного елемента неметалічні властивості. Причини відхилення від плавної зміни Еs1 у атомів Магнію, Фосфору та Аргону, такі ж як у випадку Еі1.
Ще однією характеристикою металічних (або неметалічних) властивостей є електронегативність – здатність атомів притягати до себе електрони. Позначається гр. літерою χ (хі). Розраховується як півсума значення Еі1 + Еs1: ![]() . Одержують абсолютне значення електронегативності, яким на практиці користуватись незручно. Тому за пропозицією американського вченого Л. Полінга, електронегативність атома літію приймають за одиницю – χLi = 1. Порівнюючи з нею електронегативність атомів інших елементів одержують значення відносних електронегативностей атомів.
. Одержують абсолютне значення електронегативності, яким на практиці користуватись незручно. Тому за пропозицією американського вченого Л. Полінга, електронегативність атома літію приймають за одиницю – χLi = 1. Порівнюючи з нею електронегативність атомів інших елементів одержують значення відносних електронегативностей атомів.
Зміна електронегативностей у атомів елементів в межах групи аналогічні вищеозначеним змінам Еі1 і Еs1 (табл. 5.3).
Зазначені закономірності спостерігаються в атомів елементів усіх періодів, однак у великих періодах зміна більш плавна, за рахунок заповнення електронами d- i f-підрівнів.
В межах групи елементи мають однакову будову зовнішнього електронного рівня і схожі хімічні властивості. Зі зростанням заряду ядра зростає кількість електронних рівнів, що у свою чергу веде до зменшення Еі1, Еs1 та c. Тобто в групі зі зростанням заряду ядра зростають металічні властивості (табл. 5.4).
Таблиця 5.4
Деякі властивості елементів VII B підгрупи
|
Символ |
F |
Cl |
Br |
I |
At |
|
Період |
1 |
2 |
3 |
4 |
5 |
|
Заряд ядра |
+9 |
+17 |
+35 |
+53 |
+85 |
|
Електронна конфігурація зовнішнього рівня |
2s22p5 |
3s23p5 |
4s24p5 |
5s25p5 |
6s26p5 |
|
Радіус атома, м∙10-12 |
64 |
99 |
114 |
133 |
– |
|
Енергія іонізації, Еі1, еВ |
17,42 |
12,97 |
11,84 |
10,45 |
10,49 |
|
Спорідненість до електрона, Еs1, еВ, |
3,45 |
3,60 |
3,37 |
3,08 |
2,80 |
|
Відносна електронегативність |
4,1 |
2,8 |
2,7 |
2,2 |
1,9 |
Проілюструємо сказане схемою 5.1.
Схема 5.1.
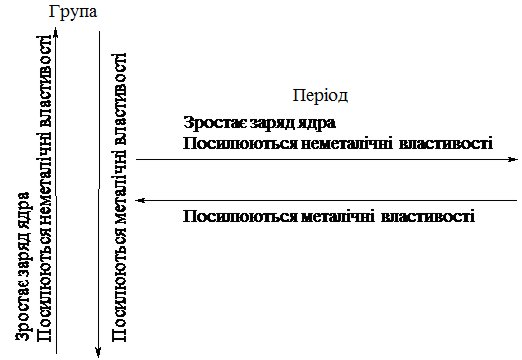
Згідно схеми, найсильніші металічні властивості виявляє Цезій, а неметалічні – Флуор.
З окресленого випливає, що періодичність зміни властивостей елементів обумовлена періодичною зміною кількості електронів на зовнішньому електронному рівні і зростанням заряду ядра атома – це фізичний зміст Періодичного закону.