5. ПЕРІОДИЧНИЙ ЗАКОН І ПЕРІОДИЧНА СИСТЕМА ХІМІЧНИХ ЕЛЕМЕНТІВ Д.І. МЕНДЕЛЄЄВА
5. ПЕРІОДИЧНИЙ ЗАКОН І ПЕРІОДИЧНА СИСТЕМА ХІМІЧНИХ ЕЛЕМЕНТІВ Д.І. МЕНДЕЛЄЄВА
5.6. Зв’язок електронної будови атома з положенням у Періодичній системі
Знаючи положення елемента у Періодичній системі можна визначити його електронну будову і навпаки – за електронною структурою визначити його положення у Періодичній системі.
Для цього використовують такі закономірності:
- Кількість електронних рівнів атомів одного періоду в основному (незбудженому) стані рівна номеру періоду.
- У головних (А) підгрупах кількість електронів на зовнішньому електронному рівні рівна номеру групи (крім Гелію).
- В елементів побічних (В) підгруп ІІІ – VІІ груп сума s-електронів останнього та d-електронів передостаннього електронного рівня рівна номеру групи.
- В елементів побічних (В) підгруп І і ІІ груп внаслідок “електронного провалу” d-підрівень завершений, а кількість електронів на s-підрівні наступного електронного рівня рівна номеру групи.
- В елементів головних (А) підгруп електронами заповнюється рівень, номер якого рівний номеру періоду.
- В елементів побічних (В) підгруп електронами заповнюється рівень, номер якого на одиницю менший від номера періоду.
- Максимальна кількість електронів в атомі елемента 1 періоду – 2, 2 – 8, 3 – 8, 4 – 18, 5 – 18, 6 – 32, 7 – 32. Відповідну кількість елементів містить кожен період.
Проілюструємо сказане прикладами.
Приклад 1. Елемент з електронною конфігурацією останнього електронного рівня 3s23p5 міститься у ІІІ періоді (електронами заповнюється 3 енергетичний рівень), VII групі (сума електронів останнього електронного рівня рівна 7). Це – р-елемент головної (А) підгрупи (електронами заповнюється р-підрівень), неметал (велика кількість валентних електронів – 5). Повна електронна структура атома: 1s22s23s23p5. Заряд ядра рівний сумі електронів – +17 і є порядковим номером елемента у Періодичній системі.
Приклад 2. Елемент з порядковим номером 25 має заряд ядра +25 і містить 25 електронів. Запишемо його електронну конфігурацію, використовуючи правила Клечковського:
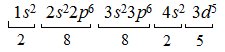
Це – елемент VII групи (сума s-електронів передостаннього і d-електронів останнього рівня дорівнює 7), d-елемент побічної (В) підгрупи (електронами заповнюється d-підрівень), 3 періоду (валентні електрони містяться на 3 електронному рівні). Метал (на зовнішньому (4s) електронному рівні міститься мало електронів – 2).
Як бачимо, існує тісний зв’язок між електронною структурою атомів елементів та їх положенням у Періодичній системі елементів, що ще раз підтверджує об’єктивні зв’язки, які існують у природі.