6. ХІМІЧНИЙ ЗВ’ЯЗОК
6. ХІМІЧНИЙ ЗВ’ЯЗОК
6.1. Ковалентний зв’язок
Найпростішим прикладом виникнення хімічного зв’язку є утворення молекули водню з атомів Гідрогену.
Неполярний ковалентний зв’язок.
Навколо ядра кожного атома Гідрогену по сферичні орбіталі обертається один електрон (1s1). Електронний рівень незавершений, атому не вистачає одного електрона, щоб набути завершеної конфігурації дублету (як у атома Гелію – 1s2). При зближення двох атомів Гідрогену відбувається часткове перекривання орбіталей. Між центрами обох ядер, виникає область підвищеної електронної густини, у якій взаємодіють електрони з протилежними спінами з утворенням спільної електронної пари (рис. 6.1):
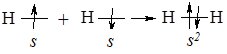
Рис. 6.1. Схема перекривання s-орбіталей атома Гідрогену при утворенні молекули Н2.
Якщо електрон позначити крапкою, а електронну пару – двокрапкою, то схема набуде вигляду:
Н· + ·Н = Н![]() Н
Н
Іноді спільну електронну пару позначають рискою, наприклад Н—Н. Спільну електронну пару називають поділеною.
Відстань між атомами Гідрогену в молекулі менша, ніж сума атомних радіусів окремих атомів (див. Довжина зв’язку).
У результаті утворення хімічного зв’язку виділяється енергія, а кожен атом Гідрогену набуває завершеної електронної конфігурації – 1s2.
Іншим прикладом є утворення ковалентного зв’язку в молекулі фтору F2. На зовнішньому електронному рівні у Флуору міститься 7 електронів (+9F 1s22s22р5), з яких неспареним є один електрон 2р-підрівня:
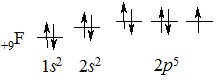
При зближенні атомів Флуору перекриваються р-орбіталі з неспареним електроном, утворюючи спільну електронну пару, а кожен атом Флуору набуває стійкої завершеної електронної конфігурації, як у Неону 1s22s22р6 (октету) утворивши спільну електронну пару:
![]()
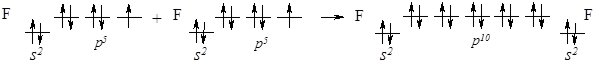
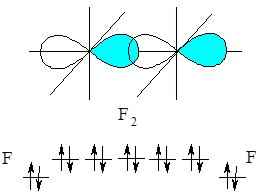
Рис. 6.2. Перекривання р-орбіталей атома Флуору з утворенням s-зв’язку.
Електронні пари, які не брали участі в утворенні хімічного зв’язку, називають неподіленими.
Іноді між атомами утворюється два (подвійний) або три (потрійний) хімічних зв’язки. Такі зв’язки називають кратними. Розглянемо кратні зв’язки на прикладі утворення молекули азоту N2 з атомів Нітрогену.
Електронна конфігурація атома Нітрогену:
+17N [Не] 2s22р3
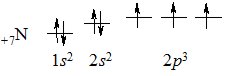
В утворенні зв’язків беруть участь усі неспарені електрони обох атомів Нітрогену:
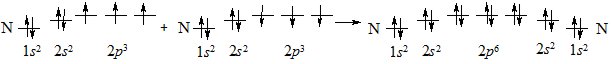
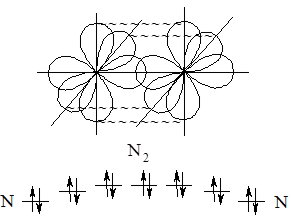
Рис. 6.3. Утворення потрійного зв’язку в молекулі азоту при перекриванні р-орбіталей та просторове розташування утворених зв’язків.
Очевидно, що кратні зв’язки будуть міцнішими, ніж одинарні, причому чим більша кратність, тим міцніший зв’язок.
Ковалентним називають зв’язок, утворений однією або кількома спільним електронними парами.
Якщо зв’язок лежить на лінії, що з’єднує ядра атомів, то він називається s (сігма)-зв’язком. Одинарний зв’язок (утворений однією спільною парою електронів) завжди є s-зв’язком.
У молекулі азоту лише один з трьох зв’язків лежить на цій лінії, а інші розташовані по обидва боки від лінії, що сполучає ядра атомів. Такі зв’язки називають p (пі)-зв’язками.
При виникненні ковалентного зв’язку між атомами з однаковою електронегативністю, спільна електронна пара у просторі симетрично розташовується відносно ядер атомів, що утворили цей зв’язок. Такий ковалентний зв’язок називають неполярним.
Полярний ковалентний зв’язок.
Якщо ж ковалентний зв’язок виникає між атомами елементів з різним значенням електронегативностей, електронна пара у просторі розташовується несиметрично, а зв’язок називають ковалентний полярний.
Розглянемо механізм виникнення ковалентного полярного зв’язку на прикладі утворення молекули гідроген фториду HF.
При взаємодії атома Гідрогену, який має неспарений електрон на s‑орбіталі з атомом Флуору, який має з неспарений р-електрон, при утворенні хімічного зв’язку перекриваються ці орбіталі:
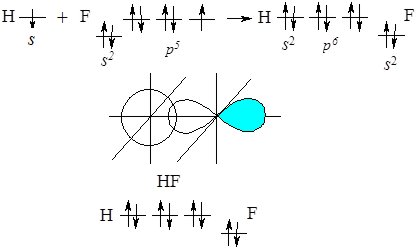
Рис. 6.4. Перекривання орбіталей атома Гідрогену та Флуору.
![]()
На схемі стрілкою показано напрям зміщення спільної електронної пари до більш електронегативного атома Флуору. За рахунок цього на ньому виникає надлишковий негативний заряд, а на атомі Гідрогену – позитивний.
Такий механізм утворення ковалентного зв’язку іноді називають обмінним.
Донорно-акцепторний механізм виникнення ковалентного зв’язку.
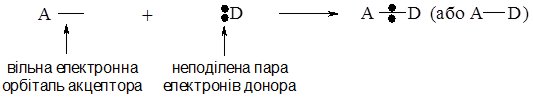
Ковалентний зв’язок за донорно-акцепторним механізмом виникає між атомами, один з яких містить неподілену пару електронів, а інший – незайняту (вакантну) орбіталь. Атом, який надає для утворення зв’язку неподілену пару електронів називається донором електронної пари, а який надає орбіталь (тобто приймає цю електронну пару) – акцептором електронної пари.
Схематично це можна зобразити так (А – акцептор, D – донор):
Простим прикладом донорно-акцепторної взаємодії є утворення іона амонію NH4+. Як відомо, такий іон утворюється при взаємодії аміаку NH3 з кислотами за схемою:
NH3 + Н+ = NH4+
У молекулі NH3 атом Нітрогену має неподілену електронну пару, а іон Гідрогену Н+, який входить до складу кислот – вільну електронну орбіталь (див. схему утворення НF). Завдяки цьому молекула NH3 виступає донором електронної пари, а іон H+ – її акцептором. При утворенні зв’язку, неподілена електронна пара стає спільною для атомів Нітрогену та Гідрогену, при цьому утворюється іон амонію NH4+:
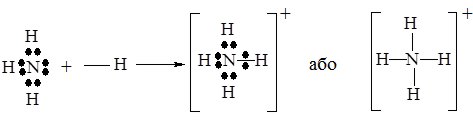
В утвореному катіоні NH4+ всі зв’язки N–H ідентичні.
Як бачимо, валентність атома Нітрогену рівна 4, що більше, ніж кількість неспарених електронів. Тому у випадках, коли елемент утворює ковалентні зв’язки за донорно-акцепторним механізмом, його валентність визначається загальною кількістю орбіталей на зовнішньому електронному рівні У атома Нітрогену їх чотири – одна 2s- і три 2р-орбіталі.
Іншими прикладами виникнення ковалентного зв’язку за розглянутим механізмом є утворення іонів гідроксонію Н3О+, BF4- та комплексних сполук.
За звичайних умов ковалентні сполуки можуть бути твердими речовинами (молекулярний йод І2, глюкоза С6Н12О6), рідинами (вода Н2О, молекулярний бром Br2), газами (F2, HCl, NH3, CH3Cl). У них низькі (порівняно зі сполуками з іонним та металічним типами зв’язку) температури плавлення та кипіння.
Речовини з ковалентним неполярним зв’язком розчиняються в неполярних розчинниках (бром Br2 розчиняється в тетрахлорметані CCl4, бензені С6Н6), а з полярним – у полярних (хлороводень HCl, етанол С2H5OH – у воді Н2О) (див. Розчини).