6. ХІМІЧНИЙ ЗВ’ЯЗОК
6. ХІМІЧНИЙ ЗВ’ЯЗОК
6.2. Основні характеристики ковалентного зв’язку
Найважливішими характеристиками ковалентного зв’язку є кратність, довжина та енергія (табл. 6.1).
Кратність зв’язку описана при розгляді утворення молекули азоту N2.
Довжина зв’язку – найкоротша відстань між ядрами атомів, які утворюють ковалентний зв’язок. Чим менша довжина зв’язку, тим він міцніший.
Кратні зв’язки завжди коротші від одинарних, тому міцніші. Чим вища кратність тим більша міцність.
Енергія зв’язку – кількість енергії, яка необхідна для його розриву, або яка виділяється при його утворенні.
Енергія характеризує міцність зв’язку і вимірюється в кДж/моль.
Таблиця 6.1.
Кратність, довжина та енергія зв’язків у деяких молекулах
|
Молекула |
Атоми, між якими виникає зв’язок |
Довжина, м∙10-12 |
Енергія, кДж/моль |
|
N2 |
NºN |
109 |
949 |
|
CO |
C=O |
113 |
941 |
|
HF |
H–F |
91 |
559 |
|
H2 |
H–H |
74 |
443 |
|
CO2 |
O=C=O |
131 |
347 |
|
Br2 |
Br–Br |
228 |
190 |
Іншими характеристиками ковалентного зв’язку є полярність, спрямованість у просторі та насиченість.
Насиченість зв’язку – здатність атомів утворювати певну кількість хімічних зв’язків. Завдяки цьому молекули мають чіткий склад і структуру.
Полярність зв’язку – асиметричний розподіл електронної хмари між ядрами атомів по осі зв’язку. Зміщення електронної хмари до більш електронегативного атома називається поляризацією, а зв’язок полярним (див. Ковалентний полярний зв’язок, схема утворення молекули HF). Електронна хмара зміщується тим сильніше, чим більша різниця електронегативностей атомів, між якими утворений хімічний зв’язок.
Коли різниця електронегативностей перевищує 1,8, то ковалентний зв’язок переходить в іонний.
Спрямованість ковалентного зв’язку обумовлює просторову структуру молекул і визначається валентним кутом (кут між лініями зв’язку атомів у молекулі).
Очевидно, двоатомні молекули матимуть лінійну форму (Н2, HF, N2).
Утворення валентного кута розглянемо на прикладі молекули H2S.
Утворення молекули H2S з атомів Гідрогену та Сульфуру схематично зображається так:
+1H 1s1 +1H 1s1
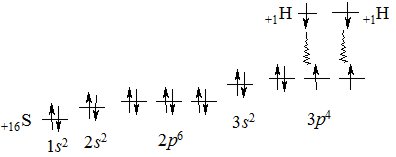
+16S 1s22s22р63s23р4
Ковалентні зв’язки атом Сульфуру утворює з рахунок неспарених електронів двох 3р-орбіталей, які у просторі розташовані під кутом 90 0 (див. Квантові числа). Саме ці орбіталі взаємодіють з орбіталями атомів Гідрогену і при перекриванні утворюють два ковалентні полярні s-зв’язки, розташовані під кутом один відносно одного (рис. 6.5).
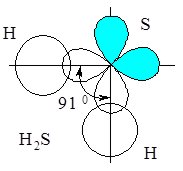
Рис. 6.5. Схема просторового розміщення орбіталей у молекулі Н2S.
Цей кут мав би дорівнювати куту між р-орбіталями (90 0), однак насправді він трохи більший (~ 91 0), за рахунок відштовхування позитивно заряджених атомів Гідрогену.
Розглядаючи аналогічні сполуки Гідрогену з іншими елементами VIA підгрупи, слід відмітити, що валентний кут зростає із зменшенням радіуса центрального атома і відповідним зменшенням довжини зв’язку (табл. 6.2).
Таблиця 6.2.
Залежність валентного кута від радіуса центрального атома у гідридів елементів VIA підгрупи
|
Центральний атом |
Сполука |
Радіус центрального атома, м∙10-12 |
Валентний кут, 0 |
|
O |
H2O |
66 |
104,5 |
|
S |
H2S |
104 |
92 |
|
Se |
H2Se |
117 |
91 |
|
Te |
H2Te |
137 |
90 |
|
Po |
H2Po |
159 |
90 |
Нижче докладніше описана геометрія молекул.