6. ХІМІЧНИЙ ЗВ’ЯЗОК
6. ХІМІЧНИЙ ЗВ’ЯЗОК
6.4. Іонний зв’язок
Як зазначалось при розгляді полярності зв’язку якщо різниця електронегативностей атомів, між якими виникає хімічний зв’язок, перевищує 1,8, ковалентний зв’язок набуває граничної поляризації і стає іонним.
При утворенні іонного зв’язку електрон від менш електронегативного атома повністю зміщується до більш електронегативного. Внаслідок цього перший атом стає позитивно зарядженим (катіон), а другий – негативно (аніон).
Розглянемо механізм утворення іонного зв’язку на прикладі молекули цезій фториду CsF (електронегативність атома Цезію 0,93, атома Флуору – 4, різниця Δχ = 3,07).
У атома Цезію конфігурація останнього електронного рівня 6s1. Для набуття стійкої електронної конфігурації благородного газу 6 періоду – Радону – 6s26p6 – йому не вистачає 7 електронів, а для електронної конфігурації благородного газу попереднього періоду – Ксенону – 5s25p6 – один електрон зайвий.
Атом Флуору містить один неспарений електрон на зовнішньому електронному рівні (2р5), але для завершення йому необхідний ще один (у Неону – 2р6).
Очевидно, що у випадку атома Цезію для завершення електронної структури легше віддати один електрон, ніж прийняти 7, а у випадку атома Флуору – легше один прийняти. Це і має місце при утворенні зв’язку в молекулі CsF.
Схематично цей процес виглядає так:
Cs – ![]() = Cs+
= Cs+
F + ![]() = F–
= F–
Cs + F = Cs+ + F– або 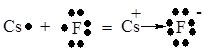
Утворені заряджені частинки (аніон і катіон) називають іонами, а хімічний зв’язок утворений внаслідок електростатичної взаємодії іонів – іонним зв’язком. Напрям зміщення електронної пари вказують стрілкою.
Принципової різниці між ковалентним неполярним, ковалентним полярним та іонним зв’язком немає. Вони відрізняються лише ступенем поляризації (зміщення) спільних електронних пар (рис. 6.11).
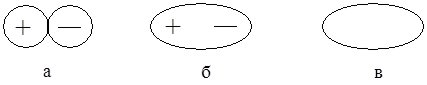
Рис. 6.11. Схематичне зображення молекул з іонним (а), ковалентним полярним (б) та ковалентним неполярним зв’язком.
На відміну від ковалентного зв’язку, іонний характеризується неспрямованістю в просторі і ненасичуваністю. Неспрямованість виявляється в тому, що кожен іон може взаємодіяти з протилежно зарядженим іоном в будь-якому напрямку. Взаємодія з одним протилежно зарядженим іоном не унеможливлює взаємодію з іншими такими ж іонами в інших напрямках. Це – ненасичуваність.
Так, у кристалі Натрій хлориду NaCl, кожен катіон Натрію Na+ оточений шістьма аніонами Хлору Cl– і навпаки (рис. 6.12).
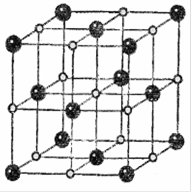
Рис. 6.12. Кристал натрій хлориду.
Іонний тип зв’язку реалізується при утворенні більшості солей, оксидів металів та гідроксидів металів і неметалів.
Іонні сполуки існують у вигляді кристалів, твердих за нормальних умов, а формули типу CsF, Na2O, Ca(OH)2 тощо відображають співвідношення іонів у кристалі.
Іонні сполуки мають високі (порівняно з ковалентними) температури плавлення та кипіння, добре розчинні у воді та інших полярних розчинниках, погано розчинні у бензолі, тетрахлорметані, ацетоні та інших неполярних розчинниках.
У твердому стані іонні сполуки не проводять електричний струм.