6. ХІМІЧНИЙ ЗВ’ЯЗОК
6. ХІМІЧНИЙ ЗВ’ЯЗОК
6.6. Водневий зв’язок
Ще у ХІХ столітті було помічено, що сполуки, в яких атом Гідрогену Н безпосередньо сполучається з атомами Флуору F, Оксигену O або Нітрогену N, мають певні аномальні властивості, зокрема температури плавлення та кипіння.
Зазвичай, у ряду однотипних сполук даної підгрупи, температури плавлення та кипіння зростають при зростанні молекулярної маси. Це пояснюється збільшенням взаємного притягання молекул зі зростанням розмірів атомів, та посиленням дисперсійної взаємодії між ними (табл. 6.4).
Таблиця 6.4
Зміна температури плавлення гідридів деяких елементів VIIA підгрупи
|
Гідрид |
HCl |
HBr |
HI |
|
Температура плавлення, 0С |
– 142,2 |
– 86,9 |
– 50,8 |
Аналогічна залежність спостерігається у ряду H2S – H2Se – H2Te.
Відхилення від сказаного спостерігаються у HF та Н2О, які киплять та плавляться при аномально високих температурах (рис. 6.14).
Як видно з рис. 6.14, зі зростанням молекулярної маси гідридів елементів однієї групи, очікуваний хід кривих спостерігається лише для елементів IVA підгрупи. У гідридів елементів VА, VIА і VIIА підгруп аномально високі температури кипіння спостерігаються у NH3, H2O та HF відповідно, що пояснюється утворенням водневих зв’язків.
Водневий зв’язок виникає внаслідок електростатичної взаємодії між атомом Гідрогену, що має частково позитивний заряд, та атомами з неподіленими парами електронів. Ці атоми зміщують на себе електронну густину, створюючи частковий позитивний заряд d+ на атомах Гідрогену: Нd+ ®Fd–. Диполі кількох полярних молекул взаємодіють між собою з утворенням водневих зв’язків (позначені трьома крапками):
![]()
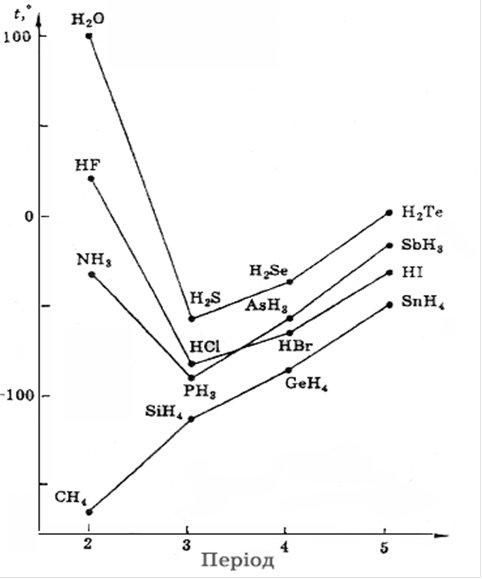
Рис. 6.14. Зміна температур кипіння та плавлення гідридів різних елементів
Зв’язок у молекулі гідроген фториду HF сильно полярний і можна вважати, що у атома Гідрогену електронна орбіталь вільна (утворюється іон Н+) на яку і попадає неподілена пара електронегативного елемента:
![]()
(для порівняння див. Донорно-акцепторний механізм виникнення ковалентного зв’язку).
Завдяки утворенню водневих зв’язків молекули об’єднуються в асоціати. Так, HF існує у вигляді асоціатів (HF)n, де n = 2 ¸ 6.
Водневі зв’язки сильно змінюють фізичні властивості. Вода за їх відсутності мала б кипіти при – 66 0С.
Водневі зв’язки можуть виникати між однаковими або різними молекулами неорганічних (HF, H2O, NH3) та органічних (спиртів, кислот та їх водних розчинів) речовин:
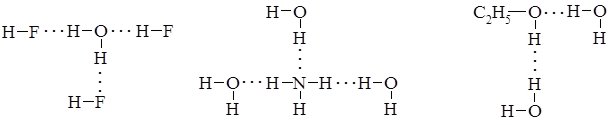
Крім розглянутих прикладів міжмолекулярних, існують внутрішньомолекулярні водневі зв’язки. Найчастіше такі зв’язки виникають у молекулах органічних сполук, наприклад саліцилової (о-оксибензойної) кислоти, о-нітрофенолу:

Зазначимо, що у випадку пара- або мета-заміщених бензолу виникнення внутрішньомолекулярних водневих зв’язків неможливе, оскільки групи, які беруть участь у їх утворенні надто віддалені у просторі.
Водневі зв’язки довші і тому слабкіші від ковалентних (20 кДж/моль у льоду, що становить лише 4,3% енергії ковалентного зв’язку Н–О, а довжина його 1,8∙10-12 м, вдвічі більша від Н–О).
Утворення водневих зв’язків відіграє важливу роль у процесах, які відбуваються при звичайній температурі. Вони підтримують вторинну структуру білків, нуклеїнових кислот. Завдяки водневим зв’язкам лід (кристалічна вода) легший за рідку воду, через що утворюється на поверхні і захищає рідину від втрати тепла.