9. ОКИСНО-ВІДНОВНІ РЕАКЦІЇ (ОВР)
9. ОКИСНО-ВІДНОВНІ РЕАКЦІЇ (ОВР)
9.8. Вплив середовища на напрям проходження ОВР
рН середовища (концентрація катіонів гідроксонію Н3О+) впливає на глибину зміни ступенів окиснення атомів.
Так, перманганат-іон MnO4– залежно від рН середовища може відновлюватись згідно схем:
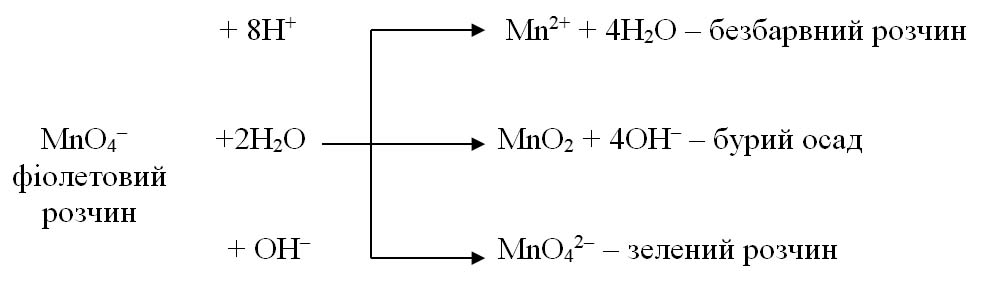
Кисле середовище створюють за допомогою розведеної сульфатної кислоти H2SO4, оскільки нітратна HNO3 є окисником, а хлоридна HCl – відновником.
Лужне середовище створюють за допомогою розчинів гідроксидів лужних і лужно-земельних металів NaOH, KOH, Ca(OH)2 тощо.
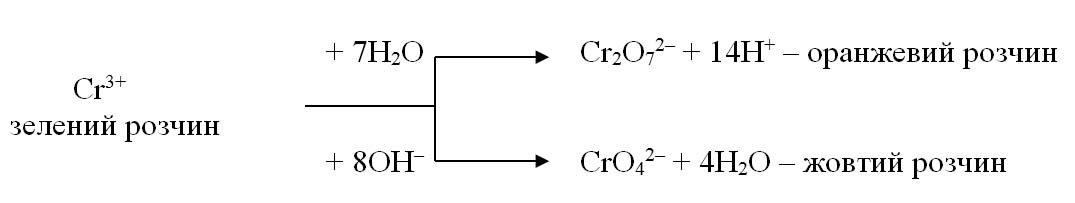
Іншим прикладом впливу середовища на продукти ОВР є окиснення іона Сr3+:
Кількісно вплив рН середовища на проходження процесу за участю іонів H+ при стандартних умовах за схемою aOx + nе + mH+ ↔ bRed, описується рівнянням Нернста-Петерса:
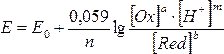
Для прикладу розрахуємо, чи відбудеться процес, який описується напівреакцією MnO4– + 8H+ + 5е = Mn2++ 4Н2О при рН = 4.
У довіднику знаходимо значення Е0(MnO4–/Mn2+) = 1,52 В. Окиснена форма – іон MnO4–, відновлена – Mn2+. Концентрацію іонів Н+ обчислимо з рівняння [H+] = 10–рН = 10–4 моль/л. Рівноважні концентрації окисненої та відновленої форм однакові. Підставимо одержані значення у рівняння Нернста-Петерса:
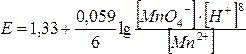 , E = 1,015.
, E = 1,015.
Отже, при даному значенні рН цей процес відбувається.
Аналогічні розрахунки можна проводити для процесів, що відбуваються за участю гідроксид-іонів ОН–, при цьому слід враховувати співвідношення рН + рОН = 14 ([Н+][ОН–] = 10–14).