10. ОСНОВИ ЕЛЕКТРОХІМІЇ
10. ОСНОВИ ЕЛЕКТРОХІМІЇ
10.1. Хімічні джерела електричного струму
Як відомо, електродні потенціали усіх редокс-систем відрізняються між собою. Ця різниця дозволяє використовувати редокс-системи для створення джерел електричного струму, у яких енергія хімічних реакцій перетворюється в електричну.
Пристрій, у якому енергія редокс-реакцій перетворюється в електричну називають гальванічним елементом (ГЕ).
Найпростішим ГЕ є елемент Даніеля-Якобі, в основі роботи якого лежить ОВР:
Zn + CuSO4 = Cu + ZnSO4
Zn0 + Cu2+ = Cu0 + Zn2+
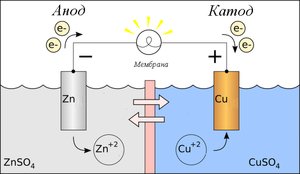
Рис. 10.1. Схема ГЕ Даніеля-Якобі.
Цей ГЕ складається з мідного і цинкового електродів, занурених у розчини відповідних сульфатів (CuSO4 та ZnSO4) і з’єднаних сольовим містком (скляна трубка, заповнена розчином калій хлориду KCl), який є “провідником” іонів і не допускає змішування розчинів солей (рис. 10.1).
Розглянемо механізм роботи ГЕ Даніеля-Якобі. Раніше зазначалось, що при зануренні металу у розчин його солі, відбувається окиснення металу або відновлення його катіонів з розчину солі, що зумовлює виникнення електрохімічного потенціалу. Це стосується і даного випадку.
На цинковому електроді відбувається процес Zn0 – 2е = Zn2+,. який зумовлює виникнення негативного заряду на електроді за рахунок адсорбції аніонів.
На мідному електроді проходить реакція Cu2+ + 2е = Cu0, відбувається адсорбція катіонів, за рахунок чого електрод набуває позитивного заряду.
Якщо цинковий електрод з’єднати з мідним за допомогою зовнішнього провідника, то надлишок електронів з цинкового електрода по провіднику перейде на мідний. На мідному електроді надлишок електронів буде спонукати дальше проходження реакції Cu2+ + 2е = Cu0. Сульфат-іони SO42–, які вивільняються при цьому, по сольовому містку перейдуть до цинкового електрода, де сполучаючись з катіонами Zn2+ утворять ZnSO4.
Поряд з цим, катіони Zn2+ перейдуть тим же шляхом у розчин СuSO4, де заміщатимуть іони Cu2+ за схемою Zn2+ + СuSO4 = Cu2+ + ZnSO4. З часом весь розчин СuSO4 перетвориться у розчин ZnSO4. ГЕ буде працювати, поки весь цинк не перейде в розчин (у вигляді іонів Zn2+).
Вважається, що струм проходить від точки з вищим потенціалом (умовно позначається “+”) до точки з нижчим (умовно позначається “–”). Позитивного заряду набуває мідний електрод, тому знак “+” одержує він (анод), а цинковий – негативного, тому йому приписують знак “‑”(катод).
Кількісною характеристикою ГЕ є його електрорушійна сила (ЕРС), тобто максимальна різниця потенціалів на аноді та катоді. Для випадку ГЕ Даніеля-Якобі знаходимо значення потенціалів систем Сu2+/Cu (+ 0,338 В) та Zn2+/Zn (– 0,763 В). Маємо:
ЕРС = ![]() = + 0,338 В – (– 0,763) В = 1,101 В.
= + 0,338 В – (– 0,763) В = 1,101 В.
Одним з видів ГЕ є паливний елемент. У ньому електричний струм утворюється за рахунок окиснення палива (молекулярного водню Н2). Окисник (кисень повітря О2) і відновник (паливо) подаються у систему ззовні. При роботі паливного елемента відбуваються процеси:
Н2 – 2е = 2Н+,
О2 + 2Н2О + 4е = 4ОН–,
сумарно 2Н2 + О2 + 2Н2О = 4ОН– + 4Н+ або 2Н2 + О2 = 2Н2О,
тобто фактично зводяться до горіння Н2.
Робота розглянутих ГЕ не є постійною і припиняється у випадку закінчення одного з учасників редокс-процесу. Практичне значення мають джерела постійного електричного струму.
Як джерела постійного електричного струму ефективні і зручні в роботі акумулятори – ГЕ багаторазового використання.
Розглянемо для прикладу роботу кислотного свинцевого акумулятора. Він побудований із занурених у розчин сульфатної кислоти H2SO4 електродів – чисто свинцевого і аналогічного, вкритого шаром плюмбум (IV) оксиду PbO2. При роботі акумулятора на електроді без покриття відбувається реакція:
Pb + SO42– – 2е = PbSO4,
на іншому електроді іде процес:
PbO2 + 4H+ + + SO42– + 2е = PbSO4 + 2H2O.
Сумарно: Pb + PbO2 + 2H2SO4 = 2PbSO4 + 2H2O.
Коли весь Pb і PbO2 перетворюються у PbSO4, акумулятор “сідає”. Зарядити його можна пропускаючи через акумулятор постійний електричний струм. При цьому відбуваються реакції:
|
PbSO4 + 2е = Pb2+ + SO42– 2PbSO4 + 2H2O – 2е = PbO2 + 4H+ + SO42– |
|
2PbSO4 + 2H2O = Pb + PbO2 + 2H2SO4 |