10. ОСНОВИ ЕЛЕКТРОХІМІЇ
10. ОСНОВИ ЕЛЕКТРОХІМІЇ
10.5. Закони електролізу
Кількісні закономірності електролізу встановив англійський вчений М. Фарадей у 30-х рр. ХІХ ст. На основі власних досліджень він сформулював закони:
1. Маса речовини, утвореної при електролізі, прямо пропорційна кількості електрики, що пройшла через систему:
m = kQ
де m – маса речовини, k – електрохімічний еквівалент, що визначає масу речовини, утвореної при проходженні струму силою 1А протягом 1 с, Q – кількість електрики (Q= It, І – сила струму, t – час електролізу).
2. Однакові кількості електрики виділяють з різних сполук однакові кількості продуктів електролізу (табл. 10.3).
Таблиця 10.3
Результати електролізу деяких сполук
|
Сполука |
Електродний процес |
Кількість електронів, n |
Молярна маса, М |
Молярна маса еквівалента, |
|
AgNO3 |
Ag+ + e = Ag |
1 |
107,9 |
107,9 |
|
CuSO4 |
Cu2+ + 2e = Cu |
2 |
63,54 |
31,77 |
|
TiCl3 |
Ti3+ + 3e = Ti |
3 |
204,4 |
68,1 |
|
SnCl4 |
Sn4+ + 4e = Sn |
4 |
118,7 |
29,7 |
Кількість моль еквівалентів сполук усіх сполук становить 1 моль.
Експериментально встановлено, що для виділення 1 моль еквівалента речовини необхідно 96485 Кл електрики (число Фарадея, F).
Тоді 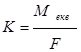 або
або ![]() , де n – кількість електронів.
, де n – кількість електронів.
У загальному випадку маємо: 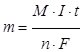 .
.
Для обчислення об’єму газоподібних речовин використовують аналогічну формулу, замінивши М на Vm (молярний об’єм, 22,4 л/моль):