17. ЕЛЕМЕНТИ VIА ГРУПИ. ЗАГАЛЬНА ХАРАКТЕРИСТИКА ХАЛЬКОГЕНІВ
17. ЕЛЕМЕНТИ VIА ГРУПИ. ЗАГАЛЬНА ХАРАКТЕРИСТИКА ХАЛЬКОГЕНІВ
17.1. Оксиген. Кисень. Озон
Оксиген – типовий елемент VIА підгрупи ІІ періоду. На зовнішньому електронному рівні міститься 6 електронів (2s22p4). Висока спорідненість до електрона і неможливість переходу у збуджений стан зумовлює високу хімічну активність кисню, як неметалу. За електронегативністю Оксиген поступається лише Флуору (3,5 і 4,0 відповідно).
Будова зовнішнього електронного рівня атома Оксигену:
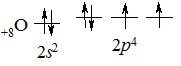
Найпоширеніші ступені окиснення Оксигену –2, –1, 0. За рахунок двох неспарених електронів, Оксиген найчастіше виявляє ступінь окиснення –2 і лише у сполуках з Флуором +2 (оксиген фторид ОF2). Існують сполуки, у яких Оксиген виявляє ступінь окиснення –1 (пероксиди H2O2, Na2O2, BaO2). У пероксидах існує зв’язок між атомами Оксигену О–О. Гідроген пероксид – кислота, пероксиди – солі.
Проста речовина Оксигену – кисень – двоатомна молекула О2, у якій атоми зв’язані ковалентним неполярним зв’язком.
Оксиген вперше добув Дж. Прістлі (Англія) у XVIII ст. термічним розкладом HgO. Назву Оксиген (гр. oxy genes – кислоти утворює) запропонував А. Лавуазьє.
Природні сполуки Оксигену.
Оксиген – найпоширеніший елемент на Землі, масова частка – 47,2%, атомна – 58%. Основна маса Оксигену міститься в повітрі (табл. 17.1).
Вода містить 89% Оксигену. Він також входить до складу оксидів, багатьох солей, рослинних і тваринних організмів.
Одержання кисню у лабораторії.
1. Термічний розклад сполук з високим вмістом Оксигену (KMnO4, KClO3, NaNO3, HgO):
2KMnO4 = O2 + K2MnO4 + MnO2, 2KClO3![]() 2KCl + 3O2,
2KCl + 3O2,
2NaNO3 = 2NaNO2 + O2, 2HgO = 2Hg + O2.
2. З пероксидів:
BaO2 + CO2 = BaCO3 + O2, Na2O2 + H2O = 2NaOH + O2.
3. Електролізом води, підкисленої сульфатною кислотою для збільшення електропровідності:
2H2O ![]() 2Н2 + О2.
2Н2 + О2.
Вперше електроліз води провели У. Ніколсон та Е. Карслайл (Англія) у XIX ст.
Одержання кисню у промисловості.
У промисловості кисень одержують електролізом води та багатоступеневою перегонкою рідкого повітря. Останній спосіб базується на різниці температур кипіння його компонентів.
В природі кисень утворюється шляхом фотосинтезу у зелених рослинах за схемою:
6СО2 + 6Н2О ![]() С6Н12О6 + 6О2.
С6Н12О6 + 6О2.
Фізичні властивості.
За н.у. кисень – безбарвний газ, без запаху і смаку, погано розчинний у воді (масова частка О2 0,004%). Температура плавлення –219,0 0С, температура кипіння –183,0 0С. Рідкий кисень блакитного кольору. Рідкий кисень вперше добув Дж. Дьюар у 90-х рр. XIX ст., і зберігав його у спеціальній посудині з подвійними посрібленими стінками, між якими було викачане повітря – посудині Дюара. Сучасний побутовий термос – це посудина Дьюара з пробкою.
Хімічні властивості.
Кисень – сильний окисник, сильніший від нього лише фтор. Безпосередньо кисень реагує з:
І. Простими речовинами.
Реакція взаємодії кисню з речовинами, що супроводжується значним виділенням тепла і світла називається горінням. Механізм процесу горіння встановив А. Лавуаз’є (Франція, 1774).
1. Неметалами (крім галогенів) з утворенням ангідридів відповідних кислот:
S + O2 = SO2, 4P + 5O2 = 2P2O5,
або індиферентних оксидів:
2С + O2 = 2СO.
2. Металами (крім золота та платинових металів) з утворенням оксидів:
5O2 + 2Ca = 2CaO, 3O2 + 2Al = 2Al2O3, 3O2 +2Fe = Fe2O3.
З лужних металів з киснем лише літій утворює оксид:
O2 + 4Li = 2Li2O,
а решта – пероксиди (Na2O2) або надпероксиди (супероксиди) (КО2):
О2 + 2Na = Na2O2, О2 + К = КО2.
Оксиди галогенів, золота, благородних металів одержують непрямим шляхом.
ІІ. Складними речовинами.
1. Оксидами елементів у нижчих ступенях окиснення:
2CО + О2 = 2СО2, 2SО2 + О2 = 2SО3.
2. Гідридами неметалів:
4NH3 + 5O2 ![]() 4NO + 6H2O,
4NO + 6H2O,
4NH3 + 3O2 = 2N2 + 6H2O, 2H2S + 3O2 = 2SO2 + 2H2O.
3. Сульфідами:
2ZnS + 3O2 = 2ZnO + 2SO2, 4FeS2 + 11O2 = 2Fe2O3 + 8SO2.
4. Органічними речовинами:
СH4 + 2O2 = CO2 + 2H2O.
Застосування кисню.
Кисень відіграє велику роль у життєдіяльності людини. Він підтримує процеси дихання та горіння. На підводних човнах і космічних кораблях кисень використовують для життєзабезпечення людей, у медицині – для полегшення дихання хворих.
У промисловості кисень застосовують для випалювання руд металів при одержанні чавуну і сталі. Кисень застосовують як окисник органічних речовин, у виробництві нітратної кислоти з амоніаку та сульфатної кислоти з піриту тощо.
При горінні багатьох газів (Н2, С2Н2) виділяється багато теплоти, що використовують для зварювання і різання металів.
Озон
Озон відкрив швейцарський хімік Х. Шенбайн (1799 – 1868 рр.).
Будову молекули озону можна представити формулою:
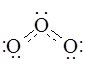
Ступінь окиснення Оксигену в озоні +4 та –2 (О+4О–22).
Одержують озон в озонаторах дією електричного струму, робота їх базується на реакції:
3О2 ↔ 2О3.
Вихід озону – 10%.
В атмосфері озон утворюється з кисню під час грози, на висоті 20 – 30 км під дією УФ-світла. При повільному окисненні смоли хвойних дерев утворюється озон, тому в хвойних лісах, як і під час грози, відчувається запах озону. На висоті 25 – 28 км над Землею розміщений озоновий шар товщиною до 5 км, що захищає планету від УФ-опромінення сонця і затримує ІЧ-промені від Землі, запобігаючи її охолодженню.
Озон утворюється при роботі копіювальних приладів (“ксероксів”) і при тривалому вдиханні порушує репродуктивну функцію чоловіків.
Озон – важкий газ, синього кольору (температура кипіння –110 0С) з різким запахом, у високій концентрації – отруйний.
Озон – сильний окисник за рахунок утворення при розкладі атомарного кисню:
О3 = О2 + О·; 2О· = О2,
окиснює навіть срібло, золото і платинові метали з утворенням пероксидів:
2Ag + 3O2 = Ag2O2 + 2O2.
З лужними металами утворює яскраво забарвлені озоніди:
К + О3 = КО3.
Якісною реакцією на О3 є взаємодія з розчинами йодидів:
2КІ + О3 + Н2О = 2КОН + І2 +О2.
За рахунок виділення молекулярного йоду, розчин забарвлюється у бурий колір.
Озон використовують для відбілювання матеріалів, дезинфекції води та повітря, очистки димових газів і стічних вод.