17. ЕЛЕМЕНТИ VIА ГРУПИ. ЗАГАЛЬНА ХАРАКТЕРИСТИКА ХАЛЬКОГЕНІВ
17. ЕЛЕМЕНТИ VIА ГРУПИ. ЗАГАЛЬНА ХАРАКТЕРИСТИКА ХАЛЬКОГЕНІВ
17.4. Гідроген пероксид. Пероксиди
Ще однією сполукою Оксигену з Гідрогеном є гідроген пероксид (перекис водню), у якому ступінь окиснення Оксигену становить –1. Атоми Гідрогену в молекулі Н2О2 лежать у двох площинах, атоми Оксигену зв’язані σ-зв’язком (рис. 17.4). Молекула гідроген пероксиду сильно полярна, що веде до утворення водневих зв’язків.
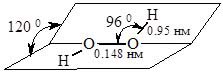
Рис. 17.4. Молекула гідроген пероксиду
Фізичні властивості.
За н. у. гідроген пероксид – безбарвна рідина з характерним запахом. Густина 1,04 г/см3, температура кипіння 152 0С. Необмежено розчинний у воді з утворенням стійких розчинів, однак при нагріванні або дії світла гідроген пероксид розкладається.
У лабораторії H2O2 одержують дією сульфатної кислоти на твердий барій пероксид BaO2:
BaO2 + H2SO4= H2O2 +BaSO4↓.
У промисловості H2O2 одержують анодним окисненням сульфатної кислоти з подальшим гідролізом утвореного продукту:
2H2SO4 – 2е = H2S2O8 + 2Н+,
H2S2O8 + 2Н2О = 2H2SO4 + H2O2.
Хімічні властивості.
1. Зв’язок О–О слабкий, при кімнатній температурі гідроген пероксид розкладається за реакцією диспропорціювання:
2H2O2 = 2H2O + O2.
Реакцію прискорює каталітична кількість MnO2.
2. Кислотні властивості:
2H2O2 = 2H+ + O22–.
- Реагує з основами з утворенням пероксидів:
H2O2 + Ba(OH)2 = 2H2O +BaO2↓.
4. Відновні властивості:
H2O2 + Ag2O = H2O + O2 + 2Ag.
5. Окисні властивості:
H2O2 + NaNO2 = H2O + KNO3, 4H2O2 + PbS = 4H2O + PbSO4.
Останню реакцію використовують для реставрації написаних масляними фарбами почорнілих картин (відновлення чорного PbS до білого PbSO4).
Використовують H2O2 для відбілювання тканин, хутра, паперу, дезинфекції (30% водний розчин – пергідроль), або 3% розчин як дезинфікуючий засіб у медицині.