17. ЕЛЕМЕНТИ VIА ГРУПИ. ЗАГАЛЬНА ХАРАКТЕРИСТИКА ХАЛЬКОГЕНІВ
17. ЕЛЕМЕНТИ VIА ГРУПИ. ЗАГАЛЬНА ХАРАКТЕРИСТИКА ХАЛЬКОГЕНІВ
17.8. Сульфатна кислота. Сульфати
Сульфатна кислота вперше описана у XIV ст. в Іспанії.
У сульфатній кислоті H2SO4, атом Cульфуру виявляє максимальний ступінь окиснення +6. Просторова структура H2SO4 – тетраедрична молекула (кут OSO = 120 0):
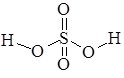
Старі назви сульфатної кислоти – сірчана кислота, купоросне масло.
Одержання.
У промисловості використовують контактний спосіб одержання сульфатної кислоти.
Раніше у промисловості використовували нітрозний спосіб:
SO2 + NO2 + H2O = H2SO4 + NO, NO + O2 = NO2.
Фізичні властивості.
Безводна сульфатна кислота – безбарвна масляниста рідина, при 10,3 0С кристалізується. Густина – 1,84 г/см3. Добре розчинна у воді (за рахунок хімічної взаємодії).
Хімічні властивості.
1. Концентрована H2SO4 – сильний окисник. При нагріванні реагує з усіма металами з утворенням сульфатів і різних продуктів відновлення сульфуру (H2S, S, SO2). Водень при цьому не утворюється:
4Mg + 5H2SO4 = 4MgSO4 + H2S + 4H2O,
3Zn + 4H2SO4 = 3ZnSO4 + S + 4H2O, Cu + 2H2SO4 = CuSO4 + SO2+ 2H2O.
Гідроген сульфід та сірка утворюються у реакціях з активними металами, а SO2 – з малоактивними.
Безводна сульфатна кислота не реагує із залізом внаслідок пасивації металу (утворюється FeSO4, який не розчиняється у сульфатній кислоті і перешкоджає подальшій реакції). Цю властивість використовують для перевезення концентрованої сульфатної кислоти у залізній тарі. Концентрована сульфатна кислота пасивує також Al, Ni, Cr, Ti.
2. Концентрована сульфатна кислота окиснює багато неметалів, відновлюючись при цьому до SO2:
S + 2H2SO4 = SO2 + 2H2O, C + 2H2SO4 = CO2 + SO2 + 2H2O
3. Окиснює броміди та йодиди до вільних галогенів:
8HI + H2SO4 =4I2 + H2S + 4H2O,
2KBr + 2H2SO4 = Br2 + SO2 + K2SO4 + 2H2O.
4. Взаємодія сульфатної кислоти з водою веде до утворення гідратів:
nH2O + H2SO4 = nH2O∙H2SO4.
Реакція супроводжується виділенням великої кількості теплоти. Для розбавлення сульфатної кислоти слід повільно приливати кислоту до води (а не навпаки), енергійно перемішуючи розчин для запобігання викидання кислоти з посудини.
5. Концентрована сульфатна кислота відбирає воду від органічних сполук:
C12H22O11 + H2SO4 = 12C + H2SO4∙11H2O,
2C2H5OH + H2SO4 = (C2H5)2O + H2SO4∙H2O
6. Безводна сульфатна кислота практично не дисоціює і є слабкою кислотою.
7. У водному розчині сульфатна кислота – сильна двоосновна кислота, виявляє усі характерні властивості кислот.
Розбавлена H2SO4 реагує з багатьма металами (крім Cu, Ag, Au, Pt), оксидами, основами, солями з утворенням солей – сульфатів (середніх Na2SO4) та гідрогенсульфатів (кислих KHSO4).
Сульфати добре розчинні у воді (крім CaSO4, BaSO4, SrSO4, PbSO4, Ag2SO4), виявляють типові властивості солей.
Реакція утворення нерозчинного у воді та у мінеральних кислотах BaSO4 широко використовується для виявлення катіонів Ba2+ та аніонів SO42– і є якісною на них.
Кристалогідрати сульфатів називають купоросами.
Сульфати термодинамічно стійкі, при нагріванні не розкладаються (крім FeSO4):
2FeSO4(тв.) ![]() Fe2O3 + SO3 + SO2.
Fe2O3 + SO3 + SO2.
Застосування.
Сульфатну кислоту використовують у виробництві мінеральних добрив, волокон, пластмас, барвників, вибухових речовин, як осушувач газів.
Широко застосовують сульфати.
Глауберова сіль (Na2SO4∙10H2O), мірабіліт (лат. sal mirabile – чудова сіль), яку вперше добув І. Глаубер у XVII ст., виявляє сильну послаблюючу дію.
Магній сульфат MgSO4∙7H2O використовують у медицині як антидот (протиотруту) при алкогольному сп’янінні під назвою “гірка сіль”.
Гіпс (CaSO4∙2H2O) використовують у будівництві, медицині. При прожарюванні гіпсу утворюється алебастр – важливий будівельний матеріал:
2CaSO4∙4H2O = 2CaSO4∙H2O + 3H2O.
Мідний (CuSO4∙5H2O) і залізний (FeSO4∙7H2O) купороси використовують у сільському господарстві для боротьби з шкідниками.
Подвійні сульфати (галуни) – алюмокалієвий галун KAl(SO4)2∙12H2O, залізоамонійний галун NH4Fe(SO4)2∙12H2O – використовують як дубильні речовини при обробці шкіри.