19. ЕЛЕМЕНТИ IVА ГРУПИ. ЗАГАЛЬНА ХАРАКТЕРИСТИКА
19. ЕЛЕМЕНТИ IVА ГРУПИ. ЗАГАЛЬНА ХАРАКТЕРИСТИКА
19.1. Карбон. Вуглець
Карбон – перший елемент IVА підгрупи. Проста речовина існує у формі кількох алотропних модифікацій: алмаз, графіт, карбін.
Алмаз – прозора кристалічна речовина. У кристалічній гратці алмазу (рис. 19.1, а) атомні орбіталі Карбону перебувають у стані sp3-гібридизації і утворюють чотири міцні ковалентні зв’язки. Така будова зумовлює високу твердість і хімічну стійкість алмазу. Алмаз не проводить електричний стум.
При нагріванні до 800 0С в атмосфері кисню алмаз згорає до СО2. Спаливши алмаз, А. Лавуазьє (Англія) у 1772 р. довів, що алмаз складається з Карбону.
Без доступу повітря утворює іншу алотропну модифікацію Карбону – графіт.
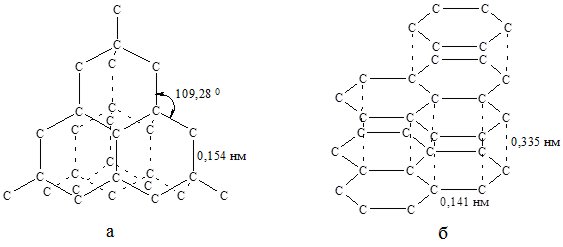
Рис. 19.1. Кристалічні гратки алмазу (а) і графіту (б).
Графіт – сіро-чорна речовина з металічним блиском. Дуже м`який, добре проводить електричний струм, тугоплавкий, хімічно інертний матеріал. У графіту шарувата кристалічна гратка (рис. 19.1, б). Зв’язки між атомами Карбону в межах одного шару міцні, між шарами – слабкі. Гібридизація атомів карбону у молекулі графіту sp2.
Карбін – чорна дрібнокристалічна речовина, в природі не існує, її штучно одержують при дегідратації ацетилену НC≡CH при 1000 0С у присутності Cu2+. Атоми Карбону перебувають у стані sp-гібридизації. Це – напівпровідник.
Існують α-карбін або поліїн зі структурою –C≡C–C≡C– та β‑карбін (полікумулен), його структура =С=С=С=С=.
Нещодавно відкрита ще одна модифікація Карбону – фулерен – сферичні поверхні, що містять від 60 до 84 атомів Карбону.
Поширення у природі.
У природі у вільному стані Карбон зустрічається у формі алмазу та графіту. Вугілля, сажа, кокс – форми існування графіту.
У мінералах Карбон міститься у складі кальциту СаСО3, доломіту CaCO3×MgCO3 і магнезиті MgCO3.
Карбон входить до складу живої матерії, як основний структурний елемент усіх органічних речовин.
Фізичні властивості.
У будь-якій алотропній формі вуглець не має смаку і запаху, тугоплавкий і нерозчинний у воді та органічних розчинниках (крім фулеренів).
Графіт у формі вугілля завдяки пористій будові має високу адсорбційну здатність.
Адсорбція – концентрування різних речовин на поверхні поділу фаз (тверда-рідка, тверда-газова, рідка-газова, рідка-рідка).
Речовина, яка утримує на своїй поверхні частинки називається адсорбентом, речовина, яка утримується – адсорбатом.
Найвищу адсорбційну здатність має активоване вугілля, в якому спеціально очищають пори. Активоване вугілля використовують для очистки повітря в протигазах, видалення отруйних речовин з організму людини, очищення води тощо.
Хімічні властивості Карбону розглянемо на прикладі графіту.
За звичайної температури графіт хімічно інертний. При нагріванні реагує з неметалами (H2, F2, O2, N, S), металами, оксидами, кислотами.
І. З простими речовинами:
1. Безпосередньо реагує лише з фтором (з іншими галогенами не реагує):
C + 2F2 = CF4.
2. У реакції з киснем можливе утворення двох оксидів.
При нестачі кисню утворюється карбон (IІ) оксид:
який згоряє у надлишку кисню:
2CO + O2 = 2CO.
3. З сіркою реакція відбувається при 1000 0С:
C + 2S = CS2.
Сірковуглець CS2 розчиняє багатьох речовин.
4. При дії електричного розряду на суміш графіту та азоту утворюється диціан (CN)2 або C2N2:
Диціан називають псевдогалогеном. При взаємодії з воднем утворюється ціановодень (водні розчини – синильна кислота):
(CN)2 + Н2О = НCN.
Синильна кислота та її солі – ціаніди – сильні отрути.
5. За високої температури або наявності каталізатора (Ni/Pt) реагує з воднем з утворенням вуглеводнів:
C + 2H2 = CH4 (600 –
Ці сполуки розглянуто в розд. Органічна хімія.
6. З кремнієм при нагріванні утворюється карбід силіцію:
C + Si = SiC.
7. З металами при нагріванні утворює карбіди:
Карбіди бувають солеподібні (типу метану (Al4C3, Be2C) і типу ацетилену (CaC2)), ковалентні (SiC, B4C3) і металоподібні (Fe3C тощо).
При дії води або кислот на карбіди типу метану виділяється метан:
Al4C3 + 12H2O = 4Al(OH)3 + 3CH4, Al4C3 + 12HCl = 4AlCl3 + 3CH4.
Карбіди типу ацетилену утворюють ацетилен:
CaC2 + 2H2O = Ca(OH)2 + C2H2, CaC2 + 2HCl = CaCl2 + C2H2.
Ковалентні карбіди – хімічно інертні, дуже тверді речовини.
Металоподібні карбіди – тверді жаростійкі речовини, під дією кислот утворюють метан і водень:
Fe3C + 6HCl = 3FeCl2 + CH4 + H2.
ІІ. Зі складними речовинами.
1. Окиснюється концентрованою сульфатною або нітратною кислотами при 100 0С до СО2:
C + 2H2SO4к. = CO2 + 2SO2 + 2H2O,
C + 4HNO3к. = CO2 + 4NO2 + 2H2O.
2. Відновлює оксиди металів і неметалів:
FeO + C = Fe + CO, SiO2 +
Іноді при цьому утворюються карбіди:
2Al2O3 +
Метод відновлення оксидів вугіллям у металургії називають карботермією (див. Добування металів).
3. Розпечений до червоного кольору вуглець реагує з парою води:
C + H2O = CO + H2.
Утворюється водяний газ.
Застосування.
Алмаз застосовують у виготовленні шліфувальних матеріалів, прикрас, для різання скла, виготовлення прикрас – діамантів. Графіт застосовують для виготовлення графітових стержнів олівців, змазок і мастил завдяки легкості його розшарування. Графіт, будучи електропровідним, є хорошим матеріалом для виготовлення електродів.
Кам’яне вугілля використовують як паливо, адсорбент, відновник при виробництві фосфору з фосфориту, чорного пороху, у металургії (карботермія).