19. ЕЛЕМЕНТИ IVА ГРУПИ. ЗАГАЛЬНА ХАРАКТЕРИСТИКА
19. ЕЛЕМЕНТИ IVА ГРУПИ. ЗАГАЛЬНА ХАРАКТЕРИСТИКА
19.4. Силіцій. Кремній
Силіцій (лат. silex – кремінь) Si – типовий неметал і найближчий електронний аналог Карбону; знаходиться у IVА підгрупі ІІІ періоду Періодичної системи. Електронна структура зовнішнього енергетичного рівня атома Силіцію 3s23p23d0:
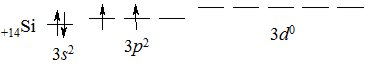
У сполуках з Оксигеном і неметалами виявляє ступінь окиснення +4 (рідше +2), у сполуках з Гідрогеном –2. Найстійкіший ступінь окиснення +4. У зв’язку зі зростанням атомного радіуса, порівняно з Карбоном, у Силіцію зменшується міцність міжатомних зв’язків, особливо в гомоатомних ланцюгах. На відміну від Карбону, Силіцій практично не утворює кратних зв’язків.
Відомі аморфний і кристалічний кремній, які відрізняються зовнішнім виглядом і властивостями, проте не є алотропними модифікаціями.
Вперше силіцій добув Й. Берцеліус (Швеція) у 1824 р.
Поширення у природі.
Силіцій – другий за поширенням елемент після Оксигену (27,6 % за масою) у Земній корі.
В природі Силіцій перебуває лише у зв’язаному стані: у вигляді силіцій діоксиду SiO2 (силікатний ангідрид, кремнезем) і у вигляді солей силікатних кислот – силікатів. Чистий SiO2 – гірський кришталь, кварц, забарвлений домішками оксидів металів – агат, аметист, яшма.
Найпоширеніші алюмосилікати: біла глина Al2O3×2SiO2×2H2O, польовий шпат K2O×Al2O3×6SiO2, слюда K2O×Al2O3×6SiO2×H2O.
Багато силікатів у чистому вигляді є дорогоцінними каменями – аквамарин, топаз, ізумруд.
Як Карбон, входячи до складу усіх живих речовин, є найважливішим елементом живої природи, так Силіцій – основний елемент неживої природи. Більшість гірських порід містять сполуки Силіцію: граніт, глини, пісок.
У живій природі Силіцій міститься у діатомових водоростях, хвощах, кремнієвих губках, іноді входить до складу пір’я, шерсті.
Одержання.
Кремній одержують прожарюванням білого піску SiO2 з магнієм:
SiO2 + 2Mg = Si + 2MgO.
При цьому утворюється аморфний кремній у вигляді білого порошку. Кристалізацією аморфного кремнію добувають кристалічний кремній з металічним блиском.
У промисловості кристалічний кремній одержують відновленням SiO2 в електропечах:
SiO2 + C = Si + CO2.
Найчистіший кремній добувають за реакціями:
SiCl4 + 2Zn = Si + 2ZnCl2, SiH4 = Si + 2H2.
Фізичні властивості.
Аморфний кремній – бурий порошок з т. пл. 1420 0С, неелектропровідний.
Кристалічний кремній – тверда речовина сірого кольору з металічним блиском, тепло- і електропровідний. Напівпровідникові властивості обумовлені будовою кристалу, яка аналогічна алмазу. Проте зв’язки в кристалі значно слабкіші, ніж в алмазу і за н.у. частина з них розірвані, а тому в кристалі є вільні електрони, наявність яких і зумовлює незначну тепло- і електропровідність. При нагріванні розривається більше зв’язків, тому тепло- і електропровідність зростає.
Хімічні властивості.
За н.у. кремній – інертний елемент, за кімнатної температури реагує лише з фтором:
Si + 2F2 = SiF2.
При високих температурах реагує практично з усіма неметалами (C, O2, S, N2, Cl2, Br2) з утворенням відповідних бінарних сполук:
Si + C = SiC, 3Si + 2N2 = Si3N4, Si + O2 = SiO2,
Si + 2S = SiS2, Si + 2Cl2 = SiCl4.
Галогеніди кремнію гідролізують у водних розчинах лугів:
6SiF4 + 12NaOH = 4Na2SiF6 + 2Na2SiO3 + 6H2O.
Кремній не реагує з кислотами і водою, розчиняється лише у суміші HF і HNO3:
3Si + 12HF + 4HNO3 = 3SiF4 + 4NO + 8H2O,
та у розчинах лугів:
Si + 2KOH + H2O = K2SiO3 + 2H2.
У цих реакціях Силіцій – відновник.
При сплавленні з металами кремній утворює силіциди, виступаючи при цьому окисником:
2Mg + Si = Mg2Si.
При дії хлоридної кислоти на Mg2Si утворюється силан:
Mg2Si + 4HCl = 2MgCl2 + SiH4.
Силан SiH4 – безбарвний отруйний газ, самозаймається на повітрі:
SiH4 + 2О2 = SiО2 + 2Н2О.
Застосування.
У техніці кремній використовують для виготовлення напівпровідників. Сплав заліза з кремнієм (феросиліцій) використовують у виготовленні деталей заводської жаро- та хімічностійкої апаратури.
Високотвердий сплав кремнію з графітом – карборунд – з кристалічною граткою алмазу використовують для виготовлення наждачного паперу і точильних кругів. Відкрив карборунд випадково Е. Ачесон (США) (1856 – 1931) при спробі добути алмаз шляхом нагрівання вугілля у присутності глини при високій температурі.
Натрій гексафторосилікат Na2SiF6 – отруйна речовина, використовують як інсектицид (отрута для боротьби з комахами).
Фторосилікати магнію, цинку, алюмінію використовують у будівництві для створення водонепроникного шару на поверхні будматеріалів.